उपसहसंयोजक यौगिक
Subject Hub
सामान्य Learning Resources
योगात्मक यौगिक :
ये दो या अधिक स्थिर यौगिकों की स्टॉइकियोमेट्रिक अनुपात में संयोजन से बनते हैं। ये हैं
(1) द्विक लवण
(2) उपसहसंयोजन यौगिक
द्विक लवण :
वे योगात्मक यौगिक जो विलयन में अपनी पहचान खो देते हैं उदाहरण- $K_{2}SO_{4}$, $Al_{2}(SO_{4})_{3}$
उपसहसंयोजन यौगिक :
वे योगात्मक यौगिक जो विलयन में अपनी पहचान बनाए रखते हैं (अर्थात् अपनी पहचान नहीं खोते)।
$Fe(CN)_{2}$ + 4KCN $\rightarrow$ $Fe(CN)_2.4KCN$
$k_4[Fe(CN)_6] (aq)$ $ \rightleftharpoons $ $4k^+(aq)$ + $[Fe(CN)_6]^{4-}(aq)$
केन्द्रीय परमाणु/आयन :
एक उपसहसंयोजन इकाई में, वह परमाणु/आयन जिसके चारों ओर निश्चित संख्या में लिगेंड निश्चित ज्यामितीय व्यवस्था में बंधे होते हैं।
लिगेंड :
वे उदासीन अणु, ऋणायन या धनायन जो उपसहसंयोजन इकाई में केन्द्रीय धातु परमाणु या आयन के साथ सीधे जुड़े होते हैं, लिगेंड कहलाते हैं।
कीलेट लिगेंड :
कीलेट लिगेंड एक द्वि- या बहु-दात्री लिगेंड होता है जो अपने दो या अधिक दाता परमाणुओं का उपयोग एकल धातु आयन से बांधने के लिए करता है, जिससे एक वलय बनता है।
द्विदात्री लिगेंड :
वे लिगेंड जो इसमें उपस्थित दो भिन्न परमाणुओं के माध्यम से लिगेशन कर सकते हैं
$ M \leftarrow O-N=O $
$\mathrm{M} \leftarrow \mathrm{SCN}$ थायोसायनेटो या थायोसायनेटो-S ;
$\mathrm{M} \leftarrow \mathrm{NCS}$ आइसोथायोसायनेटो या थायोसायनेटो- $\mathrm{N}$
समन्वय संख्या :
धातु से सीधे जुड़े लिगंड दाता परमाणुओं की संख्या।
केंद्रीय परमाणु की ऑक्सीकरण संख्या :
केंद्रीय परमाणु की ऑक्सीकरण संख्या को वह आवेश माना जाता है जो उस पर होगा यदि सभी लिगंडों को केंद्रीय परमाणु के साथ साझा किए गए इलेक्ट्रॉन युगलों सहित हटा दिया जाए। $\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]^{3-}$ में यह +3 है और इसे $\mathrm{Fe}(\mathrm{III})$ लिखा जाता है।
दंतिकता और क्लेशन :
तालिका : 1
सामान्य एकदंत लिगंड
तालिका : 2
सामान्य क्लेटिंग एमीन
तालिका : 3
सामान्य बहु-दंत (क्लेटिंग) लिगंड
होमोलीप्टिक और हेटरोलीप्टिक संकुल
-
संकुल जिनमें धातु केवल एक प्रकार के दाता समूहों से बंधित होती है, उदाहरण के लिए, $[Cr(NH_3)_6]^{3+}$, होमोलीप्टिक कहलाते हैं।
-
जटिल यौगिक जिनमें एक धातु एक से अधिक प्रकार के दाता समूहों से बंधित होता है, उदाहरण के लिए, $[Co(NH_3)_4Br_2]^+$, को हेटरोलेप्टिक कहा जाता है।
समन्वय यौगिकों का नामकरण
एककेन्द्रक समन्वय इकाइयों के सूत्र लिखना
(i) केंद्रीय परमाणु को सबसे पहले रखा जाता है।
(ii) फिर लिगेंडों को वर्णानुक्रम में रखा जाता है। लिगेंड की सूची में स्थान इसके आवेश पर निर्भर नहीं करता है।
(iii) बहुदंत लिगेंडों को भी वर्णानुक्रम में रखा जाता है। संक्षिप्त लिगेंड के मामले में, संक्षिप्त नाम का पहला अक्षर वर्णानुक्रम में स्थान निर्धारित करने के लिए प्रयुक्त होता है।
(iv) संपूर्ण समन्वय इकाई का सूत्र, चाहे आवेशयुक्त हो या नहीं, वर्ग कोष्ठकों में लिखा जाता है। जब लिगेंड बहुपरमाणवीय होते हैं, तो उनके सूत्र कोष्ठकों में लिखे जाते हैं। लिगेंडों के संक्षिप्त नाम भी कोष्ठकों में लिखे जाते हैं।
(v) समन्वय क्षेत्र के भीतर लिगेंडों और धातु के बीच कोई रिक्त स्थान नहीं होना चाहिए।
(vi) आवेशयुक्त समन्वय इकाई का सूत्र प्रतिआयन के सूत्र के बिना लिखा जाता है; आवेश को वर्ग कोष्ठकों के बाहर दाहिने ऊपर अनुस्वरूप संख्या के साथ दर्शाया जाता है। उदाहरण के लिए, $[Co(H_2O)_6]^{3+}$, $[Fe(CN)_6]^{3-}$ आदि।
(vii) धनायन(ों) का आवेश ऋणायन(ों) के आवेश से संतुलित होता है।
एककेन्द्रक समन्वय यौगिकों के नाम लिखना:
(i) साधारण लवणों की तरह, धनायन वाली और ऋणायन वाली दोनों समन्वय इकाइयों में पहले धनायन का नाम लिखा जाता है।
(ii) लिगेंड्स को मध्य परमाणु/आयन के नाम से पहले वर्णमाला क्रम में नामित किया जाता है (उपसर्ग नहीं, लिगेंड के नाम के अनुसार)।
(iii) ऋणायनिक लिगेंड्स के नाम -o से समाप्त होते हैं और उदासीन लिगेंड्स के नाम वही रहते हैं, सिवाय $H_2O$ के लिए एक्वा, $NH_3$ के लिए अमीन, CO के लिए कार्बोनिल, CS के लिए थायोकार्बोनिल और NO के लिए नाइट्रोसिल के। पर धनायनिक लिगेंड्स के नाम -ium से समाप्त होते हैं।
(iv) उपसर्ग mono, di, tri आदि का प्रयोग समन्वय इकाई में एक प्रकार के लिगेंड्स की संख्या दर्शाने के लिए किया जाता है। जब लिगेंड्स के नामों में कोई संख्यात्मक उपसर्ग हो या वे जटिल हों या जब सामान्य उपसर्गों के प्रयोग से कोई भ्रम पैदा हो, तो उसे कोष्ठक में रखा जाता है और दूसरे सेट के उपसर्गों का प्रयोग किया जाता है।
(v) धनायन, ऋणायन या उदासीन समन्वय इकाई में धातु की ऑक्सीकरण अवस्था को धातु के नाम के बाद कोष्ठक में रोमन अंकों द्वारा दर्शाया जाता है।
(vi) यदि संकुल आयन धनायन है, तो धातु का नाम तत्व के समान रखा जाता है। उदाहरण के लिए, धनायन संकुल में $\mathrm{Co}$ को कोबाल्ट और $\mathrm{Pt}$ को प्लैटिनम कहा जाता है। यदि संकुल आयन ऋणायन है, तो धातु के नाम में -ate प्रत्यय जोड़ा जाता है। उदाहरण के लिए, ऋणायन संकुल $[Co(SCN)_4]^{2-}$ में Co को कोबाल्टेट कहा जाता है। कुछ धातुओं के लिए संकुल ऋणायनों में लैटिन नामों का प्रयोग किया जाता है।
(vii) उदासीन संकुल अणु का नाम उसी प्रकार रखा जाता है जैसे धनायन संकुल का।
वर्नर का सिद्धांत :
वर्नर के अनुसार अधिकांश तत्व दो प्रकार की संयोजकताएँ प्रदर्शित करते हैं :
(a) प्राथमिक संयोजकता
(b) द्वितीयक संयोजकता।
(a) प्राथमिक संयोजकता :
यह धातु आयन की ऑक्सीकरण अवस्था के अनुरूप होती है। इसे मुख्य, आयननशील या आयनिक संयोजकता भी कहा जाता है। इसे ऋणात्मक आयनों द्वारा संतुष्ट किया जाता है और इसका केंद्रीय धातु आयन से संबंध बिंदीदार रेखाओं द्वारा दिखाया जाता है।
(b) द्वितीयक या सहायक संयोजकता :
इसे केंद्रीय धातु आयन की समन्वय संख्या (सामान्यतः $\mathrm{CN}$ से संक्षिप्त) भी कहा जाता है। यह अनायनिक या अनायननशील होती है (अर्थात् समन्वय सहसंयोजक बंध प्रकार)। आधुनिक पारिभाषिकी में ऐसी स्थानिक व्यवस्थाओं को समन्वय बहुपाश्व कहा जाता है और विभिन्न संभावनाएँ हैं
C.N. $=2$ रेखीय
C.N. $=3$ त्रिकोणीय
C.N. $=4$ चतुष्फलकीय या वर्ग समतलीय
C.N. $=6$ अष्टफलकीय।
सिजविक द्वारा दिया गया प्रभावी परमाणु संख्या नियम :
प्रभावी परमाणु संख्या (EAN) = केंद्रीय धातु की परमाणु संख्या - केंद्रीय धातु की ऑक्सीकरण अवस्था + लिगैंडों द्वारा दान किए गए इलेक्ट्रॉनों की संख्या।
वेलेंस बॉन्ड सिद्धांत :
इस मॉडल में धातु परमाणु या आयन के $(n-1) d, n s, n p$ या $n s, n p, n d$ कक्षकों के संकरण का उपयोग किया जाता है ताकि निश्चित ज्यामिति के समतुल्य कक्षकों का एक समूह प्राप्त हो सके, जिससे समन्वय यौगिकों में प्रेक्षित षट्फलाकार, वर्ग समतलीय और चतुष्फलाकार संरचनाओं और चुंबकीय गुणों की व्याख्या की जा सके। अयुग्मित इलेक्ट्रॉनों की संख्या, जिसे यौगिकों के चुंबकीय आघूर्ण द्वारा मापा जाता है, यह निर्धारित करती है कि कौन-से d-कक्षक प्रयुक्त होते हैं।
सारणी :
समन्वय संख्या छः :
- प्रतिचुंबकीय षट्फलाकर समन्वय यौगिक $[Co(NH_3)_6]^{3+}$ में कोबाल्ट आयन +3 ऑक्सीकरण अवस्था में है और इसका इलेक्ट्रॉनिक विन्यास नीचे दिखाए अनुसार है।
$Co(NH_3)_6^{3+}$
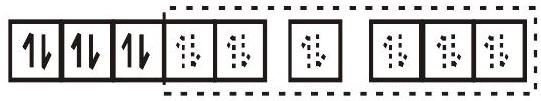
$\mathrm{d}^{2} \mathrm{sp}^{3}$ संकर कक्षक
- समन्वय यौगिक $\left[\mathrm{FeF}_{6}\right]^{4-}$ अनुचुंबकीय है और इसमें बाह्य कक्षक (4d) का उपयोग संकरण $\left(\mathrm{sp}^{3} \mathrm{~d}^{2}\right)$ में होता है; इसे इसलिए बाह्य कक्षक या उच्च स्पिन या स्पिन मुक्त समन्वय यौगिक कहा जाता है। इसलिए,
$\left[\mathrm{FeF}_{6}\right]^{4-}$
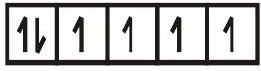

$\mathrm{sp}^{3} \mathrm{~d}^{2}$ संकर कक्ष
समन्वय संख्या चार:
- अनुचुंबकीय और चतुष्फलकीय संकुल $\left[\mathrm{NiCl}_{4}\right]^{2-}$ में, निकल +2 ऑक्सीकरण अवस्था में है और आयन का इलेक्ट्रॉनिक विन्यास $3 \mathrm{~d}^{8}$ है। संकरण योजना चित्र में दिखाए अनुसार है।
$\left[\mathrm{NiCl}_{4}\right]^{2-}$

$\mathrm{sp}^{3}$ संकर कक्ष
- इसी प्रकार संकुल $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$ का ज्यामिति चतुष्फलकीय है और यह अनुचुंबकीय है क्योंकि इसमें कोई अयुग्मित इलेक्ट्रॉन नहीं हैं। संकरण योजना चित्र में दिखाए अनुसार है।
$\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$
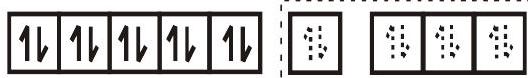
$\mathrm{sp}^{3}$ संकर कक्ष
- $\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$ के लिए संकरण योजना चित्र में दिखाए अनुसार है।
$\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$
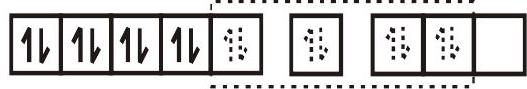
$\mathrm{dsp}^{2}$ संकर कक्षक
VBT में निम्नलिखित कमियाँ हैं :
-
इसमें कई मान्यताएँ शामिल होती हैं।
-
चुंबकीय आँकड़ों की कोई मात्रात्मक व्याख्या नहीं है।
-
यह समन्वय यौगिकों के स्पेक्ट्रल (रंग) गुणों के बारे में कुछ नहीं कहता है।
-
यह समन्वय यौगिकों की ऊष्मागतिकीय या गतिक स्थिरताओं की मात्रात्मक व्याख्या नहीं देता है।
-
यह 4-समन्वय वाले संकुलों के चतुष्फलकीय और वर्ग-समतलीय संरचनाओं के बारे में सटीक भविष्यवाणियाँ नहीं करता है।
-
यह प्रबल और दुर्बल लिगेंडों के बीच भेद नहीं करता है।
समन्वय यौगिकों की चुंबकीय गुणधर्म :
चुंबकीय आघूर्ण $= \sqrt{n(n+2)}$ बोर मैग्नेटॉन;
n = अयुग्मित इलेक्ट्रॉनों की संख्या।
d-कक्षकों में अधिकतम तीन इलेक्ट्रॉन वाले धातु आयनों जैसे $\mathrm{Ti}^{3+},\left(\mathrm{d}^{1}\right) ; \mathrm{V}^{3+}$ $\left(d^{2}\right) ; \mathrm{Cr}^{3+}\left(d^{3}\right)$ के लिए, ऑक्टाहेड्रल संकरण के लिए आसानी से दो रिक्त d-कक्षक उपलब्ध होते हैं। इन मुक्त आयनों और उनके उपसहसंयोजी संस्थाओं का चुंबकीय व्यवहार समान होता है। जब तीन से अधिक 3d इलेक्ट्रॉन मौजूद होते हैं, जैसे $\mathrm{Cr}^{2+}$ और $\mathrm{Mn}^{3+}\left(\mathrm{d}^{4}\right) ; \mathrm{Mn}^{2+}$ और $\mathrm{Fe}^{3+}\left(\mathrm{d}^{5}\right) ; \mathrm{Fe}^{2+}$ और $\mathrm{Co}^{3+}\left(\mathrm{d}^{6}\right)$ में; संकरण के लिए आवश्यक दो रिक्त कक्षक सीधे उपलब्ध नहीं होते हैं (हुंड के नियमों के परिणामस्वरूप)।
इस प्रकार, $d^{4}, d^{5}$ और $d^{6}$ स्थितियों के लिए, संकरण के लिए दो रिक्त d कक्षक केवल 3d इलेक्ट्रॉनों के युग्मन के परिणामस्वरूप उपलब्ध होते हैं, जिससे क्रमशः दो, एक और शून्य अयुग्मित इलेक्ट्रॉन शेष रहते हैं।
क्रिस्टल फील्ड सिद्धांत :
क्रिस्टल फील्ड सिद्धांत (CFT) एक विद्युतस्थैतिक मॉडल है जो धातु-लिगंड बंध को आयनिक मानता है जो केवल धातु आयन और लिगंड के बीच विद्युतस्थैतिक अन्योन्यक्रिया से उत्पन्न होता है।
(a) ऑक्टाहेड्रल उपसहसंयोजी संस्थाओं में क्रिस्टल फील्ड विपाटन :
ऑक्टाहेड्रल संकुल में क्रिस्टल फील्ड विपाटन को दर्शाता आकृति।
क्रिस्टल क्षेत्र विभाजन, $\Delta_{o}$, लिगेंड द्वारा उत्पन्न क्षेत्रों और धातु आयन पर आवेश पर निर्भर करता है। लिगेंड को बढ़ते हुए क्षेत्र सामर्थ्य के क्रम में नीचे दी गई श्रृंखला में व्यवस्थित किया जा सकता है :
$I^{-}$ < $Br^{-}$ < $SCN^{-}$ < $Cl^{-}$ < $S^{2-}$ < $F^{-}$ < $OH^{-}$ < $C_{2}O_{4}^{2-}$ < $H_{2}O$ < $NCS^{-}$ < $edta^{4-}$ < $NH_{3}$ < en < $NO_{2-}$ < $CN^{-}$ < CO
इस प्रकार की श्रृंखला को स्पेक्ट्रोकेमिकल श्रृंखला कहा जाता है। यह एक प्रायोगिक रूप से निर्धारित श्रृंखला है जो विभिन्न लिगेंडों वाले संकुलों द्वारा प्रकाश के अवशोषण पर आधारित है।
क्रिस्टल क्षेत्र स्थिरीकरण ऊर्जा (CFSE) की गणना
सूत्र : CFSE $=\left[-0.4(n) t_{2 g}+0.6\left(n^{\prime}\right) e_{g}\right] \Delta_{o}+{ }^{*} n P$.
जहाँ n और n’ क्रमशः $t_{2g}$ और $e_{g}$ कक्षकों में इलेक्ट्रॉनों की संख्या हैं और $\Delta_{o}$ अष्टफलकीय संकुल के लिए क्रिस्टल क्षेत्र विभाजन ऊर्जा है। *n सामान्य अपरिवर्तित विन्यास की तुलना में लिगेंडों के कारण बने अतिरिक्त इलेक्ट्रॉन युग्मों की संख्या को दर्शाता है।
(b) चतुष्फलकीय समन्वय इकाइयों में क्रिस्टल क्षेत्र विभाजन :
चतुष्फलकीय समन्वय इकाई बनने में, d कक्षक विभाजन उल्टा होता है और यह अष्टफलकीय क्षेत्र विभाजन की तुलना में छोटा होता है। समान धातु, समान लिगेंड और धातु-लिगेंड दूरियों के लिए, यह दिखाया जा सकता है कि $\Delta_{\mathrm{t}}=(4 / 9) \Delta_{o}$।
चित्र में टेट्राहेड्रल संकुल में क्रिस्टल क्षेत्र विपाटन दिखाया गया है।
समन्वय यौगिकों में रंग :
क्रिस्टल क्षेत्र सिद्धांत के अनुसार रंग लिगंडों के प्रभाव में इलेक्ट्रॉन के d-d संक्रमण के कारण होता है। हम जानते हैं कि किसी पदार्थ का रंग विद्युत चुंबकीय स्पेक्ट्रम के दृश्य भाग (400 से $700 \mathrm{~nm}$) में किसी विशिष्ट तरंगदैर्ध्य के प्रकाश के अवशोषण और शेष तरंगदैर्ध्यों के पारगमन या परावर्तन के कारण होता है।
क्रिस्टल क्षेत्र सिद्धांत की सीमाएँ
(1) यह केवल धातु आयन के d-कक्षकों को ध्यान में रखता है और अन्य धातु कक्षकों (जैसे $s, p_{x}, p_{y}$ और $p_{z}$ कक्षक) पर कोई विचार नहीं करता।
(2) यह लिगंडों की सापेक्ष ताकतों को संतोषजनक रूप से समझाने में असमर्थ है। उदाहरण के लिए, यह यह नहीं बताता कि स्पेक्ट्रोकेमिकल श्रेणी में $\mathrm{H}_{2} \mathrm{O}$ $\mathrm{OH}^{-}$से प्रबल लिगंड क्यों है।
(3) इस सिद्धांत के अनुसार धातु और लिगंडों के बीच का बंधन पूर्णतः आयनिक होता है। यह धातु-लिगंड बंधनों के आंशिक सहसंयोजक स्वभाव का कोई वर्णन नहीं देता।
(4) CFT संकुलों में $\pi$-बंधन का कोई वर्णन नहीं दे सकता।
समन्वय यौगिकों की स्थिरता :
एक समन्वय यौगिक $\left[\mathrm{ML}_{\mathrm{n}}\right]$ की स्थिरता को स्थिरता स्थिरांक (साम्य स्थिरांक) के संदर्भ में मापा जाता है, जिसे निमलिखित व्यंजक द्वारा दिया गया है,
$\beta_n = [ML_n]/[M(H_2O)_n][L]^n$
समग्र अभिक्रिया के लिए : $M\left(H_2 O\right)_n+n L \rightleftharpoons ML_n+nH_2 O$
परंपरा के अनुसार, विस्थापित जल को उपेक्षित किया जाता है, क्योंकि इसकी सांद्रता अनिवार्यतः स्थिर रहती है। उपरोक्त समग्र अभिक्रिया चरणों में होती है, जिसमें प्रत्येक चरण के लिए एक स्थिरता (निर्माण) स्थिरांक, $K_1, K_2, K_3, \ldots . . K_n$ होता है जैसा कि नीचे दर्शाया गया है :
$\beta_{\mathrm{n}}$, स्थिरता स्थिरांक, तापगतिक स्थिरता से संबंधित होता है जब प्रणाली साम्यावस्था पर पहुँच गई हो।
समावयवता :
(1) संरचनात्मक समावयवता :
(A) आयनन समावयवता :
यह प्रकार की समावयवता तब होती है जब एक समन्वय यौगिक में प्रतिआयन स्वयं एक संभावित लिगेंड हो और एक लिगेंड को विस्थापित कर सके जो फिर प्रतिआयन बन सकता है।
$[CO(NH_3)SO_4]NO_3$ और $[CO(NH_3)_5NO_3]SO_4$
(B) सॉल्वेट / हाइड्रेट समावयवता :
यह तब होती है जब जल समन्वय इकाई का भाग बनता है या उसके बाहर होता है।
(C) लिंकेज समावयवता :
कुछ लिगैंडों में, जैसे कि एम्बिडेंटेट लिगैंड, दो संभावित समन्वय स्थल होते हैं। ऐसे मामलों में, लिंकेज समावयवता मौजूद होती है।
उदाहरण : $[Co(ONO)(NH_3)_5]Cl_2$ और $[Co(NO_2)(NH_3)_5]Cl_2$
(D) समन्वय समावयवता :
समन्वय यौगिक जो धनायनिक और ऋणायनिक समन्वय इकाइयों से बने होते हैं, वे इस प्रकार की समावयवता दिखाते हैं क्योंकि लिगैंड धनायन और ऋणायन इकाइयों के बीच आंतर-परिवर्तित हो जाते हैं। कुछ उदाहरण हैं :
$[Co(NH_3)_6][Cr(CN)_6]$ और $[Cr(NH_3)_6][Co(CN)_6]$
(E) लिगैंड समावयवता :
चूँकि कई लिगैंड कार्बनिक यौगिक होते हैं जिनमें समावयवता की संभावनाएँ होती हैं, इसलिए परिणामी संकुल इस स्रोत से समावयवता दिखा सकते हैं।
(F) बहुलकन समावयवता :
इसे समन्वय समावयवता का एक विशेष मामला माना जाता है। इसमें विभिन्न समावयवी एक-दूसरे से सूत्र भार में भिन्न होते हैं, इसलिए ये वास्तविक अर्थों में सच समावयवी नहीं हैं।
(2). स्थिति-समावयवता
ऐसे समावयवियों का अस्तित्व (अणु जिनमें समान प्रकार के समान संख्या में परमाणु होते हैं और इसलिए समान सूत्र होता है, लेकिन रासायनिक और भौतिक गुणों में भिन्न होते हैं) जिनमें अंतरिक्ष में परमाणुओं की स्थिति में अंतर होता है। दो प्रकार के स्थिति-समावयवी होते हैं: प्रतिबिंबसम और विषमस्थितिसम।
ज्यामितीय समावयवता
ज्यामितीय समावयवी दो या अधिक ऐसे यौगिक होते हैं जिनमें परमाणुओं और बंधुओं की समान संख्या और प्रकार होती है, लेकिन जिनकी ज्यामितियाँ भिन्न होती हैं। उदाहरण के लिए, फ्यूमेरिक अम्ल और मेलिक अम्ल का आण्विक सूत्र और भार समान है, फिर भी वे समान अणु नहीं हैं।
ज्यामितीय समावयवता समन्वय संख्या 4 और 6 वाले समन्वय यौगिकों में सामान्य है।
समन्वय संख्या चार :
चतुष्फलकीय संकुल :
चतुष्फलकीय यौगिक ज्यामितीय समावयवता नहीं दिखा सकते क्योंकि हम सभी जानते हैं कि चतुष्फलकीय ज्यामिति में सभी चार स्थान समतुल्य होते हैं।
वर्ग समतलीय संकुल :
- $\mathrm{Ma}_{2} \mathrm{bc}$ प्रकार का वर्ग समतलीय संकुल (जहाँ $\mathrm{a}, \mathrm{b}, \mathrm{c}$ एकदंत लिगन्ड हैं) दो ज्यामितीय समावयव दिखाता है।

- Mabcd प्रकार का वर्ग समतलीय संकुल (जहाँ a,b,c,d एकदंत लिगन्ड हैं) तीन ज्यामितीय समावयव दिखाता है।
समन्वय संख्या छह :
अष्टफलकीय संकुलों में भी ज्यामितीय समावयवता संभव है।
$[Co(NH_3)_4Cl_2]^+$ के ज्यामितीय समावयव (सिस और ट्रांस) इस प्रकार हैं:
संभावित समावयवों की संख्या और लिगेंडों की केंद्रीय धातु आयन के चारों ओर स्थानिक व्यवस्थाएँ नीचे दी गई हैं।
(I) केवल एकदंत लिगेंड युक्त संकुल
1- $Ma_2b_4$ - 2
2- $Ma_4bc$ - 2
3- $Ma_3b_3$
(II) द्विदंत लिगेंड और एकदंत लिगेंड युक्त यौगिक
(i) $\quad M(A A) a_{3} b-$ दो ज्यामितीय समावयव संभव हैं।
(ii) $M(AA)a_2b_2$ - तीन ज्यामितीय समावयव संभव हैं।
नोट : $\left[M(A A) b_{4}\right]$ के साथ, केवल एक रूप संभव है।
$M(A A)$ abcd के छह ज्यामितीय समावयव होते हैं।
(iii) $M(AA)_2Cl_2$ के साथ - दो ज्यामितीय समावयव संभव हैं।
$[CoCl_2(en)_2]$ के ज्यामितीय समावयव (सिस और ट्रांस)
प्रकाशीय समावयवता :
एक समन्वय यौगिक जो ध्रुवित प्रकाश के तल को घुमा सकता है, प्रकाशीय रूप से सक्रिय कहा जाता है।
अष्टफलकीय संकुल :
प्रकाशीय समावयवता द्विआधारी लिगन्डों वाले अष्टफलकीय संकुलों में सामान्य है। उदाहरण के लिए, $\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$ में $\mathrm{d}$ और $\ell$ रूप नीचे दिए गए हैं।
वर्ग समतलीय संकुल :
वर्ग समतलीय संकुलों में प्रकाशीय समावयवता शायद ही देखी जाती है। चार लिगन्ड परमाणुओं और धातु आयन द्वारा बनाया गया समतल एक दर्पण समतल माना जाता है और इस प्रकार चिरालिटी की संभावना को रोकता है।
कार्बनिक धातु यौगिक
धातु कार्बोनिल :
धातुओं के यौगिक जिनमें $\mathrm{CO}$ लिगन्ड के रूप में होता है, धातु कार्बोनिल कहलाते हैं।
ये दो प्रकार के होते हैं।
(a) एकलक : वे धातु कार्बोनिल जिनमें प्रति अणु केवल एक धातु परमाणु होता है, एकलक कार्बोनिल कहलाते हैं। उदाहरण : $[Ni(CO)_4]$ $(sp^3,चतुष्फलकीय)$ ; $[Fe(CO)_5]$ $(dsp^3, \text{त्रिसमतलीय द्विपिरामिडीय})$।
(b) बहुलक : वे धातु कार्बोनिल जिनमें प्रति अणु दो या दो से अधिक धातु परमाणु होते हैं और जिनमें धातु-धातु बंध होते हैं, बहुलक कार्बोनिल कहलाते हैं। उदाहरण : $Mn_2(CO)_{10}$, $Co_2(CO)_9$, आदि।
$\mathrm{M}-\mathrm{C} \pi$ बंध धातु के भरे हुए $d$ कक्षक से कार्बन मोनोऑक्साइड के रिक्त प्रतिबंधी $\pi^{\star}$ कक्षक में इलेक्ट्रॉन युग्म के दान से बनता है। इस प्रकार कार्बन मोनोऑक्साइड एक $\sigma$ दाता $(\mathrm{OC} \rightarrow \mathrm{M})$ और एक $\pi$ ग्राही $(OC \leftarrow M)$ के रूप में कार्य करता है, जिससे ये दोनों परस्पर क्रियाएं एक सहयोगी प्रभाव उत्पन्न करती हैं जो $\mathrm{CO}$ और धातु के बीच बंध को मजबूत करती हैं जैसा कि चित्र में दिखाया गया है।
सिग्मा $(\sigma)$ बंधित कार्बनिक धातु यौगिक :
(a) ग्रिग्नार्ड अभिकर्मक $\mathrm{R}-\mathrm{Mg}-\mathrm{X}$ जहाँ $\mathrm{R}$ एक एल्किल या ऐरिल समूह है और $\mathrm{X}$ हैलोजन है।
(b) $(CH_3)_4Sn$, $(C_2H_5)_4Pb$, $Al_2(CH_3)_6$, $Al_2(C_2H_5)_6$ आदि।
पाई-बंधित कार्बनिक धातु यौगिक :
ये धातु के साथ एल्कीन, एल्काइन, बेंजीन और अन्य वलय यौगिकों के यौगिक होते हैं।
ज़ीज़े लवण :
$K[PtCl_{3}(\eta^{2}-C_2 H_4)]$
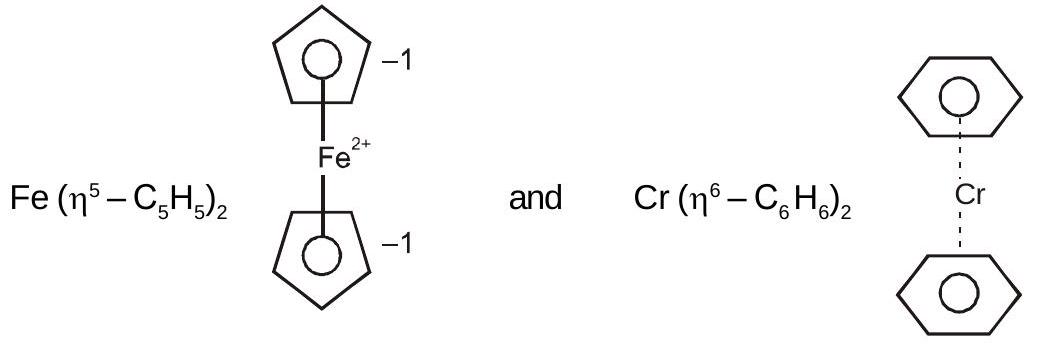
फेरोसीन और बिस(बेंजीन)क्रोमियम की संरचना इस प्रकार है:
समन्वय यौगिकों का महत्व और अनुप्रयोग
अपनी अनूठी संरचना और विशेषताओं के कारण, समन्वय यौगिक प्रकृति और उद्योग दोनों में अत्यंत आवश्यक हैं। विभिन्न क्षेत्रों में समन्वय यौगिकों के कुछ प्रमुख अनुप्रयोग निम्नलिखित हैं:
जैविक प्रणालियों में:
- रक्त में पाया जाने वाला हीमोग्लोबिन ऑक्सीजन वाहक के रूप में कार्य करता है और यह एक समन्वय अणु है जिसमें $Fe^{2+}$ केंद्रीय परमाणु है और पोर्फिरिन वलय संरचना है।
- कोबालामिन, जिसे सायनोकोबालामिन या विटामिन B-12 भी कहा जाता है, एक समन्वय अणु है जिसमें कोबाल्ट धातु तत्व होता है। क्लोरोफिल, जो पौधों की हरित रंगत और प्रकाश संश्लेषण के लिए उत्तरदायी रंजक है, एक समन्वय अणु है जिसमें मैग्नीशियम केंद्रीय परमाणु होता है।
समन्वय यौगिकों का धातुकर्मीय उपयोग:
-
अयस्कों से धातुओं के निष्कर्षण में जटिल संरचनाएँ शामिल होती हैं। उदाहरण के लिए, चाँदी और सोना NaCN के साथ संकुल बनाते हैं जब वे उसमें घुलते हैं। उन्हें निष्कर्षित करने के लिए यह विधि प्रयोग की जाती है।
-
मॉन्ड तकनीक, जिसका उपयोग निकल को शुद्ध करने के लिए किया जाता है, में अशुद्ध Ni को $[Ni(CO)_4]$ संकुल में परिवर्तित किया जाता है, जिसे फिर घोलकर मुक्त और शुद्ध निकल प्राप्त किया जा सकता है।
विश्लेषणात्मक रसायन:
- धातुओं का विश्लेषणात्मक पता जटिल संरचनाओं का उपयोग करके लगाया जाता है। उदाहरण के लिए, $Cu^{2+}$ आयनों की पहचान उनके संकुल के निर्माण के माध्यम से की जा सकती है।
- समन्वय रसायन विज्ञान का उपयोग करके जल की कठोरता की गणना की जा सकती है।
- निकल को डाइमेथिल ग्लाइऑक्सिम (DMG) के साथ उपचारित करके पहचाना जा सकता है; निकल और DMG एक लाल रंग का संकुल बनाते हैं। $Ag^{+}$ और $Hg^{2+}$ को AgCl को $NH_3$ में घोलकर एक संकुल बनाकर अलग किया जा सकता है, जबकि $Hg_2Cl_2$ एक अदम्य काली सामग्री बनाता है।
समन्वय यौगिकों का औषधीय उपयोग:
- प्लैटिनम संकुल, सिस-प्लैटिन, का सूत्र cis -$[Pt(NH_3)_2Cl_2]$ है और यह चिकित्सा में एक प्रायः प्रयुक्त प्रतिवृद्ध (anti-tumour) औषधि है।
- सीसा विषाक्तता का इलाज कैल्शियम और EDTA के संयोजन से किया जाता है।
- पशु प्रणालियों में अतिरिक्त तांबा और लोहा, D-पेनिसिलामाइन और डेस्फेर्रिऑक्सामाइन B जैसे चेलेटिंग लिगेंडों के साथ संकुल बनाकर समाप्त किए जाते हैं।



