अध्याय 03 तत्वों का वर्गीकरण एवं गुणों में आवर्तिता
Subject Hub
सामान्य Learning Resources
“आवर्त सारणी रसायन विज्ञान की तर्कसंगत रूप से सबसे महत्वपूर्ण अवधारणा है, सिद्धांत और व्यवहार दोनों में। यह छात्रों के लिए रोज़ाना का आधार है, यह पेशेवरों के लिए शोध के नए रास्ते सुझाती है, और यह सम्पूर्ण रसायन विज्ञान का संक्षिप्त संगठन प्रदान करती है। यह इस तथ्य का एक उल्लेखनीय प्रदर्शन है कि रासायनिक तत्व यादृच्छिक रूप से फैली हुई संस्थाओं का समूह नहीं हैं, बल्कि प्रवृत्तियाँ दिखाते हैं और परिवारों में साथ रहते हैं। आवर्त सारणी की जानकारी उसके लिए अनिवार्य है जो संसार को समझना चाहता है और यह देखना चाहता है कि यह रसायन विज्ञान की मूलभूत इकाइयों, रासायनिक तत्वों, से कैसे बना है।”
ग्लेन टी. सीबोर्ग
इस इकाई में हम आवर्त सारणी के ऐतिहासिक विकास का अध्ययन करेंगे जैसा कि आज है और आधुनिक आवर्त नियम का भी। हम यह भी सीखेंगे कि आवर्त वर्गीकरण परमाणुओं की इलेक्ट्रॉनिक विन्यास का एक तार्किक परिणाम कैसे है। अंत में, हम तत्वों के भौतिक और रासायनिक गुणों में आने वाली कुछ आवर्त प्रवृत्तियों की जाँच करेंगे।
3.1 हमें तत्वों को वर्गीकृत करने की आवश्यकता क्यों है ?
हम अब तक जान चुके हैं कि तत्व सभी प्रकार की पदार्थों की मूलभूत इकाइयाँ होती हैं। वर्ष 1800 तक केवल 31 तत्वों की जानकारी थी। 1865 तक पहचाने गए तत्वों की संख्या दोगुनी से अधिक होकर 63 हो गई। वर्तमान में 114 तत्व जाने जाते हैं। इनमें से हाल ही में खोजे गए तत्व मानव-निर्मित हैं। नए तत्वों को संश्लेषित करने के प्रयास जारी हैं। इतनी बड़ी संख्या में तत्वों के साथ इन सभी तत्वों और उनके असंख्य यौगिकों की रसायन को व्यक्तिगत रूप से अध्ययन करना अत्यंत कठिन है। इस समस्या को सरल बनाने के लिए वैज्ञानिकों ने तत्वों को वर्गीकृत करके अपने ज्ञान को एक व्यवस्थित तरीके से व्यवस्थित करने की खोज की। न केवल इससे तत्वों के बारे में ज्ञात रासायनिक तथ्यों को तर्कसंगत बनाया गया, बल्कि आगे के अध्ययन के लिए नए तत्वों की भविष्यवाणी भी की गई।
3.2 आवर्त वर्गीकरण की उत्पत्ति
तत्वों को समूहों में वर्गीकृत करना और आवर्त नियम तथा आवर्त सारणी का विकास वैज्ञानिकों की कई पीढ़ियों द्वारा प्रेक्षणों और प्रयोगों से प्राप्त ज्ञान को व्यवस्थित करने का परिणाम है। जर्मन रसायनज्ञ जोहान डोबेराइनर ने 1800 के दशक की शुरुआत में तत्वों के गुणों में प्रवृत्तियों के विचार को पहली बार उठाया। 1829 तक उसने तीन-तीन तत्वों के कई समूहों (त्रिकों) के भौतिक और रासायनिक गुणों में समानता देखी। प्रत्येक स्थिति में उसने पाया कि प्रत्येक त्रिक के मध्य तत्व का परमाणु भार अन्य दो तत्वों के परमाणु भारों के बीच लगभग आधा था (तालिका 3.1)। साथ ही मध्य तत्व के गुण अन्य दो सदस्यों के गुणों के बीच के थे।
तालिका 3.1 डोबेराइनर के त्रिक
| तत्व | परमाणु भार |
तत्व | परमाणु भार |
तत्व | परमाणु भार |
|---|---|---|---|---|---|
| $\mathbf{L i}$ | 7 | $\mathbf{C a}$ | 40 | $\mathbf{C l}$ | 35.5 |
| $\mathbf{N a}$ | 23 | $\mathbf{S r}$ | 88 | $\mathbf{B r}$ | 80 |
| $\mathbf{K}$ | 39 | $\mathbf{B a}$ | 137 | $\mathbf{I}$ | 127 |
चूँकि डोबेरिनियर का संबंध, जिसे ट्रायड्स का नियम कहा जाता है, कुछ ही तत्वों के लिए काम करता प्रतीत हुआ, इसे संयोग मानकर खारिज कर दिया गया। तत्वों को वर्गीकृत करने का अगला प्रयास 1862 में एक फ्रेंच भूविज्ञानी, ए.ई.बी. डे चैंकोर्टो ने किया। उसने तब तक ज्ञात तत्वों को परमाणु भार के बढ़ते क्रम में व्यवस्थित किया और तत्वों की एक बेलनाकार सारणी बनाई ताकि गुणों की आवर्ती पुनरावृत्ति को दर्शाया जा सके। इसने भी अधिक ध्यान नहीं खींचा। अंग्रेज़ रसायनशास्त्री जॉन अलेक्ज़ेंडर न्यूलैंड्स ने 1865 में अष्टकों का नियम प्रतिपादित किया। उसने तत्वों को उनके परमाणु भार के बढ़ते क्रम में व्यवस्थित किया और देखा कि हर आठवाँ तत्व पहले तत्व के समान गुण रखता है (तालिका 3.2)। यह संबंध संगीत के अष्टकों में हर आठवें स्वर के पहले स्वर के समान होने जैसा था। न्यूलैंड्स का अष्टकों का नियम कैल्शियम तक के तत्वों के लिए ही सही प्रतीत हुआ। यद्यपि उसके विचार को उस समय व्यापक रूप से स्वीकार नहीं किया गया, उसे बाद में लंदन की रॉयल सोसाइटी ने 1887 में डेवी पदक से सम्मानित किया।
आवर्त नियम, जैसा कि हम आज जानते हैं, का विकास रूसी रसायनशास्त्री दिमित्री मेंडेलीव (1834-1907) और जर्मन रसायनशास्त्री लोथार मेयर (1830-1895) के कारण संभव हुआ।
स्वतंत्र रूप से कार्य करते हुए, दोनों रसायनज्ञों ने 1869 में प्रस्तावित किया कि तत्वों को उनके परमाणु भार के बढ़ते क्रम में व्यवस्थित करने पर, नियमित अंतरालों पर भौतिक और रासायनिक गुणों में समानताएँ दिखाई देती हैं। लोथार मेयर ने परमाणु आयतन, गलनांक और क्वथनांक जैसे भौतिक गुणों को परमाणु भार के विरुद्ध आलेखित किया और एक आवर्ती दोहराव वाला पैटर्न प्राप्त किया। न्यूलैंड्स के विपरीत, लोथार मेयर ने उस दोहराव वाले पैटर्न की लंबाई में परिवर्तन देखा। 1868 तक, लोथार मेयर ने एक तत्व सारणी विकसित कर ली थी जो आधुनिक आवर्त सारणी से काफी मिलती-जुलती थी। हालाँकि, उनका कार्य तब तक प्रकाशित नहीं हुआ जब तक कि दिमित्री मेंडेलीव का कार्य प्रकाशित नहीं हुआ, वैज्ञानिक जिसे आमतौर पर आधुनिक आवर्त सारणी के विकास का श्रेय दिया जाता है।
तालिका 3.2 न्यूलैंड्स के अष्टक
| तत्व | $\mathbf{L i}$ | $\mathbf{B e}$ | $\mathbf{B}$ | $\mathbf{C}$ | $\mathbf{N}$ | $\mathbf{O}$ | $\mathbf{F}$ |
|---|---|---|---|---|---|---|---|
| पर. भार | 7 | 9 | 11 | 12 | 14 | 16 | 19 |
| तत्व | $\mathbf{N a}$ | $\mathbf{M g}$ | $\mathbf{A l}$ | $\mathbf{S i}$ | $\mathbf{P}$ | $\mathbf{S}$ | $\mathbf{C l}$ |
| पर. भार | 23 | 24 | 27 | 29 | 31 | 32 | 35.5 |
| तत्व | $\mathbf{K}$ | $\mathbf{C a}$ | |||||
| पर. भार | 39 | 40 |
जबकि डोबेराइनर ने आवर्त संबंधों के अध्ययन की शुरुआत की, यह मेंडेलीव थे जिन्होंने पहली बार आवर्त नियम प्रकाशित किया। यह इस प्रकार कहता है :
तत्वों के गुण उनके परमाणु भारों की आवर्ती फलन होते हैं।
मेंडेलीव ने तत्वों को एक सारणी की क्षैतिज पंक्तियों और ऊध्र्वाधर स्तंभों में उनके बढ़ते परमाणु भार के क्रम में इस प्रकार व्यवस्थित किया कि समान गुणधर्मों वाले तत्व एक ही ऊध्र्वाधर स्तंभ या समूह में आ गए। तत्वों को वर्गीकृत करने की मेंडेलीव की प्रणाली लोथार मेयर की प्रणाली से अधिक विस्तृत थी। उसने आवर्तिता के महत्व को पूरी तरह पहचाना और तत्वों को वर्गीकृत करने के लिए भौतिक तथा रासायनिक गुणधर्मों की व्यापक श्रेणी का प्रयोग किया। विशेष रूप से, मेंडेलीव ने तत्वों द्वारा बनने वाले यौगिकों के प्रायोगिक सूत्रों और गुणधर्मों में समानताओं पर आधारित किया। उसने महसूस किया कि कुछ तत्व उसके वर्गीकरण के ढांचे में फिट नहीं बैठते यदि परमाणु भार के क्रम का कड़ाई से पालन किया जाए। उसने परमाणु भार के क्रम को नज़रअंदाज़ किया, यह सोचकर कि परमाणु माप गलत हो सकते हैं, और समान गुणधर्मों वाले तत्वों को एक साथ रखा। उदाहरण के लिए, आयोडीन, जिसका परमाणु भार टेलुरियम (समूह VI) से कम था, उसे समूह VII में फ्लोरीन, क्लोरीन, ब्रोमीन के साथ इसलिए रखा गया क्योंकि गुणधर्म समान थे (चित्र 3.1)। साथ ही, समान गुणधर्मों वाले तत्वों को एक ही समूह में रखने के अपने प्राथमिक उद्देश्य को बनाए रखते हुए, उसने प्रस्तावित किया कि कुछ तत्व अभी अनखोजे गए हैं और, इसलिए, सारणी में कई रिक्त स्थान छोड़ दिए। उदाहरण के लिए, जब मेंडेलीव ने अपनी आवर्त सारणी प्रकाशित की, तब गैलियम और जर्मेनियम दोनों अज्ञात थे। उसने एल्युमिनियम के नीचे और सिलिकॉन के नीचे रिक्त स्थान छोड़े और इन तत्वों को एका-एल्युमिनियम और एका-सिलिकॉन कहा। मेंडेलीव ने न केवल गैलियम और जर्मेनियम के अस्तित्व की भविष्यवाणी की, बल्कि उनके कुछ सामान्य भौतिक गुणधर्मों का वर्णन भी किया। ये तत्व बाद में खोजे गए। इन तत्वों के लिए मेंडेलीव द्वारा भविष्यवाणी किए गए कुछ गुणधर्म और प्रायोगिक रूप से पाए गए गुणधर्म सारणी 3.3 में सूचीबद्ध हैं।
मेंडेलीव की मात्रात्मक भविष्यवाणियों की साहसिकता और उनकी अंततः सफलता ने उन्हें और उनकी आवर्त सारणी को प्रसिद्ध बना दिया। 1905 में प्रकाशित मेंडेलीव की आवर्त सारणी को चित्र 3.1 में दिखाया गया है।
तालिका 3.3 तत्व एका-एल्युमिनियम (गैलियम) और एका-सिलिकन (जर्मेनियम) के लिए मेंडेलीव की भविष्यवाणियाँ
| गुणधर्म | एका-एल्युमिनियम (भविष्यवाणी) |
गैलियम (प्राप्त) |
एका-सिलिकन (भविष्यवाणी) |
जर्मेनियम (प्राप्त) |
|---|---|---|---|---|
| परमाणु भार | 68 | 70 | 72 | 72.6 |
| घनत्व/(g/cm $\mathbf{)}$ | 5.9 | 5.94 | 5.5 | 5.36 |
| गलनांक/K | $\mathrm{Low}$ | 302.93 | $\mathrm{High}$ | 1231 |
| ऑक्साइड का सूत्र | $\mathrm{E}_2 \mathrm{O}_3$ | $\mathrm{Ga}_2 \mathrm{O}_3$ | $\mathrm{EO}_{2}$ | $\mathrm{GeO}_{2}$ |
| क्लोराइड का सूत्र | $\mathrm{E} \mathrm{Cl}_{3}$ | $\mathrm{GaCl}_{3}$ | $\mathrm{ECl}_{4}$ | $\mathrm{GeCl}_{4}$ |
समूहों और श्रेणियों में तत्वों की आवर्त प्रणाली

चित्र 3.1 मेंडेलीव की प्रारंभ में प्रकाशित आवर्त सारणी
3.3 आधुनिक आवर्त नियम और आवर्त सारणी का वर्तमान रूप
हमें यह ध्यान रखना चाहिए कि जब मेंडेलीव ने अपनी आवर्त सारणी विकसित की, तब रसायनज्ञ परमाणु की आंतरिक संरचना के बारे में कुछ नहीं जानते थे। हालाँकि, $20^{\text {वें}}$ शताब्दी की शुरुआत ने उप-परमाणु कणों के सिद्धांतों में गहरे विकास को देखा। 1913 में, अंग्रेज़ भौतिक विज्ञानी हेनरी मॉसले ने तत्वों के विशिष्ट $X$-रे स्पेक्ट्रा में नियमितताओं को देखा। $\sqrt{v}$ (जहाँ $V$ उत्सर्जित $X$-किरणों की आवृत्ति है) का परमाणु संख्या $(Z)$ के विरुद्ध आलेख एक सीधी रेखा देता है, न कि $\sqrt{v}$ बनाम परमाणु द्रव्यमान का आलेख। उन्होंने इस प्रकार दिखाया कि परमाणु संख्या किसी तत्व की परमाणु द्रव्यमान की तुलना में अधिक मौलिक संपत्ति है। इसलिए, मेंडेलीव के आवर्त नियम को तदनुसार संशोधित किया गया। इसे आधुनिक आवर्त नियम कहा जाता है और इसे इस प्रकार कहा जा सकता है:
तत्वों की भौतिक और रासायनिक गुण उनकी परमाणु संख्याओं के आवर्ती फलन होते हैं।
आवर्त नियम ने 94 प्राकृतिक रूप से पाए जाने वाले तत्वों (नेप्चूनियम और प्लूटोनियम, एक्टिनियम और प्रोटोएक्टिनियम की तरह, यूरेनियम के अयस्क पिच ब्लेंड में भी पाए जाते हैं) के बीच महत्वपूर्ण समानताओं को उजागर किया। इसने अकार्बनिक रसायन में नवीनीकृत रुचि को उत्पन्न किया और कृत्रिम रूप से उत्पन्न अल्पजीवी तत्वों की रचना के साथ वर्तमान तक आगे बढ़ाया है।
आपको याद होगा कि परमाणु संख्या नाभिकीय आवेश (अर्थात् प्रोटॉनों की संख्या) या किसी उदासीन परमाणु में इलेक्ट्रॉनों की संख्या के बराबर होती है। तब क्वांटम संख्याओं और इलेक्ट्रॉनिक विन्यासों के महत्व को तत्वों की आवर्तिता में देखना आसान हो जाता है। वास्तव में, अब यह माना जाता है कि आवर्त नियम मूलतः इलेक्ट्रॉनिक विन्यासों में आवर्ती परिवर्तन का परिणाम है, जो वास्तव में तत्वों और उनके यौगिकों के भौतिक और रासायनिक गुणों को निर्धारित करते हैं।
समय-समय पर आवर्त सारणी के अनेक रूप बनाए गए हैं। कुछ रूप रासायनिक अभिक्रियाओं और संयोजकता पर बल देते हैं, जबकि अन्य तत्वों के इलेक्ट्रॉनिक विन्यास पर ज़ोर देते हैं। एक आधुनिक संस्करण, जिसे तत्वों की आवर्त सारणी का “दीर्घ रूप” (चित्र 3.2) कहा जाता है, सबसे सुविधाजनक और व्यापक रूप से प्रयुक्त है। क्षैतिज पंक्तियाँ (जिन्हें मेंडेलीव ने श्रेणियाँ कहा था) आवर्त कहलाती हैं और ऊर्ध्वाधर स्तंभ समूह कहलाते हैं। वे तत्व जिनके परमाणुओं में बाहरी इलेक्ट्रॉनिक विन्यास समान होते हैं, उन्हें ऊर्ध्वाधर स्तंभों में व्यवस्थित किया जाता है, जिन्हें समूह या वंश कहा जाता है। अंतरराष्ट्रीय शुद्ध और उपयुक्त रसायन संघ (IUPAC) की सिफारिश के अनुसार, समूहों को 1 से 18 तक संख्यांकित किया गया है, जिससे पुराना संकेत IA … VIIA, VIII, IB … VIIB और 0 प्रतिस्थापित हो गया है।
कुल मिलाकर सात आवर्त हैं। आवर्त संख्या उस आवर्त में उपस्थित तत्वों के उच्चतम प्रधान क्वांटम संख्या $(n)$ के अनुरूप होती है। प्रथम आवर्त में 2 तत्व होते हैं। इसके बाद के आवर्तों में क्रमशः $8,8,18,18$ और 32 तत्व होते हैं। सातवाँ आवर्त अपूर्ण है और छठे आवर्त की भाँति इसकी सैद्धांतिक अधिकतम (क्वांटम संख्याओं के आधार पर) 32 तत्व होनी चाहिए। आवर्त सारणी के इस रूप में छठे और सातवें आवर्तों के 14-14 तत्वों (क्रमशः लैन्थेनॉयड और ऐक्टिनॉयड) को नीचे अलग पैनलों में रखा गया है[^0]।
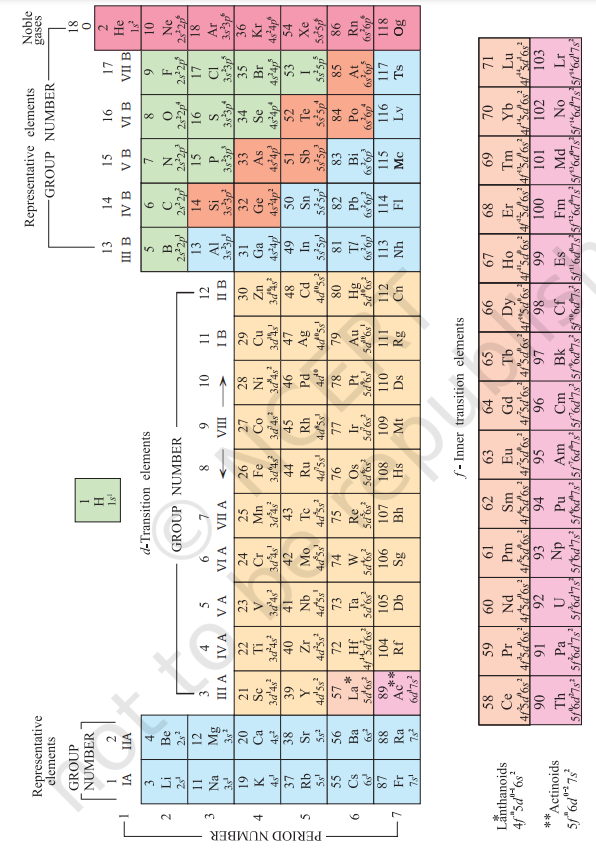
चित्र 3.2 तत्वों की आवर्त सारणी का दीर्घ रूप, जिसमें उनकी परमाणु संख्याएँ और भू-स्थित बाह्य इलेक्ट्रॉनिक विन्यास दिए गए हैं। समूहों को 1984 IUPAC की सिफारिशों के अनुरूप 1-18 तक अंकित किया गया है। यह संकेतन तत्वों के पुराने क्रमांकन योजना IA–VIIA, VIII, IB–VIIB और 0 को प्रतिस्थापित करता है।
3.4 परमाणु संख्या > 100 वाले तत्वों की नामकरण
नए तत्वों का नामकरण परंपरागत रूप से खोजकर्ता (या खोजकर्ताओं) का विशेषाधिकार रहा है और सुझाया गया नाम IUPAC द्वारा अनुमोदित किया जाता था। हाल के वर्षों में इससे कुछ विवाद उत्पन्न हुए हैं। बहुत उच्च परमाणु संख्या वाले नए तत्व इतने अस्थिर होते हैं कि इनकी बहुत ही कम मात्रा, कभी-कभी केवल कुछ परमाणु ही प्राप्त होते हैं। इनके संश्लेषण और विशेषता निर्धारण के लिए अत्याधुनिक तथा महंगे उपकरण और प्रयोगशाला की आवश्यकता होती है। ऐसा कार्य केवल विश्व की कुछ प्रयोगशालाओं में प्रतिस्पर्धात्मक भावना से किया जाता है। वैज्ञानिक, नए तत्व पर विश्वसनीय आकड़े एकत्र करने से पहले, कभी-कभी इसकी खोज का दावा करने के लिए लालायित हो जाते हैं। उदाहरण के लिए, अमेरिकी और सोवियत वैज्ञानिकों दोनों ने तत्व 104 की खोज का श्रेय लेने का दावा किया। अमेरिकियों ने इसे रदरफोर्डियम नाम दिया जबकि सोवियतों ने इसे कुर्चाटोवियम नाम दिया। ऐसी समस्याओं से बचने के लिए, IUPAC ने सिफारिश की है कि जब तक किसी नए तत्व की खोज सिद्ध नहीं हो जाती और इसका नाम आधिकारिक रूप से मान्य नहीं हो जाता, तब तक इसके परमाणु संख्या से सीधे एक व्यवस्थित नामकरण व्युत्पन्न किया जाए जो 0 और संख्याओं $1-9$ के लिए संख्यात्मक मूलों का उपयोग करता है। ये मूल तालिका 3.4 में दिखाए गए हैं। मूलों को परमाणु संख्या बनाने वाले अंकों के क्रम में एक साथ रखा जाता है और अंत में “ium” जोड़ा जाता है। 100 से ऊपर $Z$ वाले तत्वों के लिए IUPAC नाम तालिका 3.5 में दिखाए गए हैं।
तालिका 3.4 तत्वों के IUPAC नामकरण के लिए संकेतन
| अंक | नाम | संक्षेप |
|---|---|---|
| 0 | निल | $\mathrm{n}$ |
| 1 | उन | $\mathrm{u}$ |
| 2 | बि | $\mathrm{b}$ |
| 3 | त्रि | $\mathrm{t}$ |
| 4 | क्वाड | $\mathrm{q}$ |
| 5 | पेन्ट | $\mathrm{p}$ |
| 6 | हेक्स | $\mathrm{h}$ |
| 7 | सेप्ट | $\mathrm{s}$ |
| 8 | ऑक्ट | $\mathrm{o}$ |
| 9 | एन | $\mathrm{e}$ |
तालिका 3.5 100 से अधिक परमाणु संख्या वाले तत्वों की नामकरण पद्धति
| परमाणु संख्या |
IUPAC नामकरण के अनुसार नाम | प्रतीक | IUPAC आधिकारिक नाम |
IUPAC प्रतीक |
|---|---|---|---|---|
| 101 | अनिलूनियम | Unu | मेंडेलीवियम | $\mathrm{Md}$ |
| 102 | अनिल्बियम | Unb | नोबेलियम | No |
| 103 | अनिल्ट्रियम | Unt | लॉरेंसियम | $\mathrm{Lr}$ |
| 104 | अनिल्क्वाडियम | Unq | रदरफोर्डियम | $\mathrm{Rf}$ |
| 105 | अनिल्पेन्टियम | Unp | डब्नियम | $\mathrm{Db}$ |
| 106 | अनिल्हेक्सियम | Unh | सीबोर्गियम | $\mathrm{Sg}$ |
| 107 | अनिल्सेप्टियम | Uns | बोह्रियम | $\mathrm{Bh}$ |
| 108 | अनिलॉक्टियम | Uno | हासियम | $\mathrm{Hs}$ |
| 109 | अनिलेनियम | Une | माइट्नेरियम | $\mathrm{Mt}$ |
| 110 | अनुनिलियम | Uun | डार्मस्टाटियम | $\mathrm{Ds}$ |
| 111 | अनुनुनियम | Uuu | रॉन्टजेनियम | $\mathrm{Rg}$ |
| 112 | अनुन्बियम | Uub | कोपरनिसियम | $\mathrm{Cn}$ |
| 113 | अनुन्ट्रियम | Uut | निहोनियम | $\mathrm{Nh}$ |
| 114 | अनुन्क्वाडियम | Uuq | फ्लेरोवियम | $\mathrm{Fl}$ |
| 115 | अनुन्पेन्टियम | Uup | मॉस्कोवियम | $\mathrm{Mc}$ |
| 116 | अनुन्हेक्सियम | Uuh | लिवरमोरियम | $\mathrm{Lv}$ |
| 117 | अनुन्सेप्टियम | Uus | टेनेसीन | $\mathrm{Ts}$ |
| 118 | अनुनॉक्टियम | Uuo | ओगनेसन | $\mathrm{Og}$ |
इस प्रकार, नए तत्व को पहले एक अस्थायी नाम मिलता है, जिसका प्रतीक तीन अक्षरों से बना होता है। बाद में स्थायी नाम और प्रतीक प्रत्येक देश के आईयूपीएसी प्रतिनिधियों के मतदान द्वारा दिए जाते हैं। स्थायी नाम उस देश (या देश के राज्य) को दर्शा सकता है जहाँ तत्व की खोज हुई थी, या किसी प्रसिद्ध वैज्ञानिक को श्रद्धांजलि दे सकता है। अब तक, 118 तक परमाणु संख्या वाले तत्वों की खोज हो चुकी है। सभी तत्वों के आधिकारिक नाम आईयूपीएसी द्वारा घोषित किए जा चुके हैं।
प्रश्न 3.1
परमाणु संख्या 120 वाले तत्व का आईयूपीएसी नाम और प्रतीक क्या होगा?
हल
सारणी 3.4 से, 1, 2 और 0 के लिए मूल क्रमशः अन, बाई और निल हैं। इसलिए, प्रतीक और नाम क्रमशः Ubn और अनबाइनिलियम हैं।
3.5 तत्वों की इलेक्ट्रॉनिक विन्यास और आवर्त सारणी
पिछली इकाई में हमने सीखा है कि एक परमाणु में इलेक्ट्रॉन चार क्वांटम संख्याओं के एक समूह द्वारा वर्णित होता है, और प्रधान क्वांटम संख्या ($n$) मुख्य ऊर्जा स्तर को परिभाषित करती है जिसे कोश कहा जाता है। हमने यह भी अध्ययन किया है कि इलेक्ट्रॉनों को परमाणु में विभिन्न उपकोशों, जिन्हें कक्षक (s, p, $d, f$) भी कहा जाता है, में कैसे भरा जाता है। परमाणु के कक्षकों में इलेक्ट्रॉनों का वितरण उसकी इलेक्ट्रॉनिक विन्यास कहलाता है। एक तत्व की आवर्त सारणी में स्थिति अंतिम भरे गए कक्षक की क्वांटम संख्याओं को दर्शाती है। इस खंड में हम तत्वों की इलेक्ट्रॉनिक विन्यास और आवर्त सारणी के दीर्घ रूप के बीच प्रत्यक्ष संबंध देखेंगे।
(क) आवर्तों में इलेक्ट्रॉनिक विन्यास
अवधि बाहरी या संयोजक कोश के लिए $n$ के मान को दर्शाती है। दूसरे शब्दों में, आवर्त सारणी में क्रमिक अवधि अगले उच्चतर प्रमुख ऊर्जा स्तर $(n=1, n=2$, आदि) के भरने से जुड़ी होती है। यह स्पष्ट रूप से देखा जा सकता है कि प्रत्येक अवधि में तत्वों की संख्या उस ऊर्जा स्तर में उपलब्ध परमाणु कक्षकों की संख्या की दोगुनी होती है जिसे भरा जा रहा है। पहली अवधि $(n=1)$ सबसे निचले स्तर (1s) के भरने से शुरू होती है और इसलिए इसमें दो तत्व होते हैं - हाइड्रोजन $\left(1 s^{1}\right)$ और हीलियम $\left(1 s^{2}\right)$ जब पहला कोश $(K)$ पूरा होता है। दूसरी अवधि $(n=2)$ लिथियम से शुरू होती है और तीसरा इलेक्ट्रॉन $2 s$ कक्षक में प्रवेश करता है। अगला तत्व, बेरिलियम के पास चार इलेक्ट्रॉन होते हैं और इसका इलेक्ट्रॉनिक विन्यास $1 s^{2} 2 s^{2}$ होता है। अगले तत्व बोरन से शुरू होकर, $2 p$ कक्षक इलेक्ट्रॉनों से भरे जाते हैं जब $L$ कोश नियॉन $\left(2 s^{2} 2 p^{6}\right)$ पर पूरा होता है। इस प्रकार दूसरी अवधि में 8 तत्व होते हैं। तीसरी अवधि $(n=3)$ सोडियम से शुरू होती है, और अतिरिक्त इलेक्ट्रॉन $3 s$ कक्षक में प्रवेश करता है। $3 s$ और $3 p$ कक्षकों का क्रमिक भरना सोडियम से आर्गॉन तक 8 तत्वों की तीसरी अवधि को जन्म देता है। चौथी अवधि $(n=4)$ पोटैशियम से शुरू होती है, और अतिरिक्त इलेक्ट्रॉन $4 s$ कक्षक को भरते हैं। अब आप ध्यान दें कि $4 p$ कक्षक को भरने से पहले, $3 d$ कक्षकों को भरना ऊर्जा की दृष्टि से अधिक अनुकूल हो जाता है और हम तथाकथित $3 d$ संक्रमण श्रृंखला के तत्वों से मिलते हैं। यह स्कैंडियम $(Z=21)$ से शुरू होती है जिसका इलेक्ट्रॉनिक विन्यास $3 d^{1} 4 s^{2}$ होता है। $3 d$ कक्षक जिंक $(Z=30)$ पर भरे जाते हैं जिसका इलेक्ट्रॉनिक विन्यास $3 d^{10} 4 s^{2}$ होता है। चौथी अवधि क्रिप्टॉन पर समाप्त होती है जब $4 p$ कक्षक भर जाते हैं। कुल मिलाकर इस चौथी अवधि में 18 तत्व होते हैं। पांचवीं अवधि $(n=5)$ रुबिडियम से शुरू होती है जो चौथी अवधि के समान है और इसमें $4 d$ संक्रमण श्रृंखला शामिल है जो यिट्रियम $(Z=39)$ से शुरू होती है। यह अवधि ज़ेनॉन पर समाप्त होती है जब $5 p$ कक्षक भर जाते हैं। छठी अवधि $(n=6)$ में 32 तत्व होते हैं और क्रमिक इलेक्ट्रॉन $6 s, 4 f, 5 d$ और $6 p$ कक्षकों में प्रवेश करते हैं, इस क्रम में - $4 f$ कक्षकों का भरना सीरियम $(Z=58)$ से शुरू होता है और ल्यूटेशियम $(Z=71)$ पर समाप्त होता है जो $4 f$-आंतरिक संक्रमण श्रृंखला को देता है जिसे लैन्थेनॉयड श्रृंखला कहा जाता है। सातवीं अवधि $(n=7)$ छठी अवधि के समान है जिसमें $7 s, 5 f, 6 d$ और $7 p$ कक्षकों का क्रमिक भरना होता है और इसमें अधिकांश मानव-निर्मित रेडियोधर्मी तत्व शामिल हैं। यह अवधि परमाणु क्रमांक 118 वाले तत्व पर समाप्त होगी जो निष्क्रिय गैस परिवार से संबंधित होगा। एक्टिनियम $(Z=89)$ के बाद $5 f$ कक्षकों को भरना $5 f$-आंतरिक संक्रमण श्रृंखला को देता है जिसे एक्टिनॉयड श्रृंखला कहा जाता है। $4 f$ और $5 f$-आंतरिक संक्रमण श्रृंखला के तत्वों को आवर्त सारणी में अलग से रखा गया है ताकि इसकी संरचना को बनाए रखा जा सके और वर्गीकरण के सिद्धांत को संरक्षित किया जा सके जिससे समान गुणों वाले तत्व एक ही स्तंभ में रहें।
प्रश्न 3.2
आप आवर्त सारणी की 5वीं अवधि में 18 तत्वों की उपस्थिति को कैसे उचित ठहराएंगे?
हल
जब n=5, l=0,1,2,3। उपलब्ध कक्षकों 4d, 5s और 5p की ऊर्जा बढ़ने का क्रम 5s < 4d < 5p है। उपलब्ध कुल कक्षकों की संख्या 9 है। अधिकतम इलेक्ट्रॉनों की संख्या जिन्हें समायोजित किया जा सकता है वह 18 है; और इसलिए 5वीं अवधि में 18 तत्व हैं।
(b) समूहवार इलेक्ट्रॉनिक विन्यास
एक ही ऊर्ध्वाधर स्तंभ या समूह में स्थित तत्वों के इलेक्ट्रॉनिक विन्यास समान होते हैं, बाह्य कक्षकों में समान संख्या में इलेक्ट्रॉन होते हैं, और गुण समान होते हैं। उदाहरण के लिए, समूह 1 के तत्व (क्षार धातुएं) सभी का इलेक्ट्रॉनिक विन्यास ns¹ होता है जैसा नीचे दिखाया गया है।
| परमाणु संख्या | प्रतीक | इलेक्ट्रॉनिक विन्यास |
|---|---|---|
| 3 | Li | 1s² 2s¹ (या) [He] 2s¹ |
| 11 | Na | 1s² 2s² 2p⁶ 3s¹ (या) [Ne] 3s¹ |
| 19 | K | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ (या) [Ar] 4s¹ |
| 37 | Rb | 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁶ 5s¹ (या) [Kr] 5s¹ |
| 55 | Cs | 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁶ 4d¹⁰ 5s² 5p⁶ 6s¹ (या) [Xe] 6s¹ |
| 87 | Fr | [Rn] 7s¹ |
इस प्रकार यह देखा जा सकता है कि किसी तत्व के गुणों का आवर्ती निर्भरता उसकी परमाणु संख्या पर होती है, न कि सापेक्ष परमाणु द्रव्यमान पर।
3.6 इलेक्ट्रॉनिक विन्यास और तत्वों के प्रकार: s-, p-, d-, f- ब्लॉक
ऑर्बाउ (निर्माण) सिद्धांत और परमाणुओं की इलेक्ट्रॉनिक विन्यास आवर्त वर्गीकरण के लिए एकै सैद्धांतिक आधार प्रदान करते हैं। आवर्त सारणी के एक ऊध्र्वाधर स्तंभ में स्थित तत्व एक समूह या परिवार बनाते हैं और समान रासायनिक व्यवहार प्रदर्शित करते हैं। यह समानता इसलिए उत्पन्न होती है क्योंकि इन तत्वों में बाहरीतम ऑर्बिटलों में इलेक्ट्रॉनों की समान संख्या और समान वितरण होता है। हम तत्वों को चार ब्लॉकों—s-ब्लॉक, $\boldsymbol{p}$-ब्लॉक, $\boldsymbol{d}$-ब्लॉक और $\boldsymbol{f}$-ब्लॉक—में वर्गीकृत कर सकते हैं, यह इस बात पर निर्भर करता है कि किस प्रकार की परमाण्विक ऑर्बिटलें इलेक्ट्रॉनों से भरी जा रही हैं। यह चित्र 3.3 में दिखाया गया है। हम इस वर्गीकरण में दो अपवाद देखते हैं। कड़ाई से, हीलियम s-ब्लॉक से संबंधित है, परंतु इसे p-ब्लॉक में अन्य समूह 18 तत्वों के साथ रखा गया है और यह स्थान उचित है क्योंकि इसकी संपूर्णतः भरी हुई संयोजक कोश होती है $\left(1 s^{2}\right)$ और इसके परिणामस्वरूप यह अन्य अक्रिय गैसों के समान गुण प्रदर्शित करता है। दूसरा अपवाद हाइड्रोजन है। इसमें केवल एक s-इलेक्ट्रॉन होता है और इसलिए इसे समूह 1 (क्षार धातुओं) में रखा जा सकता है। यह एक इलेक्ट्रॉन ग्रहण करके अक्रिय गैस व्यवस्था प्राप्त कर सकता है और इसलिए यह समूह 17 (हैलोजन परिवार) के तत्वों के समान व्यवहार कर सकता है। चूँकि यह एक विशेष स्थिति है, हम हाइड्रोजन को आवर्त सारणी के शीर्ष पर, चित्र 3.2 और चित्र 3.3 में दिखाए अनुसार, पृथक रखेंगे। हम आवर्त सारणी में चिह्नित चार प्रकार के तत्वों की प्रमुख विशेषताओं पर संक्षेप में चर्चा करेंगे। इन तत्वों के बारे में अधिक विवरण बाद में दिया जाएगा। उनकी विशेषताओं के वर्णन के दौरान कुछ शब्दावली का प्रयोग किया गया है जिसे अनुभाग 3.7 में वर्गीकृत किया गया है।
3.6.1 s-ब्लॉक तत्व
समूह 1 (क्षार धातुएँ) और समूह 2 (क्षारीय मृदा धातुएँ) के तत्व, जिनकी बाह्यतम इलेक्ट्रॉनिक विन्यास $n s^{1}$ और $n s^{2}$ होती है, s-ब्लॉक तत्वों से संबंधित हैं। ये सभी क्रियाशील धातुएँ हैं जिनकी आयनन एन्थैल्पी कम होती है। ये बाह्यतम इलेक्ट्रॉन(ों) को सरलता से त्यागकर $1+$ आयन (क्षार धातुओं के मामले में) या $2+$ आयन (क्षारीय मृदा धातुओं के मामले में) बनाते हैं। धातु-प्रकृति और क्रियाशीलता समूह में नीचे जाने पर बढ़ती है। उच्च क्रियाशीलता के कारण ये कभी भी शुद्ध रूप में प्रकृति में नहीं पाए जाते हैं। s-ब्लॉक तत्वों के यौगिक, लिथियम और बेरिलियम के यौगिकों को छोड़कर, प्रायः आयनिक होते हैं।
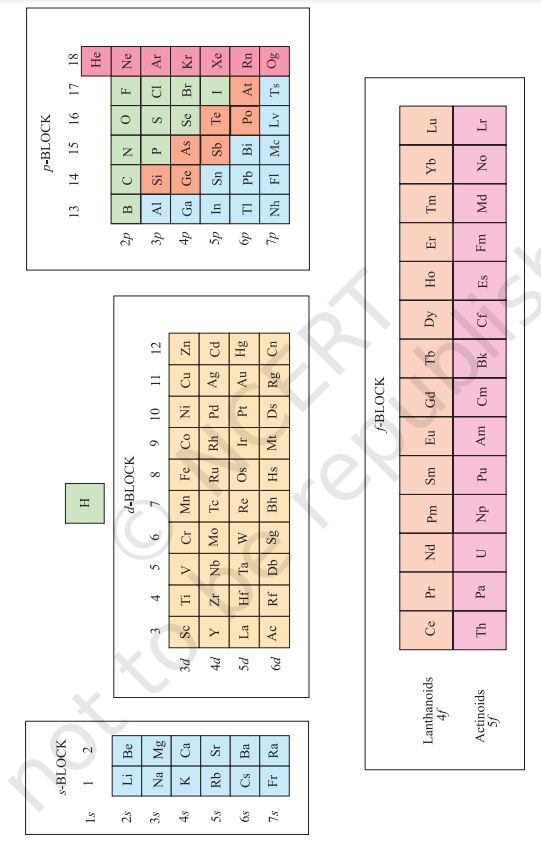
आकृति 3.3 आवर्त सारणी में तत्वों के प्रकार उन कक्षकों के आधार पर जिन्हें भरा जा रहा है। साथ ही तत्वों का व्यापक विभाजन धातुओं, अधातुओं और उपधातुओं में भी दिखाया गया है।
3.6.2 p-ब्लॉक तत्व
$\boldsymbol{p}$-ब्लॉक तत्व वे होते हैं जो समूह 13 से 18 तक आते हैं और ये सभी s-ब्लॉक तत्वों के साथ मिलकर प्रतिनिधि तत्व या मुख्य समूह तत्व कहलाते हैं। प्रत्येक आवर्त में बाह्यतम इलेक्ट्रॉनिक विन्यास $n s^{2} n p^{1}$ से $n s^{2} n p^{6}$ तक भिन्न होता है। प्रत्येक आवर्त के अंत में एक निष्क्रिय गैस तत्व होता है जिसकी बाह्य कोश बंद होती है और उसका विन्यास $n s^{2} n p^{6}$ होता है। निष्क्रिय गैसों की बाह्य कोश में सभी कक्षक इलेक्ट्रॉनों से पूरी तरह भरे होते हैं और इस स्थिर व्यवस्था को इलेक्ट्रॉनों की वृद्धि या हानि द्वारा बदलना अत्यंत कठिन होता है। इस प्रकार निष्क्रिय गैसें रासायनिक दृष्टि से अत्यंत कम सक्रियता प्रदर्शित करती हैं। निष्क्रिय गैस परिवार से ठीक पहले दो रासायनिक दृष्टि से महत्वपूर्ण अधातु समूह होते हैं। वे हैं हैलोजन (समूह 17) और कॉल्कोजन (समूह 16)। इन दोनों समूहों के तत्वों की इलेक्ट्रॉन लब्धि एन्थैल्पी अत्यधिक ऋणात्मक होती है और ये क्रमशः एक या दो इलेक्ट्रॉन आसानी से ग्रहण कर स्थिर निष्क्रिय गैस विन्यास प्राप्त कर लेते हैं। एक आवर्त में बाएँ से दाएँ जाने पर अधात्विक लक्षण बढ़ता है और समूह में नीचे जाने पर धात्विक लक्षण बढ़ता है।
3.6.3 d-ब्लॉक तत्व (संक्रमण तत्व)
ये तत्व आवर्त सारणी के केंद्र में स्थित समूह 3 से 12 के तत्व हैं। इनकी विशेषता यह है कि इनमें इलेक्ट्रॉन भीतरी $d$ कक्षकों में भरे जाते हैं, इसलिए इन्हें d-ब्लॉक तत्व कहा जाता है। इन तत्वों की सामान्य बाह्य इलेक्ट्रॉनिक विन्यास $(n-1) d^{1-10} n s^{0-2}$ होती है, सिवाय $\mathrm{Pd}$ के जिसकी इलेक्ट्रॉनिक विन्यास $4 \mathrm{~d}^{10} 5 \mathrm{~s}^{0}$ है। ये सभी धातु हैं। ये अधिकांशतः रंगीन आयन बनाते हैं, परिवर्ती संयोजकता (ऑक्सीकरण अवस्थाएँ), अनुचुंबकत्व प्रदर्शित करते हैं और प्रायः उत्प्रेरक के रूप में प्रयुक्त होते हैं। हालाँकि, Zn, $\mathrm{Cd}$ और $\mathrm{Hg}$ जिनकी इलेक्ट्रॉनिक विन्यास $(n-1) d^{10} n s^{2}$ है, वे संक्रमण तत्वों के अधिकांश गुण नहीं दिखाते। एक तरह से, संक्रमण धातु रासायनिक रूप से सक्रिय s-ब्लॉक तत्वों और कम सक्रिय समूह 13 और 14 के तत्वों के बीच एक सेतु का कार्य करते हैं और इस प्रकार इन्हें “संक्रमण तत्व” का प्रचलित नाम मिला है।
3.6.4 f-ब्लॉक तत्व (आंतरिक-संक्रमण तत्व)
आवर्त सारणी के नीचे दो पंक्तियों में स्थित तत्व, जिन्हें लैन्थेनॉयड, $\mathrm{Ce}(Z=58)-\mathrm{Lu}(Z=71)$ और ऐक्टिनॉयड, $\operatorname{Th}(Z=90)-\operatorname{Lr}(Z=103)$ कहा जाता है, इनकी बाह्य इलेक्ट्रॉनिक विन्यास $(n-2) f^{1-14}$ $(n-1) d^{0-1} n s^{2}$ द्वारा विशेषता होती है। प्रत्येक तत्व में अंतिम इलेक्ट्रॉन $f$-कक्षक में भरा जाता है। इन दोनों श्रृंखलाओं के तत्वों को इसलिए आंतरिक संक्रमण तत्व (f-ब्लॉक तत्व) कहा जाता है। ये सभी धातु हैं। प्रत्येक श्रृंखला के भीतर तत्वों के गुण काफी समान होते हैं। प्रारंभिक ऐक्टिनॉयडों की रसायन शास्त्र संगत लैन्थेनॉयडों की तुलना में अधिक जटिल होती है, क्योंकि इन ऐक्टिनॉयड तत्वों के लिए संभावित ऑक्सीकरण अवस्थाओं की संख्या अधिक होती है। ऐक्टिनॉयड तत्व रेडियोधर्मी होते हैं। इनमें से अनेक तत्व नाभिकीय अभिक्रियाओं द्वारा केवल नैनोग्राम मात्रा या उससे भी कम में बनाए गए हैं और इनका रसायन पूरी तरह से अध्ययन नहीं किया गया है। यूरेनियम के बाद के तत्वों को ट्रांसयूरेनियम तत्व कहा जाता है।
प्रश्न 3.3
तत्व $Z=117$ और 120 अभी तक खोजे नहीं गए हैं। आप इन तत्वों को किस कुल/समूह में रखेंगे और प्रत्येक स्थिति में इलेक्ट्रॉनिक विन्यास भी दीजिए।
हल
हम आकृति 3.2 से देखते हैं कि $Z=117$ वाला तत्व हैलोजन कुल (समूह 17) से संबंधित होगा और इसका इलेक्ट्रॉनिक विन्यास $[\mathrm{Rn}]$ $5 f^{14} 6 d^{10} 7 s^{2} 7 p^{5}$ होगा। $Z=120$ वाला तत्व समूह 2 (क्षारीय मृदा धातुओं) में रखा जाएगा और इसका इलेक्ट्रॉनिक विन्यास [Uuo] $8 s^{2}$ होगा।
3.6.5 धातु, अधातु और उपधातु
इसके अतिरिक्त $\boldsymbol{s}$-, $\boldsymbol{p}$-, $\boldsymbol{d}$-, और $\boldsymbol{f}$-ब्लॉकों में तत्वों के वर्गीकरण को प्रदर्शित करने के, आकृति 3.3 तत्वों के एक अन्य व्यापक वर्गीकरण को भी दर्शाती है जो उनके गुणों पर आधारित है। तत्वों को धातुओं और अधातुओं में विभाजित किया जा सकता है। धातुएं सभी ज्ञात तत्वों के $78 %$ से अधिक हैं और आवर्त सारणी के बाईं ओर स्थित होती हैं। धातुएं प्रायः कमरे के तापमान पर ठोस होती हैं [पारा एक अपवाद है; गैलियम और सीज़ियम के भी बहुत कम गलनांक होते हैं $(303 \mathrm{~K}$ और 302K क्रमशः)]। धातुओं के सामान्यतः उच्च गलनांक और क्वथनांक होते हैं। वे ऊष्मा और विद्युत के अच्छे चालक होते हैं। वे पिटने योग्य (हथौड़े से पीटकर पतली चादरों में समतल किए जा सकते हैं) और तार खींचे जाने योग्य होते हैं। इसके विपरीत, अधातु आवर्त सारणी के ऊपर दाईं ओर स्थित होते हैं। वास्तव में, एक क्षैतिज पंक्ति में तत्वों के गुण बाईं ओर धात्विक से दाईं ओर अधात्वीय में बदलते हैं। अधातु प्रायः कमरे के तापमान पर ठोस या गैस होते हैं और उनके गलनांक और क्वथनांक कम होते हैं (बोरॉन और कार्बन अपवाद हैं)। वे ऊष्मा और विद्युत के खराब चालक होते हैं। अधिकांश अधात्वीय ठोस भुरभुरे होते हैं और न तो पिटने योग्य होते हैं और न ही तार खींचे जाने योग्य। जब हम किसी समूह में नीचे जाते हैं तो तत्व अधिक धात्वीय बनते हैं; आवर्त सारणी में बाईं ओर से दाईं ओर जाने पर अधात्वीय लक्षण बढ़ते हैं। धात्वीय से अधात्वीय लक्षण में परिवर्तन अचानक नहीं होता जैसा कि आकृति 3.3 में मोटी ज़िग-ज़ैग रेखा द्वारा दिखाया गया है। इस रेखा की सीमा वाले और आवर्त सारणी में तिरछे पार करने वाले तत्व (जैसे सिलिकॉन, जर्मेनियम, आर्सेनिक, एन्टीमनी और टेलुरियम) ऐसे गुण दिखाते हैं जो धातुओं और अधातुओं दोनों के लिए विशेष होते हैं। इन तत्वों को अर्ध-धातु या मेटालॉयड कहा जाता है।
प्रश्न 3.4
परमाणु क्रमांक और आवर्त सारणी में स्थिति को ध्यान में रखते हुए निम्नलिखित तत्वों को धात्विक लक्षण के बढ़ते क्रम में व्यवस्थित कीजिए :
$\mathrm{Si}, \mathrm{Be}, \mathrm{Mg}$, $\mathrm{Na}, \mathrm{P}$.
हल
धात्विक लक्षण एक वर्ग में नीचे की ओर बढ़ता है और एक आवर्त में बाएँ से दाएँ जाने पर घटता है। इसलिए धात्विक लक्षण के बढ़ते क्रम का क्रम इस प्रकार है:
$\mathrm{P}<\mathrm{Si}<\mathrm{Be}<\mathrm{Mg}<\mathrm{Na}$।
3.7 तत्वों के गुणों में आवर्ती प्रवृत्तियाँ
जब हम आवर्त सारणी में किसी वर्ग में नीचे जाते हैं या किसी आवृत्ति में आगे बढ़ते हैं, तो तत्वों के भौतिक और रासायनिक गुणों में कई प्रेक्षणीय प्रतिरूप देखे जा सकते हैं। उदाहरण के लिए, एक आवर्त के भीतर, रासायनिक क्रियाशीलता समूह 1 के धातुओं में अधिक होती है, सारणी के मध्य के तत्वों में कम होती है, और समूह 17 के अधातुओं में अधिकतम हो जाती है। इसी प्रकार, प्रतिनिधि धातुओं के किसी वर्ग (मान लीजिए क्षार धातुओं) के भीतर, वर्ग में नीचे जाने पर क्रियाशीलता बढ़ती है, जबकि अधातुओं के किसी वर्ग (मान लीजिए हैलोजनों) के भीतर, वर्ग में नीचे जाने पर क्रियाशीलता घटती है। लेकिन तत्वों के गुण ये प्रवृत्तियाँ क्यों अपनाते हैं? और हम आवर्तिता की व्याख्या कैसे कर सकते हैं? इन प्रश्नों के उत्तर देने के लिए, हमें परमाणु संरचना के सिद्धांतों और परमाणु के गुणों को देखना होगा। इस खंड में हम कुछ भौतिक और रासायनिक गुणों में आवर्ती प्रवृत्तियों की चर्चा करेंगे और उन्हें इलेक्ट्रॉनों की संख्या और ऊर्जा स्तरों के संदर्भ में समझाने का प्रयास करेंगे।
3.7.1 भौतिक गुणों में प्रवृत्तियाँ
तत्वों के अनेक भौतिक गुण होते हैं जैसे गलनांक और क्वथनांक, संगलन और वाष्पीकरण की ऊष्मा, परमाणुकृत ऊर्जा आदि, जो आवर्ती परिवर्तन दिखाते हैं। तथापि, हम परमाणु और आयनिक त्रिज्या, आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी और विद्युतऋणात्मकता के संदर्भ में आवर्ती प्रवृत्तियों की चर्चा करेंगे।
(a) परमाणु त्रिज्या
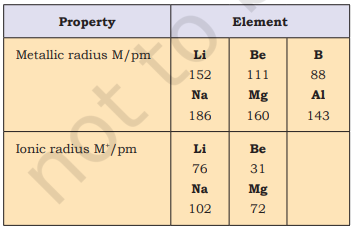
आप बखूबी कल्पना कर सकते हैं कि किसी परमाणु का आकार ज्ञात करना किसी गेंद की त्रिज्या मापने से कहीं अधिक जटिल है। क्या आप जानते हैं क्यों? पहली बात तो यह कि परमाणु का आकार ($1.2 \mathring{A}$ अर्थात् $1.2 \times 10^{-10} \mathrm{~m}$ त्रिज्या) बहुत छोटा होता है। दूसरे, चूँकि परमाणु को घेरे हुए इलेक्ट्रॉन बादल की कोई स्पष्ट सीमा नहीं होती, इसलिए परमाणु के आकार का निर्धारण सटीक नहीं हो सकता। दूसरे शब्दों में, किसी व्यक्तिगत परमाणु का आकार मापने का कोई व्यावहारिक तरीका नहीं है। तथापि, संयुक्त अवस्था में परमाणुओं के बीच की दूरी को जानकर परमाणु के आकार का एक अनुमान लगाया जा सकता है। किसी अधात्विक तत्व के परमाणु के आकार का अनुमान लगाने का एक व्यावहारिक उपाय यह है कि जब दो परमाणु एक सहसंयोजक अणु में एकल बंध द्वारा आबद्ध होते हैं, तब उनके बीच की दूरी मापी जाए और इस मान से तत्व की “सहसंयोजक त्रिज्या” परिकलित की जा सके। उदाहरण के लिए, क्लोरीन अणु $\left(\mathrm{Cl}_{2}\right)$ में बंध दूरी $198 \mathrm{pm}$ है और इस दूरी का आधा $(99 \mathrm{pm})$, क्लोरीन की परमाणु त्रिज्या माना जाता है। धातुओं के लिए हम “धात्विक त्रिज्या” शब्द को परिभाषित करते हैं जिसे धात्विक क्रिस्टल में धातु कोरों को अलग करने वाली अंतराभिकीय दूरी के आधे के रूप में लिया जाता है। उदाहरण के लिए, ठोस तांबे में दो संलग्न तांबा परमाणुओं के बीच की दूरी $256 \mathrm{pm}$ है; अतः तांबे की धात्विक त्रिज्या का मान $128 \mathrm{pm}$ निर्धारित किया गया है। सरलता के लिए, इस पुस्तक में हम परमाणु त्रिज्या शब्द का प्रयोग तत्व के अधातु या धातु होने के आधार पर सहसंयोजक या धात्विक त्रिज्या दोनों के लिए करते हैं। परमाणु त्रिज्याओं को $X$-रे या अन्य स्पेक्ट्रोस्कोपी विधियों द्वारा मापा जा सकता है।
कुछ तत्वों की परमाण्विक त्रिज्याएँ सारणी 3.6 में सूचीबद्ध हैं। दो प्रवृत्तियाँ स्पष्ट हैं। हम इन प्रवृत्तियों को नाभिकीय आवेश और ऊर्जा स्तर के संदर्भ में समझा सकते हैं। परमाणु का आकार आमतौर पर एक आवर्त में घटता है जैसा कि द्वितीय आवर्त के तत्वों के लिए चित्र 3.4(क) में दिखाया गया है। ऐसा इसलिए है क्योंकि आवर्त के भीतर बाह्य इलेक्ट्रॉन समान संयोजी कोश में होते हैं और प्रभावी नाभिकीय आवेश परमाणु क्रमांक बढ़ने के साथ बढ़ता है, जिससे इलेक्ट्रॉनों का नाभिक की ओर आकर्षण बढ़ता है। आवर्त सारणी के एक वर्ग या ऊध्र्वाधर स्तंभ के भीतर, परमाण्विक त्रिज्या परमाणु क्रमांक के साथ नियमित रूप से बढ़ती है जैसा कि चित्र 3.4(ख) में दिखाया गया है। क्षार धातुओं और हैलोजनों के लिए, जैसे-जैसे हम समूहों में नीचे जाते हैं, प्रधान क्वांटम संख्या $(n)$ बढ़ती है और संयोजी इलेक्ट्रॉन नाभिक से दूर होते हैं। ऐसा इसलिए होता है क्योंकि आंतरिक ऊर्जा स्तर इलेक्ट्रॉनों से भरे होते हैं, जो बाह्य इलेक्ट्रॉनों को नाभिक के आकर्षण से बचाते हैं। परिणामस्वरूप परमाणु का आकार बढ़ता है जैसा कि परमाण्विक त्रिज्याओं में दिखाई देता है।
ध्यान दें कि निष्क्रिय गैसों की परमाण्विक त्रिज्याओं को यहाँ विचार में नहीं लिया गया है। एकल परमाणु होने के कारण उनके (अ-संयुक्त त्रिज्या) मान बहुत बड़े होते हैं। वास्तव में निष्क्रिय गैसों की त्रिज्याओं की तुलना सहसंयोजक त्रिज्याओं से नहीं बल्कि अन्य तत्वों की वान् डर वाल्स त्रिज्याओं से की जानी चाहिए।
सारणी 3.6(क) आवर्तों में परमाण्विक त्रिज्याएँ/pm
| परमाणु (द्वितीय आवर्त) | Li | Be | B | $\mathbf{C}$ | $\mathbf{N}$ | $\mathbf{O}$ | $\mathbf{F}$ |
| परमाणु त्रिज्या | 152 | 111 | 88 | 77 | 74 | 66 | 64 |
| परमाणु (तृतीय आवर्त) | $\mathbf{N a}$ | $\mathbf{M g}$ | $\mathbf{A l}$ | $\mathbf{S i}$ | $\mathbf{P}$ | $\mathbf{S}$ | $\mathbf{C l}$ |
| परमाणु त्रिज्या | 186 | 160 | 143 | 117 | 110 | 104 | 99 |
तालिका 3.6(b) एक वर्ग में नीचे की ओर परमाणु त्रिज्याएँ/pm
| परमाणु (वर्ग I) |
परमाणु त्रिज्या |
परमाणु (वर्ग 17) |
परमाणु त्रिज्या |
|---|---|---|---|
| $\mathbf{L i}$ | 152 | $\mathbf{F}$ | 64 |
| $\mathbf{N a}$ | 186 | $\mathbf{C l}$ | 99 |
| $\mathbf{K}$ | 231 | $\mathbf{B r}$ | 114 |
| $\mathbf{R b}$ | 244 | $\mathbf{I}$ | 133 |
| $\mathbf{C s}$ | 262 | $\mathbf{A t}$ | 140 |
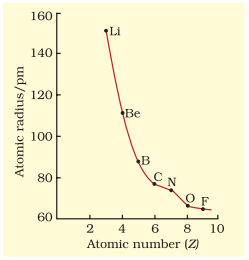
आकृति 3.4 (a) द्वितीय आवर्त में परमाणु क्रमांक के साथ परमाणु त्रिज्या का परिवर्तन
(b) आयन त्रिज्या
किसी परमाणु से एक इलेक्ट्रॉन के निष्कासन से धनायन (कैशन) का निर्माण होता है, जबकि एक इलेक्ट्रॉन के प्राप्त होने से ऋणायन (ऐनियन) बनता है। आयनिक त्रिज्याओं का आकलन आयनिक क्रिस्टलों में धनायनों और ऋणायनों के बीच की दूरियों को मापकर किया जा सकता है। सामान्यतः, तत्वों की आयनिक त्रिज्याएँ परमाणु त्रिज्याओं के समान प्रवृत्ति दर्शाती हैं। एक धनायन अपने मूल परमाणु से छोटा होता है क्योंकि उसमें इलेक्ट्रॉन कम होते हैं जबकि उसका नाभिकीय आवेश समान रहता है। एक ऋणायन का आकार मूल परमाणु से बड़ा होगा क्योंकि एक या अधिक इलेक्ट्रॉनों की वृद्धि से इलेक्ट्रॉनों के बीच प्रतिकर्षण बढ़ता है और प्रभावी नाभिकीय आवेश घटता है। उदाहरण के लिए, फ्लोराइड आयन $\left(\mathrm{F}^{-}\right)$ की आयनिक त्रिज्या $136 \mathrm{pm}$ है जबकि फ्लोरीन की परमाणु त्रिज्या केवल $64 \mathrm{pm}$ है। दूसरी ओर, सोडियम की परमाणु त्रिज्या $186 \mathrm{pm}$ है जबकि $\mathrm{Na}^{+}$ की आयनिक त्रिज्या $95 \mathrm{pm}$ है।
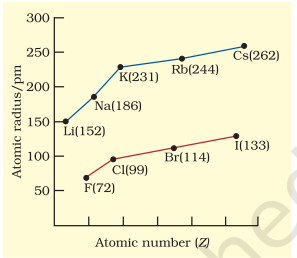
आकृति 3.4 (b) क्षार धातुओं और हैलोजनों के लिए परमाणु संख्या के साथ परमाणु त्रिज्या में परिवर्तन
जब हमें कुछ परमाणु और आयन मिलते हैं जिनमें इलेक्ट्रॉनों की समान संख्या होती है, तो हम उन्हें समइलेक्ट्रॉनिक प्रजातियाँ कहते हैं[^1]। उदाहरण के लिए, $\mathrm{O}^{2-}, \mathrm{F}^{-}, \mathrm{Na}^{+}$ और $\mathrm{Mg}^{2+}$ में इलेक्ट्रॉनों की समान संख्या (10) होती है। उनकी त्रिज्याएँ उनके भिन्न नाभिकीय आवेशों के कारण भिन्न-भिन्न होंगी। जिस धनात्मक आवेश वाले धनायन का आवेश अधिक होगा, उसकी त्रिज्या छोटी होगी क्योंकि इलेक्ट्रॉनों पर नाभिक का आकर्षण अधिक होता है। जिस ऋणात्मक आवेश वाले ऋणायन का आवेश अधिक होगा, उसकी त्रिज्या बड़ी होगी। इस स्थिति में, इलेक्ट्रॉनों का निवार आकर्षण नाभिकीय आवेश से अधिक होगा और आयन का आकार फैल जाएगा।
प्रश्न 3.5
निम्नलिखित में से कौन-सी प्रजाति सबसे बड़े और सबसे छोटे आकार की होगी?
$\mathrm{Mg}, \mathrm{Mg}^{2+}, \mathrm{Al}, \mathrm{Al}^{3+}$।
हल
एक आवर्त में परमाण्वीय त्रिज्याएँ घटती हैं। धनायन अपने मूल परमाणुओं से छोटे होते हैं। समइलेक्ट्रॉनिक प्रजातियों में, जिसका धनात्मक नाभिकीय आवेश अधिक होता है, उसकी त्रिज्या छोटी होती है।
इसलिए सबसे बड़ी प्रजाति $\mathrm{Mg}$ है; सबसे छोटी प्रजाति $\mathrm{Al}^{3+}$ है।
(c) आयनन एन्थैल्पी
किसी तत्व द्वारा इलेक्ट्रॉन खोने की प्रवृत्ति का मात्रात्मक माप उसकी आयनन एन्थैल्पी द्वारा दिया जाता है। यह उस ऊर्जा को दर्शाती है जो किसी पृथक गैसीय परमाणु (X) को उसकी आधारभूत अवस्था से इलेक्ट्रॉन हटाने के लिए आवश्यक होती है।
दूसरे शब्दों में, किसी तत्व $\mathrm{X}$ के लिए प्रथम आयनन एन्थैल्पी, समीकरण 3.1 में दर्शाए गए अभिक्रिया के लिए एन्थैल्पी परिवर्तन $\left(\Delta_{i} H\right)$ होता है।
$$\mathrm{X}(\mathrm{g}) \rightarrow \mathrm{X}^{+}(\mathrm{g})+\mathrm{e}^{-} \tag{3.1}$$
आयनन एन्थैल्पी को $\mathrm{kJ} \mathrm{mol}^{-1}$ इकाइयों में व्यक्त किया जाता है। हम द्वितीय आयनन एन्थैल्पी को उस ऊर्जा के रूप में परिभाषित कर सकते हैं जो दूसरे सबसे ढीले बंधे इलेक्ट्रॉन को हटाने के लिए आवश्यक होती है; यह समीकरण 3.2 में दर्शाए गए अभिक्रिया को करने के लिए आवश्यक ऊर्जा है।
$$\mathrm{X}^{+}(\mathrm{g}) \rightarrow \mathrm{X}^{2+}(\mathrm{g})+\mathrm{e}^{-} \tag{3.2}$$
किसी परमाणु से इलेक्ट्रॉन हटाने के लिए सदैव ऊर्जा की आवश्यकता होती है और इसलिए आयनन एन्थैल्पी सदैव धनात्मक होती हैं। द्वितीय आयनन एन्थैल्पी, प्रथम आयनन एन्थैल्पी से अधिक होगी क्योंकि किसी धनावेशित आयन से इलेक्ट्रॉन को हटाना, किसी उदासीन परमाणु से इलेक्ट्रॉन हटाने की तुलना में अधिक कठिन होता है। इसी प्रकार तृतीय आयनन एन्थैल्पी, द्वितीय आयनन एन्थैल्पी से अधिक होगी और इसी तरह आगे भी। “आयनन एन्थैल्पी” शब्द, यदि स्पष्ट नहीं किया गया हो, तो इसे प्रथम आयनन एन्थैल्पी के रूप में लिया जाता है।
पहले आयनन एन्थैल्पी को तत्वों के लिए जिनकी परमाणु संख्या 60 तक है, चित्र 3.5 में दर्शाया गया है। ग्राफ की आवर्तता काफी प्रमुख है। आपको निष्क्रिय गैसों पर अधिकतम मिलेंगे जिनके इलेक्ट्रॉन कोश बंद होते हैं और बहुत स्थिर इलेक्ट्रॉन विन्यास होता है। दूसरी ओर, न्यूनतम क्षार धातुओं पर होते हैं और उनकी कम आयनन एन्थैल्पी उनकी उच्च क्रियाशीलता से संबंधित हो सकती है।
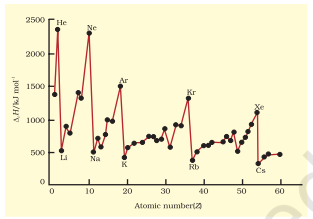
चित्र 3.5 पहले आयनन एन्थैल्पी ($∆_i$ H) में परिवर्तन परमाणु संख्या के साथ Z = 1 से 60 तक के तत्वों के लिए
इसके अतिरिक्त, आप दो प्रवृत्तियाँ देखेंगे: पहला आयनन एन्थैल्पी सामान्यतः एक आवर्त में बाएँ से दाएँ जाने पर बढ़ता है और एक वर्ग में नीचे जाने पर घटता है। ये प्रवृत्तियाँ चित्र 3.6(a) और 3.6(b) में क्रमशः द्वितीय आवर्त और आवर्त सारणी के प्रथम वर्ग के तत्वों के लिए दिखाई गई हैं। आप समझेंगे कि आयनन एन्थैल्पी और परमाणु त्रिज्या निकट से संबंधित गुण हैं। इन प्रवृत्तियों को समझने के लिए हमें दो कारकों पर विचार करना होगा: (i) इलेक्ट्रॉनों का नाभिक की ओर आकर्षण, और (ii) इलेक्ट्रॉनों का एक-दूसरे से प्रतिकर्षण।

आकृति 3.6 (a) द्वितीय आवर्त के तत्वों की प्रथम आयनन एन्थैल्पी (∆i H) परमाणु संख्या (Z) के फलन के रूप में और आकृति 3.6(b) क्षार धातुओं की ∆i H, Z के फलन के रूप में।
किसी परमाणु में संयोजी इलेक्ट्रॉन द्वारा अनुभव किया गया प्रभावी नाभिकीय आवेश, नाभक पर वास्तविक आवेश से कम होता है क्योंकि संयोजी इलेक्ट्रॉन को नाभक से “ढाल” या “स्क्रीनिंग” करने वाले मध्यस्थ कोर इलेक्ट्रॉन होते हैं। उदाहरण के लिए, लिथियम में $2 s$ इलेक्ट्रॉन को नाभक से $1 \mathrm{~s}$ इलेक्ट्रॉनों के भीतरी कोर द्वारा ढाला जाता है। परिणामस्वरूप, संयोजी इलेक्ट्रॉन एक धनात्मक निवल आवेश अनुभव करता है जो +3 से कम होता है। सामान्यतः, ढाल प्रभावी तब होता है जब आंतरिक कोशों के कक्षक पूर्णतः भरे होते हैं। यह स्थिति क्षार धातुओं में होती है जिनमें एकल बाह्यतम $n s$-इलेक्ट्रॉन एक निष्क्रिय गैस इलेक्ट्रॉनिक विन्यास के पश्चात होता है।
जब हम दूसरे आवर्त में लिथियम से फ्लोरीन की ओर बढ़ते हैं, तो क्रमिक इलेक्ट्रॉन एक ही प्रधान क्वांटम स्तर की कक्षकों में जोड़े जाते हैं और इलेक्ट्रॉनों के आंतरिक कोर द्वारा नाभिकीय आवेश की ढाल प्रभावी रूप से इलेक्ट्रॉन के नाभिक की ओर बढ़ते आकर्षण को संतुलित करने के लिए अधिक नहीं बढ़ती। इस प्रकार, एक आवर्त में बढ़ता हुआ नाभिकीय आवेश ढाल को पार कर जाता है। परिणामस्वरूप, बाह्यतम इलेक्ट्रॉन अधिक से अधिक कसकर पकड़े जाते हैं और आयनन एन्थैल्पी एक आवर्त में बढ़ता है। जब हम एक समूह में नीचे जाते हैं, तो बाह्यतम इलेक्ट्रॉन नाभिक से तेजी से दूर होता जाता है, आंतरिक स्तरों के इलेक्ट्रॉनों द्वारा नाभिकीय आवेश की ढाल में वृद्धि होती है। इस स्थिति में, ढाल में वृद्धि बढ़ते हुए नाभिकीय आवेश को पार कर जाती है और एक समूह में नीचे बाह्यतम इलेक्ट्रॉन को हटाने के लिए कम ऊर्जा की आवश्यकता होती है।
चित्र 3.6(a) से आप यह भी देखेंगे कि बोरॉन $(Z=5)$ की प्रथम आयनन एन्थैल्पी बेरीलियम $(Z=4)$ की तुलना में थोड़ी कम है, यद्यपि पूर्व में नाभिकीय आवेश अधिक है। जब हम एक ही प्रधान क्वांटम स्तर पर विचार करते हैं, तो एक s-इलेक्ट्रॉन p-इलेक्ट्रॉन की तुलना में नाभिक की ओर अधिक आकर्षित होता है। बेरीलियम में, आयनन के दौरान निकाला गया इलेक्ट्रॉन एक s-इलेक्ट्रॉन होता है, जबकि बोरॉन के आयनन के दौरान निकाला गया इलेक्ट्रॉन एक p-इलेक्ट्रॉन होता है। $2 s$-इलेक्ट्रॉन की नाभिक में पैठ $2 p$-इलेक्ट्रॉन की तुलना में अधिक होती है; इसलिए बोरॉन का $2 p$ इलेक्ट्रॉन नाभिक से आंतरिक इलेक्ट्रॉनों द्वारा बेरीलियम के $2 s$ इलेक्ट्रॉनों की तुलना में अधिक स्क्रीन किया जाता है। इसलिए, बोरॉन से $2 p$-इलेक्ट्रॉन को बेरीलियम से $2 s$-इलेक्ट्रॉन को निकालने की तुलना में आसानी से निकाला जा सकता है। इस प्रकार, बोरॉन की प्रथम आयनन एन्थैल्पी बेरीलियम से कम होती है। एक अन्य “विसंगति” ऑक्सीजन की नाइट्रोजन की तुलना में कम प्रथम आयनन एन्थैल्पी है। यह इसलिए है कि नाइट्रोजन परमाणु में तीन $2 p$-इलेक्ट्रॉन विभिन्न परमाणु कक्षकों में होते हैं (हुंड नियम), जबकि ऑक्सीजन परमाणु में चार $2 p$-इलेक्ट्रॉनों में से दो को एक ही $2 p$-कक्षक में रहना पड़ता है जिससे इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। परिणामस्वरूप, ऑक्सीजन से चौथा $2 p$-इलेक्ट्रॉन नाइट्रोजन से तीन $2 p$-इलेक्ट्रॉनों में से एक को निकालने की तुलना में आसानी से निकाला जा सकता है।
प्रश्न 3.6
तीसरी अवधि के तत्वों Na, Mg और Si के प्रथम आयनन एन्थैल्पी (\left(\Delta_{i} H\right)) मान क्रमशः 496, 737 और (786 \mathrm{~kJ}) (\mathrm{mol}^{-1}) हैं। भविष्यवाणी कीजिए कि Al के लिए प्रथम (\Delta_{i} H) मान 575 या (760 \mathrm{~kJ}) (\mathrm{mol}^{-1}) में से किसके अधिक निकट होगा? अपने उत्तर का औचित्य दीजिए।
हल
यह (575 \mathrm{~kJ} \mathrm{~mol}^{-1}) के अधिक निकट होगा। Al का मान Mg से कम होना चाहिए क्योंकि 3s-इलेक्ट्रॉनों द्वारा नाभिक से 3p इलेक्ट्रॉनों की प्रभावी ढालन होती है।
(d) इलेक्ट्रॉन लब्धि एन्थैल्पी
जब किसी उदासीन गैसीय परमाणु ((\mathrm{X})) में एक इलेक्ट्रॉन जोड़कर उसे ऋणायन में रूपांतरित किया जाता है, तो इस प्रक्रिया के साथ जुड़ा एन्थैल्पी परिवर्तन इलेक्ट्रॉन लब्धि एन्थैल्पी (\left(\Delta_{\boldsymbol{e}} \boldsymbol{H}\right)) कहलाता है। इलेक्ट्रॉन लब्धि एन्थैल्पी यह माप प्रदान करती है कि कोई परमाणु ऋणायन बनाने के लिए इलेक्ट्रॉन को कितनी सरलता से जोड़ता है, जैसा कि समीकरण 3.3 द्वारा दर्शाया गया है।
(\mathrm{X}(\mathrm{g})+\mathrm{e}^{-} \rightarrow \mathrm{X}^{-}(\mathrm{g}))
तत्व के आधार पर, परमाणु में इलेक्ट्रॉन जोड़ने की प्रक्रिया या तो ऊष्माशोषी या ऊष्माक्षेपी हो सकती है। अनेक तत्वों के लिए जब परमाणु में इलेक्ट्रॉन जोड़ा जाता है तो ऊर्जा मुक्त होती है और इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होती है।
तालिका 3.7 कुछ मुख्य वर्ग के तत्वों की इलेक्ट्रॉन लब्धि एन्थैल्पी[^2] / (kJ mol-1)
| समूह 1 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ | समूह 16 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ | समूह 17 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ | समूह 0 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ |
|---|---|---|---|---|---|---|---|
| $\mathbf{H}$ | -73 | $\mathbf{H e}$ | +48 | ||||
| $\mathbf{L i}$ | -60 | $\mathbf{O}$ | -141 | $\mathbf{F}$ | -328 | $\mathbf{N e}$ | +116 |
| $\mathbf{N a}$ | -53 | $\mathbf{S}$ | -200 | $\mathbf{C l}$ | -349 | $\mathbf{A r}$ | +96 |
| $\mathbf{K}$ | -48 | $\mathbf{S e}$ | -195 | $\mathbf{B r}$ | -325 | $\mathbf{K r}$ | +96 |
| $\mathbf{R b}$ | -47 | $\mathbf{T e}$ | -190 | $\mathbf{I}$ | -295 | $\mathbf{X e}$ | +77 |
| $\mathbf{C s}$ | -46 | $\mathbf{P o}$ | -174 | $\mathbf{A t}$ | -270 | $\mathbf{R n}$ | +68 |
उदाहरण के लिए, समूह 17 के तत्वों (हैलोजनों) की इलेक्ट्रॉन-लब्धि एन्थैल्पी बहुत अधिक ऋणात्मक होती है क्योंकि वे एक इलेक्ट्रॉन ग्रहण करके स्थिर निष्क्रिय गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर सकते हैं। दूसरी ओर, निष्क्रिय गैसों की इलेक्ट्रॉन-लब्धि एन्थैल्पी बड़ी धनात्मक होती है क्योंकि इलेक्ट्रॉन को अगले उच्च प्रधान क्वांटम स्तर में प्रवेश करना पड़ता है जिससे बहुत अस्थिर इलेक्ट्रॉनिक विन्यास बनता है। यह ध्यान दिया जा सकता है कि आवर्त सारणी में निष्क्रिय गैसों से पहले ऊपर दाईं ओर इलेक्ट्रॉन-लब्धि एन्थैल्पी के मान बड़े ऋणात्मक होते हैं।
तत्वों में इलेक्ट्रॉन लब्धि एन्थैल्पी का परिवर्तन आयनन एन्थैल्पी की तुलना में कम नियमित होता है। एक सामान्य नियम के तौर पर, एक पीरियड में परमाणु क्रमांक बढ़ने के साथ इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती जाती है। एक पीरियड में बाएँ से दाएँ प्रभावी नाभिकीय आवेश बढ़ता है और इसलिए एक छोटे परमाणु में एक इलेक्ट्रॉन जोड़ना आसान होता है क्योंकि जोड़ा गया इलेक्ट्रॉन औसतन धनात्मक आवेशित नाभिक के अधिक निकट होगा। हमें यह भी अपेक्षा करनी चाहिए कि एक समूह में नीचे जाने पर इलेक्ट्रॉन लब्धि एन्थैल्पी कम ऋणात्मक होती जाएगी क्योंकि परमाणु का आकार बढ़ता है और जोड़ा गया इलेक्ट्रॉन नाभिक से दूर होगा। यह आमतौर पर ऐसा ही होता है (तालिका 3.7)। हालाँकि, $\mathrm{O}$ या $F$ की इलेक्ट्रॉन लब्धि एन्थैल्पी उसके बाद वाले तत्व की तुलना में कम ऋणात्मक होती है। ऐसा इसलिए है क्योंकि जब $\mathrm{O}$ या $\mathrm{F}$ में एक इलेक्ट्रॉन जोड़ा जाता है, तो वह इलेक्ट्रॉन छोटे $n=2$ क्वांटम स्तर में जाता है और इस स्तर में मौजूद अन्य इलेक्ट्रॉनों से महत्वपूर्ण प्रतिकर्षण सहता है। $n=3$ क्वांटम स्तर ($\mathrm{S}$ या $\mathrm{Cl}$) के लिए, जोड़ा गया इलेक्ट्रॉन अधिक स्थान घेरता है और इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण काफी कम होता है।
प्रश्न 3.7
निम्नलिखित में से किसकी इलेक्ट्रॉन लब्धि एन्थैल्पी सबसे अधिक ऋणात्मक होगी और किसकी सबसे कम ऋणात्मक? $\mathrm{P}, \mathrm{S}, \mathrm{Cl}, \mathrm{F}$। अपने उत्तर की व्याख्या कीजिए।
हल
इलेक्ट्रॉन लाभ एन्थैल्पी आमतौर पर एक आवर्त में बाएँ से दाएँ जाने पर अधिक ऋणात्मक होती जाती है। एक समूह के भीतर, इलेक्ट्रॉन लाभ एन्थैल्पी नीचे जाने पर कम ऋणात्मक होती जाती है। हालाँकि, $2 p$-कक्षक में एक इलेक्ट्रॉन जोड़ने से बड़े $3 p$-कक्षक में इलेक्ट्रॉन जोड़ने की तुलना में अधिक प्रतिकर्षण होता है। इसलिए सबसे अधिक ऋणात्मक इलेक्ट्रॉन लाभ एन्थैल्पी वाला तत्व क्लोरीन है; सबसे कम ऋणात्मक इलेक्ट्रॉन लाभ एन्थैल्पी वाला तत्व फॉस्फोरस है।
(e) विद्युतऋणता
किसी रासायनिक यौगिक में एक परमाणु की स्वयं की ओर साझा इलेक्ट्रॉनों को आकर्षित करने की क्षमता का गुणात्मक माप विद्युतऋणता कहलाता है। आयनन एन्थैल्पी और इलेक्ट्रॉन लाभ एन्थैल्पी के विपरीत, यह कोई मापनीय राशि नहीं है। फिर भी, तत्वों की विद्युतऋणता की कई संख्यात्मक स्केल—जैसे पॉलिंग स्केल, मुल्लिकेन-जाफे स्केल, ऑलरेड-रोचो स्केल—विकसित की गई हैं। सबसे अधिक प्रयुक्त पॉलिंग स्केल है। अमेरिकी वैज्ञानिक लाइनस पॉलिंग ने 1922 में फ्लोरीन—उस तत्व को जिसे इलेक्ट्रॉनों को आकर्षित करने की सबसे अधिक क्षमता मानी जाती है—को स्वेच्छया से 4.0 का मान दिया। कुछ तत्वों की विद्युतऋणता के सन्निकट मान तालिका 3.8(a) में दिए गए हैं।
किसी दिए गए तत्व की विद्युतऋणता स्थिर नहीं होती; यह इस बात पर निर्भर करती है कि वह किस तत्व से बंधा है। यद्यपि यह कोई मापनीय राशि नहीं है, फिर भी यह यह पूर्वानुमान लगाने का साधन देती है कि परमाणुओं के एक युग्म को एक साथ बाँधने वाला बल किस प्रकृति का होगा—एक संबंध जिसे आप बाद में अन्वेषित करेंगे।
विद्युतऋणात्मकता आमतौर पर आवर्त सारणी में एक आवर्त में बाएँ से दाएँ बढ़ती है (जैसे लिथियम से फ्लोरीन तक) और एक वर्ग में ऊपर से नीचे घटती है (जैसे फ्लोरीन से एस्टेटाइन तक)। इन प्रवृत्तियों की व्याख्या कैसे की जा सकती है? क्या विद्युतऋणात्मकता परमाणु त्रिज्या से संबंधित हो सकती है, जो प्रत्येक आवर्त में बाएँ से दाएँ घटने की प्रवृत्ति रखती है, लेकिन प्रत्येक वर्ग में ऊपर से नीचे बढ़ती है? बाहरी (या संयोजी) इलेक्ट्रॉनों और नाभिक के बीच आकर्षण परमाणु त्रिज्या घटने के साथ बढ़ता है। विद्युतऋणात्मकता भी बढ़ती है।
इसी कारण से एक वर्ग में परमाणु त्रिज्या बढ़ने के साथ विद्युतऋणात्मकता मान घटते हैं। यह प्रवृत्ति आयनन एन्थैल्पी की तरह है।
विद्युतऋणात्मकता और परमाणु त्रिज्या के बीच संबंध को जानकर, क्या आप अब विद्युतऋणात्मकता और अधातु गुणों के बीच संबंध की कल्पना कर सकते हैं?
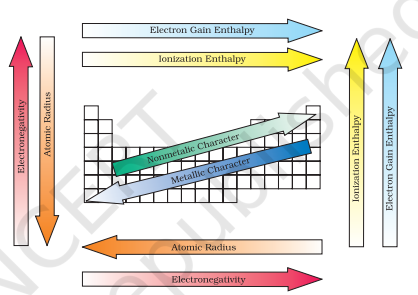
चित्र 3.7 आवर्त सारणी में तत्वों की आवर्ती प्रवृत्तियाँ
तालिका 3.8(क) आवर्तों में विद्युतऋणात्मकता मान (पॉलिंग स्केल पर)
| परमाणु (द्वितीय आवर्त) | $\mathbf{L i}$ | $\mathbf{B e}$ | $\mathbf{B}$ | $\mathbf{C}$ | $\mathbf{N}$ | $\mathbf{O}$ | $\mathbf{F}$ |
|---|---|---|---|---|---|---|---|
| विद्युतऋणात्मकता | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| परमाणु (तृतीय आवर्त) | $\mathbf{N a}$ | $\mathbf{M g}$ | $\mathbf{A l}$ | $\mathbf{S i}$ | $\mathbf{P}$ | $\mathbf{S}$ | $\mathbf{C l}$ |
| विद्युतऋणात्मकता | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
तालिका 3.8(b) एक वर्ग में नीचे की ओर विद्युतऋणात्मकता मान (पॉलिंग पैमाने पर)
| परमाणु (वर्ग I) |
विद्युतऋणात्मकता मान |
परमाणु (वर्ग 17) |
विद्युतऋणात्मकता मान |
|---|---|---|---|
| $\mathbf{L i}$ | 1.0 | $\mathbf{F}$ | 4.0 |
| $\mathbf{N a}$ | 0.9 | $\mathbf{C l}$ | 3.0 |
| $\mathbf{K}$ | 0.8 | $\mathbf{B r}$ | 2.8 |
| $\mathbf{R b}$ | 0.8 | $\mathbf{I}$ | 2.5 |
| $\mathbf{C s}$ | 0.7 | $\mathbf{A t}$ | 2.2 |
अधात्विक तत्वों में इलेक्ट्रॉन ग्रहण करने की प्रबल प्रवृत्ति होती है। इसलिए, विद्युत्-ऋणात्मकता तत्वों की अधात्विक गुणधर्मों से सीधे संबंधित है। इसे आगे बढ़ाकर यह कहा जा सकता है कि विद्युत्-ऋणात्मकता तत्वों की धात्विक गुणधर्मों के व्युत्क्रमानुपाती है। इस प्रकार, एक आवर्त में विद्युत्-ऋणात्मकता में वृद्धि के साथ तत्वों की अधात्विक गुणधर्मों में वृद्धि (या धात्विक गुणधर्मों में कमी) होती है। इसी प्रकार, एक वर्ग में नीचे जाने पर विद्युत्-ऋणात्मकता में कमी के साथ तत्वों की अधात्विक गुणधर्मों में कमी (या धात्विक गुणधर्मों में वृद्धि) होती है।
इन सभी आवर्ती प्रवृत्तियों का सारांश आकृति 3.7 में दिया गया है।
3.7.2 रासायनिक गुणधर्मों में आवर्ती प्रवृत्तियाँ
तत्वों के रासायनिक गुणधर्मों की अधिकांश प्रवृत्तियाँ, जैसे कि विकर्ण संबंध, निष्क्रिय युग्म प्रभाव, लैन्थेनॉइड संकुचन के प्रभाव आदि, प्रत्येक वर्ग की चर्चा के साथ बाद की इकाइयों में की जाएगी। इस खंड में हम तत्वों द्वारा प्रदर्शित संयोजन अवस्थाओं की आवर्तिता और द्वितीय आवर्त के तत्वों (लिथियम से फ्लोरीन तक) की असामान्य गुणधर्मों का अध्ययन करेंगे।
(a) संयोजन या ऑक्सीकरण अवस्थाओं की आवर्तिता
संयोजकता तत्वों की सबसे विशिष्ट संपत्ति है और इसे उनकी इलेक्ट्रॉनिक विन्यास के संदर्भ में समझा जा सकता है। प्रतिनिधि तत्वों की संयोजकता सामान्यतः (हालांकि आवश्यक नहीं) बाह्यतम कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के बराबर होती है और/या बाह्यतम इलेक्ट्रॉनों की संख्या को आठ से घटाने पर प्राप्त संख्या के बराबर होती है जैसा नीचे दिखाया गया है।
आजकल ऑक्सीकरण अवस्था शब्द प्रायः संयोगिता के लिए प्रयुक्त होता है। दो ऑक्सीजन युक्त यौगिकों पर विचार कीजिए: $\mathrm{OF}_2$ और $\mathrm{Na}_2 \mathrm{O}$। इन यौगिकों में सम्मिलित तीन तत्वों की विद्युतऋणात्मकता का क्रम $\mathrm{F}>\mathrm{O}>\mathrm{Na}$ है। फ्लोरीन के प्रत्येक परमाणु, जिसकी बाह्य इलेक्ट्रॉनिक विन्यास $2 s^2 2 p^5$ है, $\mathrm{OF}_2$ अणु में ऑक्सीजन के साथ एक इलेक्ट्रॉन साझा करता है। सर्वाधिक विद्युतऋणात्मक तत्व होने के कारण फ्लोरीन को ऑक्सीकरण अवस्था -1 दी जाती है। चूँकि इस अणु में दो फ्लोरीन परमाणु हैं, $2 s^2 2 p^4$ बाह्य इलेक्ट्रॉनिक विन्यास वाला ऑक्सीजन दो इलेक्ट्रॉन फ्लोरीन परमाणुओं के साथ साझा करता है और इस प्रकार +2 ऑक्सीकरण अवस्था प्रदर्शित करता है। $\mathrm{Na}_2 \mathrm{O}$ में, अधिक विद्युतऋणात्मक होने के कारण ऑक्सीजन दो इलेक्ट्रॉन ग्रहण करता है, दो सोडियम परमाणुओं में से प्रत्येक से एक-एक, और इस प्रकार -2 ऑक्सीकरण अवस्था दर्शाता है। दूसरी ओर, $3 s^1$ इलेक्ट्रॉनिक विन्यास वाला सोडियम ऑक्सीजन को एक इलेक्ट्रॉन त्यागता है और इसे +1 ऑक्सीकरण अवस्था दी जाती है। इस प्रकार, किसी विशेष यौगिक में एक तत्व की ऑक्सीकरण अवस्था को उसके परमाणु द्वारा अर्जित आवेश के रूप में परिभाषित किया जा सकता है, जो अणु में अन्य परमाणुओं से विद्युतऋणात्मक विचार के आधार पर प्राप्त होता है।
प्रश्न 3.8
आवर्त सारणी का प्रयोग करते हुए, उन यौगिकों के सूत्रों की भविष्यवाणी कीजिए जो निम्नलिखित तत्व युग्मों द्वारा बनाए जा सकते हैं; (क) सिलिकॉन और ब्रोमीन (ख) एल्युमिनियम और सल्फर।
हल
(क) सिलिकॉन समूह 14 का तत्व है जिसकी संयोजकता 4 है; ब्रोमीन हैलोजन परिवार से संबंधित है जिसकी संयोजकता 1 है। इसलिए बनने वाले यौगिक का सूत्र $\mathrm{SiBr}_{4}$ होगा।
(ख) एल्युमिनियम समूह 13 से संबंधित है जिसकी संयोजकता 3 है; सल्फर समूह 16 के तत्वों से है जिसकी संयोजकता 2 है। इसलिए बनने वाले यौगिक का सूत्र $\mathrm{Al}_2 \mathrm{~S}_3$ होगा।
तत्वों की संयोजकता में देखी जाने वाली कुछ आवर्ती प्रवृत्तियाँ (हाइड्राइड्स और ऑक्साइड्स) तालिका 3.9 में दिखाई गई हैं। तत्वों के रासायनिक व्यवहार में होने वाली अन्य ऐसी आवर्ती प्रवृत्तियों की चर्चा इस पुस्तक में अन्यत्र की गई है। कई ऐसे तत्व हैं जो परिवर्ती संयोजकता प्रदर्शित करते हैं। यह विशेष रूप से संक्रमण तत्वों और ऐक्टिनॉयड्स की विशेषता है, जिनका अध्ययन हम बाद में करेंगे।
| समूह | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| संयोजक इलेक्ट्रॉन की संख्या |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| संयोजकता | 1 | 2 | 3 | 4 | 3,5 | 2,6 | 1,7 | 0,8 |
तालिका 3.9 तत्वों की संयोजकता में आवर्ती प्रवृत्तियाँ जैसा कि उनके यौगिकों के सूत्रों द्वारा दिखाया गया है
| समूह | 1 | 2 | 13 | 14 | 15 | 16 | 17 |
|---|---|---|---|---|---|---|---|
| हाइड्राइड का सूत्र |
$\mathrm{LiH}$ $\mathrm{NaH}$ $\mathrm{KH}$ |
$\mathrm{CaH}_2$ | $\mathrm{B}_2 \mathrm{H}_6$ $\mathrm{AlH}_3$ |
$\mathrm{CH}_4$ $\mathrm{SiH}_4$ $\mathrm{GeH}_4$ $\mathrm{SnH}_4$ |
$\mathrm{NH}_3$ $\mathrm{PH}_3$ $\mathrm{AsH}_3$ |
$\mathrm{H}_2 \mathrm{O}$ $\mathrm{H}_2 \mathrm{~S}$ $\mathrm{H}_2 \mathrm{Se}$ $\mathrm{H}_2 \mathrm{Te}$ |
$\mathrm{HF}$ $\mathrm{HCl}$ $\mathrm{HBr}$ $\mathrm{HI}$ |
| ऑक्साइड का सूत्र |
$\mathrm{Li}_2 \mathrm{O}$ $\mathrm{Na}_2 \mathrm{O}$ $\mathrm{K}_2 \mathrm{O}$ |
$\mathrm{MgO}$ $\mathrm{CaO}$ $\mathrm{SrO}$ $\mathrm{BaO}$ |
$\mathrm{B}_2 \mathrm{O}_3$ $\mathrm{Al}_2 \mathrm{O}_3$ $\mathrm{Ca}_2 \mathrm{O}_3$ $\mathrm{In}_2 \mathrm{O}_3$ |
$\mathrm{CO}_2$ $\mathrm{SiO}_2$ $\mathrm{GeO}_2$ $\mathrm{SnO}_2$ $\mathrm{PbO}_2$ |
$\mathrm{N}_2 \mathrm{O}_3, \mathrm{~N}_2 \mathrm{O}_5$ $\mathrm{P}_4 \mathrm{O}_6, \mathrm{P}_4 \mathrm{O_10}$ $\mathrm{As}_2 \mathrm{O}_3, \mathrm{As}_2 \mathrm{O}_5$ $\mathrm{Sb}_2 \mathrm{O}_3, \mathrm{Sb}_2 \mathrm{O}_5$ $\mathrm{Bi}_2 \mathrm{O}_3-$ |
$\mathrm{SO}_3$ $\mathrm{SeO}_3$ $\mathrm{TeO}_3$ |
- $\mathrm{Cl}_2 \mathrm{O}_7$ - |
(b) द्वितीय आवर्त के तत्वों की असामान्य गुणधर्म
प्रत्येक समूह 1 (लिथियम) और 2 (बेरिलियम) तथा समूह 13-17 (बोरॉन से फ्लोरीन) के प्रथम तत्व अपने-अपने समूह के अन्य सदस्यों से कई दृष्टियों से भिन्न होते हैं। उदाहरण के लिए, लिथियम अन्य क्षार धातुओं के विपरीत और बेरिलियम अन्य क्षारीय मृदा धातुओं के विपरीत स्पष्ट सहसंयोजक प्रकृति वाले यौगिक बनाते हैं; इन समूहों के अन्य सदस्य प्रायः आयनिक यौगिक बनाते हैं। वास्तव में लिथियम और बेरिलियम का व्यवहार उनके बाद वाले समूह के द्वितीय तत्व, अर्थात् क्रमशः मैग्नीशियम और ऐल्युमिनियम के समान होता है। इस प्रकार की समानता को आवर्त गुणधर्मों में ‘विकर्ण संबंध’ कहा जाता है।
$s$- और $p$-ब्लॉक के तत्वों के किसी समूह के प्रथम सदस्य की रासायनिक व्यवहार उसी समूह के बाद के सदस्यों की तुलना में भिन्न क्यों होता है? इस असामान्य व्यवहार का कारण उनके छोटे आकार, बड़ा आवेश/त्रिज्या अनुपात और उच्च विद्युतऋणाता को माना जाता है। इसके अतिरिक्त, समूह का प्रथम सदस्य आबंधन के लिए केवल चार संयोजी कक्षिकाएँ ($2s$ और $2p$) रखता है, जबकि समूह के दूसरे सदस्य के पास नौ संयोजी कक्षिकाएँ $(3s, 3p, 3d)$ होती हैं। इसके परिणामस्वरूप प्रत्येक समूह के प्रथम सदस्य की अधिकतम सहसंयोजकता 4 होती है (उदाहरणस्वरूप, बोरन केवल $\left[BF_4\right]^{-}$ ही बना सकता है), जबकि समूह के अन्य सदस्य अपनी संयोजी कोश को फैलाकर चार से अधिक इलेक्ट्रॉन युग्मों को समायोजित कर सकते हैं (उदाहरणस्वरूप, ऐलुमिनियम $\left[AlF_6\right]^{3-}$ बनाता है)। इसके अतिरिक्त, $p$-ब्लॉक के प्रथम सदस्य स्वयं से $p_{\pi}-p_{\pi}$ गुणबंध बनाने की अधिक क्षमता दिखाता है (जैसे $\mathrm{C}=\mathrm{C}, \mathrm{C} \equiv \mathrm{C}$, $\mathrm{N}=\mathrm{N}, \mathrm{N} \equiv \mathrm{N}$) और अन्य द्वितीय आवर्त तत्वों से भी (जैसे $\mathrm{C}=\mathrm{O}, \mathrm{C}=\mathrm{N}, \mathrm{C} \equiv \mathrm{N}$, $\mathrm{N}=\mathrm{O}$), जो उसी समूह के बाद के सदस्यों की तुलना में अधिक होती है।
प्रश्न 3.9
क्या $\left[\mathrm{AlCl}\left(\mathrm{H}_2 \mathrm{O}\right)_5\right]^{2+}$ में $\mathrm{Al}$ की ऑक्सीकरण अवस्था और सहसंयोजकता समान हैं?
हल
नहीं। ऑक्सीकरण अवस्था of $\mathrm{Al}$ +3 है और सहसंयोजकता 6 है।
3.7.3 आवर्तीय प्रवृत्तियाँ और रासायनिक क्रियाशीलता
हमने कुछ मूलभूत गुणों—जैसे परमाणु और आयनिक त्रिज्या, आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी और संयोजकता—में आवर्तीय प्रवृत्तियाँ देखी हैं। अब तक हम जान चुके हैं कि आवर्तिता इलेक्ट्रॉनिक विन्यास से सम्बद्ध है। अर्थात्, सभी रासायनिक और भौतिक गुण तत्वों के इलेक्ट्रॉनिक विन्यास का प्रकटीकरण हैं। अब हम इन मूलभूत गुणों और तत्वों की रासायनिक क्रियाशीलता के बीच सम्बन्धों को समझने का प्रयास करेंगे।
परमाणु और आयनिक त्रिज्याएँ, जैसा कि हम जानते हैं, आमतौर पर एक आवर्त में बाएँ से दाएँ घटती हैं। इसके परिणामस्वरूप आयनन एन्थैल्पी सामान्यतः बढ़ती है (कुछ अपवादों के साथ जैसा कि अनुभाग 3.7.1(a) में रेखांकित किया गया है) और इलेक्ट्रॉन लब्धि एन्थैल्पी आवर्त में अधिक ऋणात्मक हो जाती है। दूसरे शब्दों में, एक आवर्त में अत्यंत बाएँ स्थित तत्व की आयनन एन्थैल्पी न्यूनतम होती है और अत्यंत दाएँ स्थित तत्व की इलेक्ट्रॉन लब्धि एन्थैल्पी उच्चतम ऋणात्मक होती है (नोट: पूर्णतः भरे हुए कोश वाले निष्क्रिय गैसों की इलेक्ट्रॉन लब्धि एन्थैल्पी मान अपेक्षाकृत धनात्मक होते हैं)। इससे दोनों छोरों पर उच्च रासायनिक सक्रियता और केंद्र में न्यूनतम सक्रियता प्राप्त होती है। इस प्रकार, अत्यंत बाएँ (क्षार धातुओं के बीच) अधिकतम रासायनिक सक्रियता एक इलेक्ट्रॉन के क्षरण द्वारा धनायन बनने में प्रकट होती है और अत्यंत दाएँ (हैलोजनों के बीच) एक इलेक्ट्रॉन के लब्धि द्वारा ऋणायन बनने में दिखाई देती है। यह गुण तत्वों के अपचायक और ऑक्सीकारक व्यवहार से संबंधित है जो आप बाद में सीखेंगे। फिर भी, यहाँ इसे सीधे तत्वों की धात्विक और अधात्विक प्रकृति से जोड़ा जा सकता है। इस प्रकार, एक तत्व की धात्विक प्रकृति, जो अत्यंत बाएँ अधिकतम होती है, बाएँ से दाएँ आवर्त में घटती जाती है और अधात्विक प्रकृति बढ़ती है। किसी तत्व की रासायनिक सक्रियता को ऑक्सीजन और हैलोजनों के साथ उसकी अभिक्रियाओं से सर्वोत्तम रूप से दिखाया जा सकता है। यहाँ हम केवल तत्वों की ऑक्सीजन के साथ अभिक्रिया पर विचार करेंगे। आवर्त के दोनों छोरों पर स्थित तत्व ऑक्सीजन के साथ आसानी से मिलकर ऑक्साइड बनाते हैं। अत्यंत बाएँ स्थित तत्व द्वारा बना सामान्य ऑक्साइड सर्वाधिक क्षारीय होता है (उदा., $\mathrm{Na}_2 \mathrm{O}$), जबकि अत्यंत दाएँ स्थित तत्व द्वारा बना ऑक्साइड सर्वाधिक अम्लीय होता है (उदा., $\mathrm{Cl}_2 \mathrm{O}_7$)। आवर्त के मध्य के तत्वों के ऑक्साइड उभयधर्मी होते हैं (उदा., $\mathrm{Al}_2 \mathrm{O}_3, \mathrm{As}_2 \mathrm{O}_3$) या उदासीन होते हैं (उदा., $\mathrm{CO}, \mathrm{NO}, \mathrm{N}_2 \mathrm{O}$)। उभयधर्मी ऑक्साइड क्षारों के साथ अम्लीय और अम्लों के साथ क्षारीय व्यवहार करते हैं, जबकि उदासीन ऑक्साइड में न तो अम्लीय और न ही क्षारीय गुण होते हैं।
प्रश्न 3.10
रासायनिक अभिक्रिया द्वारा दिखाइए कि $\mathrm{Na}_2 \mathrm{O}$ एक क्षारीय ऑक्साइड है और $\mathrm{Cl}_2 \mathrm{O}_7$ एक अम्लीय ऑक्साइड है।
हल
$\mathrm{Na}_2 \mathrm{O}$ जल के साथ मिलकर एक प्रबल क्षार बनाता है जबकि $\mathrm{Cl}_2 \mathrm{O}_7$ प्रबल अम्ल बनाता है।
$\mathrm{Na}_2 \mathrm{O}+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{NaOH}$
$\mathrm{Cl}_2 \mathrm{O}_7+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{HClO}_4$
इनके क्षारीय या अम्लीय स्वभाव की गुणात्मक जाँच लिटमस कागज से की जा सकती है।
संक्रमण धातुओं (3d श्रेणी) में, परमाणु त्रिज्या में परिवर्तन प्रतिनिधि तत्वों की तुलना में कहीं कम होता है जब वे आवर्त में चलते हैं। आंतरिक-संक्रमण धातुओं (4f श्रेणी) के बीच परमाणु त्रिज्या में परिवर्तन और भी कम होता है। आयनन एन्थैल्पी s- और p-ब्लॉकों के मध्यवर्ती होती हैं। परिणामस्वरूप, वे समूह 1 और 2 की धातुओं की तुलना में कम विद्युतधनात्मक होती हैं।
एक समूह में, परमाणु संख्या में वृद्धि के साथ परमाणु और आयनिक त्रिज्याओं में वृद्धि के परिणामस्वरूप मुख्य समूह तत्वों के मामले में आयनन एन्थैल्पी में क्रमिक कमी और इलेक्ट्रॉन लब्धि एन्थैल्पी में नियमित कमी होती है (कुछ तीसरी आवृत्ति के तत्वों में अपवाद के साथ जैसा कि अनुभाग 3.7.1(d) में दिखाया गया है)। इस प्रकार, समूह में नीचे जाने पर धात्विक लक्षण बढ़ता है और अधात्विक लक्षण घटता है। यह प्रवृत्ति उनके अपचायक और ऑक्सीकारक गुणों से संबंधित है जो आप बाद में सीखेंगे। संक्रमण तत्वों के मामले में, हालांकि, एक विपरीत प्रवृत्ति देखी जाती है। इसे परमाणु आकार और आयनन एन्थैल्पी के संदर्भ में समझाया जा सकता है।
सारांश
इस इकाई में, आपने आवर्त नियम और आवर्त सारणी के विकास का अध्ययन किया है। मेंडलीव की आवर्त सारणी परमाणु द्रव्यमानों पर आधारित थी। आधुनिक आवर्त सारणी तत्वों को उनकी परमाणु संख्याओं के क्रम में सात क्षैतिज पंक्तियों (आवर्तों) और अठारह ऊर्ध्वाधर स्तंभों (समूहों या वर्गों) में व्यवस्थित करती है। एक आवर्त में परमाणु संख्याएं क्रमागत होती हैं, जबकि एक समूह में वे एक पैटर्न में बढ़ती हैं। समान समूह के तत्वों की संयोजक कक्षा की इलेक्ट्रॉनिक विन्यास समान होती है और, इसलिए, वे समान रासायनिक गुण प्रदर्शित करते हैं। हालांकि, समान आवर्त के तत्वों में बाएं से दाएं इलेक्ट्रॉनों की संख्या क्रमिक रूप से बढ़ती है, और, इसलिए, उनकी संयोजकताएं भिन्न होती हैं। इलेक्ट्रॉनिक विन्यासों के आधार पर आवर्त सारणी में चार प्रकार के तत्वों को पहचाना जा सकता है। ये हैं s-ब्लॉक, $\boldsymbol{p}$-ब्लॉक, $\boldsymbol{d}$-ब्लॉक और $\boldsymbol{f}$-ब्लॉक तत्व। हाइड्रोजन, जिसके $1 \boldsymbol{s}$ कक्षक में एक इलेक्ट्रॉन होता है, आवर्त सारणी में एक अद्वितीय स्थान रखता है। धातुएं ज्ञात तत्वों के इकहत्तर प्रतिशत से अधिक हैं। अधातु, जो आवर्त सारणी के शीर्ष पर स्थित हैं, संख्या में बीस से कम हैं। तत्व जो धातुओं और अधातुओं के बीच सीमा रेखा पर स्थित होते हैं (जैसे Si, Ge, As) को उपधातु या अर्ध-धातु कहा जाता है। एक समूह में परमाणु संख्या बढ़ने के साथ धात्विक लक्षण बढ़ते हैं जबकि एक आवर्त में बाएं से दाएं घटते हैं। तत्वों के भौतिक और रासायनिक गुण उनकी परमाणु संख्याओं के साथ आवर्ती रूप से परिवर्तित होते हैं।
आवर्ती प्रवृत्तियाँ परमाणु आकार, आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी, विद्युतऋणात्मकता और संयोजकता में देखी जाती हैं। एक आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या घटती है और एक समूह में परमाणु क्रमांक के साथ बढ़ती है। आयनन एन्थैल्पी सामान्यतः एक आवर्त में बढ़ती है और एक समूह में नीचे जाने पर घटती है। विद्युतऋणात्मकता भी इसी प्रकार की प्रवृत्ति दिखाती है। इलेक्ट्रॉन लब्धि एन्थैल्पी सामान्यतः एक आवर्त में अधिक ऋणात्मक होती जाती है और एक समूह में नीचे जाने पर कम ऋणात्मक होती है। संयोजकता में कुछ आवर्तिता होती है, उदाहरण के लिए, प्रतिनिधित्व करने वाले तत्वों में संयोजकता या तो बाह्यतम कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के बराबर होती है या आठ में से इस संख्या को घटाने पर प्राप्त संख्या के बराबर होती है। रासायनिक क्रियाशीलता एक आवर्त के दो चरमों पर अधिकतम होती है और मध्य में न्यूनतम होती है। एक आवर्त के बाएँ चरम पर क्रियाशीलता इसलिए होती है क्योंकि इलेक्ट्रॉन खोने में आसानी होती है (या आयनन एन्थैल्पी कम होती है)। अत्यधिक क्रियाशील तत्व प्रकृति में स्वतंत्र अवस्था में नहीं पाए जाते; ये सामान्यतः संयुक्त रूप में पाए जाते हैं। बाएँ ओर के तत्वों द्वारा बने ऑक्साइड क्षारीय प्रकृति के होते हैं और दाएँ ओर के तत्वों द्वारा बने ऑक्साइड अम्लीय प्रकृति के होते हैं। मध्य के तत्वों के ऑक्साइड उभयधर्मी या उदासीन प्रकृति के होते हैं।



