अध्याय 08 रेडॉक्स अभिक्रियाएँ
Subject Hub
सामान्य Learning Resources
जहाँ ऑक्सीकरण होता है, वहाँ सदैव अपचयन होता है; रसायन विज्ञान मूलतः रेडॉक्स तंत्रों का अध्ययन है।
रसायन विज्ञ्ञान पदार्थों की विविधताओं और एक प्रकार के पदार्थ के दूसरे प्रकार में परिवर्तन से संबंधित है। पदार्थ का एक रूप से दूसरे रूप में रूपांतर विभिन्न प्रकार की अभिक्रियाओं द्वारा होता है। ऐसी अभिक्रियाओं का एक महत्वपूर्ण वर्ग रेडॉक्स अभिक्रियाएँ है। भौतिक और जैविक दोनों प्रकार की अनेक घटनाएँ रेडॉक्स अभिक्रियाओं से संबंधित हैं। ये अभिक्रियाएँ औषधीय, जैविक, औद्योगिक, धातुकर्म और कृषि क्षेत्रों में व्यापक रूप से प्रयुक्त होती हैं। इन अभिक्रियाओं का महत्त्व इस तथ्य से स्पष्ट होता है कि घरेलू, परिवहन और अन्य व्यावसायिक उद्देश्यों के लिए ऊर्जा प्राप्त करने हेतु विभिन्न प्रकार के ईंधनों का दहन, अत्यंत क्रियाशील धातुओं और अधातुओं के निष्कर्षण के लिए विद्युत-रासायनिक प्रक्रम, सोडा-कॉस्टिक जैसे रासायनिक यौगिकों का निर्माण, शुष्क और आर्द्र बैटरियों का संचालन तथा धातुओं का संक्षरण—all रेडॉक्स प्रक्रमों के अंतर्गत आते हैं। हाल के वर्षों में, हाइड्रोजन अर्थव्यवस्था (ईंधन के रूप में द्रव हाइड्रोजन के प्रयोग) और ‘ओज़ोन छिद्र’ का विकास जैसी पर्यावरणीय समस्याएँ भी रेडॉक्स घटना के अंतर्गत आने लगी हैं।
8.1 रेडॉक्स अभिक्रियाओं की शास्त्रीय अवधारणा — ऑक्सीकरण और अपचयन अभिक्रियाएँ
प्रारंभ में, ऑक्सीकरण शब्द का प्रयोग किसी तत्व या यौगिक में ऑक्सीजन के योग को वर्णित करने के लिए किया जाता था। वायुमंडल में डाइऑक्सीजन की उपस्थिति (20%) के कारण अनेक तत्व इसके साथ संयोजित होते हैं और यही प्रमुख कारण है कि वे पृथ्वी पर प्रायः अपने ऑक्साइडों के रूप में पाए जाते हैं। निम्नलिखित अभिक्रियाएं ऑक्सीकरण की सीमित परिभाषा के अनुसार ऑक्सीकरण प्रक्रमों को दर्शाती हैं:
$$2 \mathrm{Mg}(\mathrm{s})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{MgO}(\mathrm{s}) \tag{8.1}$$
$$\mathrm{S}(\mathrm{s})+\mathrm{O_2}(\mathrm{~g}) \rightarrow \mathrm{SO_2}(\mathrm{~g}) \tag{8.2}$$
अभिक्रियाओं (8.1) और (8.2) में, तत्व मैग्नीशियम और सल्फर इसलिए ऑक्सीकृत होते हैं क्योंकि उनमें ऑक्सीजन का योग होता है। इसी प्रकार, मीथेन भी ऑक्सीकृत होता है क्योंकि उसमें ऑक्सीजन का योग होता है।
$$\mathrm{CH} _{4}(\mathrm{~g})+2 \mathrm{O} _{2}(\mathrm{~g}) \rightarrow \mathrm{CO} _{2}(\mathrm{~g})+2 \mathrm{H} _{2} \mathrm{O}(\mathrm{l}) \tag{7.3}$$
अभिक्रिया (8.3) का सावधानीपूर्वक परीक्षण, जिसमें हाइड्रोजन को ऑक्सीजन द्वारा प्रतिस्थापित किया गया है, ने रसायनज्ञों को ऑक्सीकरण की पुनः व्याख्या करने के लिए प्रेरित किया कि यह किसी पदार्थ से हाइड्रोजन के विलोपन के रूप में होता है, और इस प्रकार ऑक्सीकरण शब्द की सीमा को किसी पदार्थ से हाइड्रोजन के विलोपन को सम्मिलित करने के लिए विस्तृत कर दिया गया। निम्नलिखित चित्रण एक अन्य अभिक्रिया है जहाँ हाइड्रोजन के विलोपन को भी एक ऑक्सीकरण अभिक्रिया के रूप में उद्धृत किया जा सकता है।
$$ \begin{equation*} 2 \mathrm{H_2} \mathrm{~S}(\mathrm{~g})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{~S}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \tag{8.4} \end{equation*} $$
जैसे-जैसे रसायनज्ञों का ज्ञान बढ़ा, यह स्वाभाविक था कि ऑक्सीकरण शब्द का विस्तार (7.1 से 7.4) जैसी अभिक्रियाओं पर किया जाए, जिनमें ऑक्सीजन नहीं बल्कि अन्य ऋणात्मक तत्व शामिल होते हैं। मैग्नीशियम का फ्लोरीन, क्लोरीन और सल्फर आदि के साथ ऑक्सीकरण निम्नलिखित अभिक्रियाओं के अनुसार होता है :
$$\operatorname{Mg}(\mathrm{s})+\mathrm{F_2} (\mathrm{~g}) \rightarrow \operatorname{MgF_2} (s) \tag{8.5}$$
$$\mathrm{Mg}(\mathrm{s})+\mathrm{Cl_2} (g) \rightarrow \mathrm{MgCl_2} (s) \tag{8.6}$$
$$\mathrm{Mg}(\mathrm{s})+\mathrm{S} (s) \rightarrow \operatorname{MgS}(\mathrm{s}) \tag{8.7}$$
अभिक्रियाओं 7.5 से 7.7 को ऑक्सीकरण अभिक्रियाओं के दायरे में शामिल करने से रसायनज्ञों को न केवल हाइड्रोजन के हटने को ऑक्सीकरण मानने की प्रेरणा मिली, बल्कि धनात्मक तत्वों के हटने को भी ऑक्सीकरण माना जाने लगा। इस प्रकार अभिक्रिया :
$$ 2 \mathrm{~K_4} \left[ \mathrm{Fe} ( \mathrm{CN})_{6} \right] ( \mathrm{aq}) + \mathrm{H_2} \mathrm{O_2} ( \mathrm{aq}) \rightarrow 2 \mathrm{~K_3} \left[\mathrm{Fe}( \mathrm{CN})_6 \right] ( \mathrm{aq}) + 2 \mathrm{KOH} ( \mathrm{aq}) $$
इसे ऑक्सीकरण के रूप में व्याख्या की जाती है क्योंकि पोटैशियम फेरोसायनाइड से विधायात्मक तत्व पोटैशियम को हटाया जाता है इससे पहले कि वह पोटैशियम फेरिसायनाइड में बदले। संक्षेप में, “ऑक्सीकरण” शब्द की परिभाषा किसी पदार्थ में ऑक्सीजन/विद्युत-ऋणात्मक तत्व की वृद्धि या किसी पदार्थ से हाइड्रोजन/विद्युत-धनात्मक तत्व की हटाना है।
प्रारंभ में, अपचयन को यौगिक से ऑक्सीजन की हटाना माना जाता था। हालांकि, आजकल अपचयन शब्द का दायरा बढ़ा दिया गया है और इसमें किसी पदार्थ से ऑक्सीजन/विद्युत-ऋणात्मक तत्व की हटाना या किसी पदार्थ में हाइड्रोजन/विद्युत-धनात्मक तत्व की वृद्धि शामिल है।
ऊपर दी गई परिभाषा के अनुसार, निम्नलिखित अपचयन प्रक्रमों के उदाहरण हैं:
$$2 \mathrm{HgO}(\mathrm{s}) \xrightarrow{\Delta} 2 \mathrm{Hg}(\mathrm{l})+\mathrm{O_2}(\mathrm{~g}) \tag{8.8}$$
(मरक्यूरिक ऑक्साइड से ऑक्सीजन की हटाना)
$$2 \mathrm{FeCl_3}(\mathrm{aq})+\mathrm{H_2}(\mathrm{~g}) \rightarrow 2 \mathrm{FeCl_2}(\mathrm{aq})+2 \mathrm{HCl}(\mathrm{aq}) \tag{8.9}$$
(फेरिक क्लोराइड से विद्युत-ऋणात्मक तत्व क्लोरीन की हटाना)
$$\mathrm{CH_2}=\mathrm{CH_2}(\mathrm{~g})+\mathrm{H_2}(\mathrm{~g}) \rightarrow \mathrm{H_3} \mathrm{C}-\mathrm{CH_3}(\mathrm{~g})\tag{8.10}$$
(हाइड्रोजन की वृद्धि)
$$2 \mathrm{HgCl_2}(\mathrm{aq})+\mathrm{SnCl_2}(\mathrm{aq}) \rightarrow \mathrm{Hg_2} \mathrm{Cl_2}(\mathrm{~s})+\mathrm{SnCl_4}(\mathrm{aq})\tag{8.11}$$
(मरक्यूरिक क्लोराइड में मरक्युरी की वृद्धि)
प्रतिक्रिया (8.11) में स्टैनस क्लोराइड के स्टैनिक क्लोराइड में एक साथ ऑक्सीकरण इसलिए भी हो रहा है क्योंकि उसमें विद्युतऋणात्मक तत्व क्लोरीन जोड़ा जा रहा है। शीघ्र ही यह समझ में आया कि ऑक्सीकरण और अपचयन सदैव एक साथ होते हैं (जैसा कि ऊपर दी गई सभी समीकरणों को पुनः देखने पर स्पष्ट होगा), इसलिए इस वर्ग की रासायनिक प्रतिक्रियाओं के लिए “रेडॉक्स” शब्द गढ़ा गया।
प्रश्न 8.1
नीचे दी गई प्रतिक्रियाओं में, ऑक्सीकरण और अपचयन से गुजरने वाले स्पीशीज की पहचान कीजिए:
(i) $\mathrm{H_2} \mathrm{~S}$ (g) $+\mathrm{Cl_2}$ (g) $\rightarrow 2 \mathrm{HCl}$ (g) $+\mathrm{S}$ (s)
(ii) $3 \mathrm{Fe_3} \mathrm{O_4}$ (s) $+8 \mathrm{Al}$ (s) $\rightarrow 9 \mathrm{Fe}$ (s) $+4 \mathrm{Al_2} \mathrm{O_3}(\mathrm{~s})$
(iii) $2 \mathrm{Na}$ (s) $+\mathrm{H_2}$ (g) $\rightarrow 2 \mathrm{NaH}$ (s)
हल
(i) $\mathrm{H_2} \mathrm{~S}$ ऑक्सीकृत होता है क्योंकि अधिक विद्युतऋणात्मक तत्व क्लोरीन हाइड्रोजन से जोड़ा जा रहा है (या अधिक विद्युतधनात्मक तत्व हाइड्रोजन S से हटाया जा रहा है)। क्लोरीन अपचयित होता है क्योंकि उसमें हाइड्रोजन जुड़ रहा है।
(ii) ऐलुमिनियम ऑक्सीकृत होता है क्योंकि उसमें ऑक्सीजन जुड़ रही है। फेरस फेरिक ऑक्साइड $\left(\mathrm{Fe_3} \mathrm{O_4}\right)$ अपचयित होता है क्योंकि उससे ऑक्सीजन हटायी जा रही है।
(iii) केवल विद्युतऋणात्मकता की संकल्पना का सावधानीपूर्वक प्रयोग कर हम यह निष्कर्ष निकाल सकते हैं कि सोडियम ऑक्सीकृत होता है और हाइड्रोजन अपचयित होता है।
यहाँ चुनी गई प्रतिक्रिया (iii) हमें रेडॉक्स प्रतिक्रियाओं को परिभाषित करने के एक अन्य तरीके के बारे में सोचने को प्रेरित करती है।
8.2 इलेक्ट्रॉन स्थानांतरण अभिक्रियाओं के संदर्भ में रेडॉक्स अभिक्रियाएँ
हमने पहले ही सीखा है कि ये अभिक्रियाएँ रेडॉक्स अभिक्रियाएँ हैं क्योंकि इनमें से प्रत्येक अभिक्रिया में सोडियम का ऑक्सीकरण होता है, जो कि सोडियम में या तो ऑक्सीजन या अधिक विद्युतऋणात्मक तत्व के जुड़ने के कारण होता है।
$$2 \mathrm{Na}(\mathrm{s})+\mathrm{Cl_2}(\mathrm{~g}) \rightarrow 2 \mathrm{NaCl}(\mathrm{s})\tag{8.12}$$
$$4 \mathrm{Na}(\mathrm{s})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{Na_2} \mathrm{O}(\mathrm{s})\tag{8.13}$$
$$2 \mathrm{Na}(\mathrm{s})+\mathrm{S}(\mathrm{s}) \rightarrow \mathrm{Na_2} \mathrm{~S}(\mathrm{~s}) \tag{8.14}$$
इसके साथ-साथ, क्लोरीन, ऑक्सीजन और सल्फर का अपचयन होता है क्योंकि इनमें से प्रत्येक में विद्युतधनात्मक तत्व सोडियम जुड़ा है। रासायनिक आबंधन के हमारे ज्ञान से हम यह भी जानते हैं कि सोडियम क्लोराइड, सोडियम ऑक्साइड और सोडियम सल्फाइड आयनिक यौगिक हैं और शायद इन्हें बेहतर रूप से $\mathrm{Na}^{+} \mathrm{Cl}^{-}( \mathrm{s}),\left(\mathrm{Na}^{+} \right)_2 \mathrm{O}^{2-}( \mathrm{s})$, और $ \left(\mathrm{Na}^{+} \right)_2$ $\mathrm{S}^{2-}( \mathrm{s})$ के रूप में लिखा जा सकता है। उत्पन्न प्रजातियों पर आवेशों के विकास का सुझाव देता है कि हम अभिक्रियाओं (8.12 से 8.14) को निम्नलिखित तरीके से पुनः लिखें:
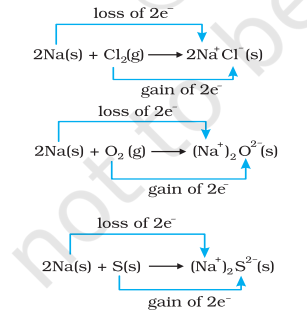
सुविधा के लिए, उपरोक्त प्रत्येक प्रक्रिया को दो अलग-अलग चरणों के रूप में माना जा सकता है, एक में इलेक्ट्रॉनों की हानि होती है और दूसरे में इलेक्ट्रॉनों की प्राप्ति। उदाहरण के तौर पर, हम इनमें से किसी एक को और विस्तार से समझ सकते हैं, मान लीजिए, सोडियम क्लोराइड के निर्माण को।
$2 \mathrm{Na}(\mathrm{s}) \rightarrow 2 \mathrm{Na}^{+}(\mathrm{g})+2 \mathrm{e}^{-}$
$\mathrm{Cl_2}(\mathrm{~g})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cl}^{-}(\mathrm{g})$
उपरोक्त प्रत्येक चरण को एक अर्ध-अभिक्रिया कहा जाता है, जो स्पष्ट रूप से इलेक्ट्रॉनों की भागीदारी को दर्शाती है। अर्ध-अभिक्रियाओं के योग से समग्र अभिक्रिया प्राप्त होती है:
$2 \mathrm{Na}(\mathrm{s})+\mathrm{Cl_2}(\mathrm{~g}) \rightarrow 2 \mathrm{Na}^{+} \mathrm{Cl}^{-}(\mathrm{s})$ या $2 \mathrm{NaCl}(\mathrm{s})$
प्रतिक्रियाएँ 8.12 से 8.14 सुझाती हैं कि अर्ध-प्रतिक्रियाएँ जिनमें इलेक्ट्रॉनों की हानि होती है, ऑक्सीकरण प्रतिक्रियाएँ कहलाती हैं। इसी प्रकार, अर्ध-प्रतिक्रियाएँ जिनमें इलेक्ट्रॉनों की प्राप्ति होती है, अपचयन प्रतिक्रियाएँ कहलाती हैं। यहाँ यह उल्लेख करना प्रासंगिक होगा कि ऑक्सीकरण और अपचयन को परिभाषित करने की यह नई विधि केवल इस बात से संबंध स्थापित करने के बाद संभव हुई है कि प्रजातियों का व्यवहार शास्त्रीय अवधारणा के अनुसार कैसा है और वे इलेक्ट्रॉन-हस्तांतरण परिवर्तन में कैसे परस्पर क्रिया करती हैं। प्रतिक्रियाओं (8.12 से 8.14) में, सोडियम जो ऑक्सीकृत होता है, एक अपचायक एजेंट के रूप में कार्य करता है क्योंकि यह अपने साथ क्रिया करने वाले प्रत्येक तत्व को इलेक्ट्रॉन दान करता है और इस प्रकार उन्हें अपचयित करने में सहायता करता है। क्लोरीन, ऑक्सीजन और सल्फर अपचयित होते हैं और ऑक्सीकारक एजेंट के रूप में कार्य करते हैं क्योंकि ये सोडियम से इलेक्ट्रॉन ग्रहण करते हैं। संक्षेप में, हम यह उल्लेख कर सकते हैं कि
ऑक्सीकरण : किसी भी प्रजाति द्वारा इलेक्ट्रॉनों की हानि।
अपचयन : किसी भी प्रजाति द्वारा इलेक्ट्रॉनों की प्राप्ति।
ऑक्सीकारक एजेंट : इलेक्ट्रॉनों का ग्राही।
अपचायक एजेंट : इलेक्ट्रॉनों का दाता।
प्रश्न 8.2
सिद्ध कीजिए कि प्रतिक्रिया: $2 \mathrm{Na}(\mathrm{s})+\mathrm{H_2}(\mathrm{~g}) \rightarrow 2 \mathrm{NaH}$ (s) एक रेडॉक्स परिवर्तन है।
हल
चूँकि उपरोक्त प्रतिक्रिया में बना यौगिक एक आयनिक यौगिक है, जिसे $\mathrm{Na}^{+} \mathrm{H}^{-}$(s) के रूप में भी दर्शाया जा सकता है, इससे सुझाव मिलता है कि इस प्रक्रिया में एक अर्ध-प्रतिक्रिया है :
$2 \mathrm{Na}(\mathrm{s}) \quad \rightarrow 2 \mathrm{Na}^{+}(\mathrm{g})+2 \mathrm{e}^{-}$
और दूसरी अर्ध-प्रतिक्रिया है:
$\mathrm{H_2}(\mathrm{~g})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{H}^{-}(\mathrm{g})$
परीक्षण के अंतर्गत इस अभिक्रिया को दो अर्ध-अभिक्रियाओं में विभाजित करने से स्वतः ही स्पष्ट हो जाता है कि यहाँ सोडियम ऑक्सीकृत तथा हाइड्रोजन अपचयित होता है, इसलिए संपूर्ण अभिक्रिया एक रेडॉक्स परिवर्तन है।
8.2.1 प्रतिस्पर्धी इलेक्ट्रॉन स्थानांतरण अभिक्रियाएँ
चित्र 8.1 में दिखाए अनुसार लगभग एक घंटे तक कॉपर नाइट्रेट के जलीय विलयन में जिंक धातु की एक पट्टी रखें। आप देख सकते हैं कि पट्टी लाल-भूरे रंग की धातु कॉपर से आच्छादित हो जाती है और विलयन की नीली रंगत गायब हो जाती है। विलयन की नीली रंगत जो $\mathrm{Cu}^{2+}$ के कारण है, गायब हो जाने पर उत्पादों में $\mathrm{Zn}^{2+}$ आयनों की उपस्थिति आसानी से अनुमान लगाई जा सकती है। यदि रंगहीन विलयन जिसमें $\mathrm{Zn}^{2+}$ आयन हैं, से हाइड्रोजन सल्फाइड गैस प्रवाहित की जाए, तो विलयन को अमोनिया से क्षारीय बनाने पर सफेद जिंक सल्फाइड, $\mathrm{ZnS}$ का दिखना संभव है।
धातु जिंक तथा कॉपर नाइट्रेट के जलीय विलयन के बीच अभिक्रिया है :
$$\mathrm{Zn}(\mathrm{s})+\mathrm{Cu}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Zn}^{2+}(\mathrm{aq})+\mathrm{Cu}(\mathrm{s}) \tag{8.15}$$
अभिक्रिया (8.15) में, जिंक ने इलेक्ट्रॉन खोकर $\mathrm{Zn}^{2+}$ बनाया है, इसलिए जिंक ऑक्सीकृत होता है। स्पष्ट है कि यदि जिंक ऑक्सीकृत होकर इलेक्ट्रॉन मुक्त करता है, तो कुछ और अवश्य अपचयित होकर उन इलेक्ट्रॉनों को ग्रहण करेगा। कॉपर आयन जिंक से इलेक्ट्रॉन ग्रहण कर अपचयित होता है।
अभिक्रिया (8.15) को इस प्रकार पुनः लिखा जा सकता है :
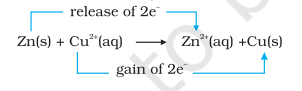
इस चरण पर हम समीकरण (8.15) द्वारा दर्शाए गए अभिक्रिया की साम्यावस्था की जांच कर सकते हैं। इस उद्देश्य के लिए, आइए जिंक सल्फेट विलयन में तांबे की धातु की एक पट्टी रखें। कोई दृश्य अभिक्रिया देखने को नहीं मिलती और विलयन में $\mathrm{Cu}^{2+}$ आयनों की उपस्थिति का पता लगाने के लिए $\mathrm{H_2} \mathrm{~S}$ गैस प्रवाहित करने का प्रयास, जिससे कपरिक सल्फाइड, CuS का काला रंग बनता है, सफल नहीं होता है। कपरिक सल्फाइड की विलेयता इतनी कम है कि यह एक अत्यंत संवेदनशील परीक्षण है; फिर भी $\mathrm{Cu}^{2+}$ की मात्रा का पता नहीं लगाया जा सकता। हम इस प्रकार निष्कर्ष निकालते हैं कि अभिक्रिया (8.15) की साम्यावस्था अभिकारकों की तुलना में उत्पादों को अत्यधिक पक्ष देती है।
आइए अब इलेक्ट्रॉन स्थानांतरण अभिक्रिया को तांबे की धातु और जल में सिल्वर नाइट्रेट विलयन तक बढ़ाएं और चित्र 8.2 में दिखाए गए अनुसार एक व्यवस्था तैयार करें। विलयन नीला रंग विकसित करता है क्योंकि निम्न अभिक्रिया के कारण $\mathrm{Cu}^{2+}$ आयन बनते हैं:
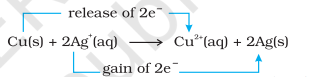
यहाँ, $\mathrm{Cu}(\mathrm{s})$ को $\mathrm{Cu}^{2+}(\mathrm{aq})$ में ऑक्सीकृत किया जाता है और $\mathrm{Ag}^{+}(\mathrm{aq})$ को $\mathrm{Ag}(\mathrm{s})$ में अपचयित किया जाता है। साम्यावस्था उत्पादों $\mathrm{Cu}^{2+}(\mathrm{aq})$ और $\mathrm{Ag}(\mathrm{s})$ को काफी अधिक पक्ष देती है।
विरोधस्वरूप, आइए निकल सल्फेट विलयन में रखे धातु कोबाल्ट की अभिक्रिया की भी तुलना करें। यहाँ जो अभिक्रिया होती है वह है :
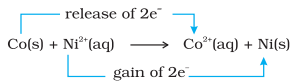
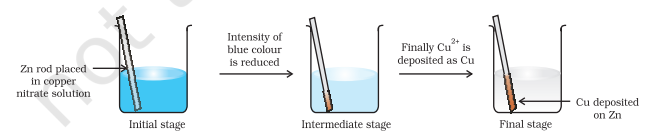
चित्र 8.1 बीकर में जिंक और कॉपर नाइट्रेट के जलीय विलयन के बीच होने वाली रेडॉक्स अभिक्रिया।
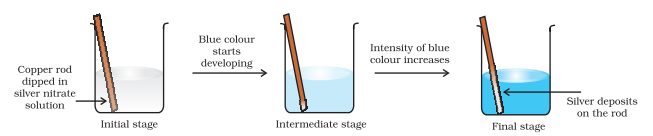
चित्र 8.2 बीकर में कॉपर और सिल्वर नाइट्रेट के जलीय विलयन के बीच होने वाली रेडॉक्स अभिक्रिया।
साम्यावस्था पर, रासायनिक परीक्षणों से पता चलता है कि दोनों $\mathrm{Ni}^{2+}(\mathrm{aq})$ और $\mathrm{Co}^{2+}(\mathrm{aq})$ मध्यम सांद्रता में मौजूद हैं। इस स्थिति में, न तो अभिकारक $\left[\mathrm{Co}(\mathrm{s})\right.$ और $\left.\mathrm{Ni}^{2+}(\mathrm{aq})\right]$ और न ही उत्पाद $\left[\mathrm{Co}^{2+}(\mathrm{aq})\right.$ और $\left.\mathrm{Ni}(\mathrm{s})\right]$ को अत्यधिक प्राथमिकता प्राप्त है।
इलेक्ट्रॉनों के मुक्त होने के लिए यह प्रतिस्पर्धा संयोगवश हमें अम्लों के बीच प्रोटॉनों के मुक्त होने की प्रतिस्पर्धा की याद दिलाती है। इस समानता से संकेत मिलता है कि हम एक ऐसी सारणी विकसित कर सकते हैं जिसमें धातुओं और उनके आयनों को इलेक्ट्रॉन छोड़ने की प्रवृत्ति के आधार पर सूचीबद्ध किया जाए, जैसे कि हम अम्लों की ताकत दर्शाने के लिए करते हैं। वास्तव में, हमने पहले ही कुछ तुलनाएँ की हैं। तुलना करके हमें पता चला है कि जिंक कॉपर को इलेक्ट्रॉन देता है और कॉपर सिल्वर को इलेक्ट्रॉन देता है, और इसलिए धातुओं की इलेक्ट्रॉन छोड़ने की प्रवृत्ति इस क्रम में है: $\mathrm{Zn}>\mathrm{Cu}>\mathrm{Ag}$। हम अपनी सूची को और अधिक विस्तृत बनाना चाहेंगे और एक धातु सक्रियता श्रेणी या विद्युत रासायनिक श्रेणी तैयार करेंगे। विभिन्न धातुओं के बीच इलेक्ट्रॉनों के लिए प्रतिस्पर्धा हमें एक प्रकार की कोशिकाओं की श्रेणी बनाने में मदद करती है, जिन्हें गैल्वेनिक कोशिकाएँ कहा जाता है, जिनमें रासायनिक अभिक्रियाएँ विद्युत ऊर्जा का स्रोत बन जाती हैं। हम इन कोशिकाओं के बारे में कक्षा बारहवीं में और अधिक अध्ययन करेंगे।
8.3 ऑक्सीकरण संख्या
इलेक्ट्रॉन स्थानांतरण का एक कम स्पष्ट उदाहरण तब साकार होता है जब हाइड्रोजन ऑक्सीजन के साथ मिलकर पानी बनाती है अभिक्रिया द्वारा:
$$2 \mathrm{H_2}(\mathrm{~g})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{H_2} \mathrm{O}(\mathrm{l})\tag{8.18}$$
यद्यपि यह अपने दृष्टिकोण में सरल नहीं है, फिर भी हम $\mathrm{H}$ परमाणु को $\mathrm{H_2}$ में एक उदासीन (शून्य) अवस्था से $\mathrm{H_2} \mathrm{O}$ में एक धनात्मक अवस्था में जाते हुए देख सकते हैं, $\mathrm{O}$ परमाणु $\mathrm{O_2}$ में एक शून्य अवस्था से $\mathrm{H_2} \mathrm{O}$ में एक द्वि-ऋणात्मक अवस्था में चला जाता है। यह माना जाता है कि $\mathrm{H}$ से $\mathrm{O}$ में इलेक्ट्रॉन स्थानांतरण होता है और परिणामस्वरूप $\mathrm{H_2}$ ऑक्सीकृत होता है और $\mathrm{O_2}$ अपचयित होता है।
हालांकि, जैसा कि हम बाद में देखेंगे, आवेश स्थानांतरण केवल आंशिक होता है और शायद इसे इलेक्ट्रॉन स्थानांतरण के बजाय इलेक्ट्रॉन विस्थापन के रूप में बेहतर वर्णित किया जा सकता है बजाय इसके कि $\mathrm{H}$ द्वारा इलेक्ट्रॉन का पूर्ण नुकसान और O द्वारा लाभ हो। जो कुछ यहाँ समीकरण (8.18) के संबंध में कहा गया है वह सहसंयोजी यौगिकों को सम्मिलित करने वाली अन्य कई अभिक्रियाओं के लिए सत्य हो सकता है। इस वर्ग की अभिक्रियाओं के ऐसे दो उदाहरण हैं:
$$\mathrm{H_2}(\mathrm{~s})+\mathrm{Cl_2}(\mathrm{~g}) \rightarrow 2 \mathrm{HCl}(\mathrm{g})\tag{8.19}$$
और,
$$\mathrm{CH_4}(\mathrm{~g})+4 \mathrm{Cl_2}(\mathrm{~g}) \rightarrow \mathrm{CCl_4}(\mathrm{l})+4 \mathrm{HCl}(\mathrm{g})\tag{8.20}$$
सहसंयोजी यौगिकों के निर्माण से जुड़ी रासायनिक अभिक्रियाओं में इलेक्ट्रॉन के बदलावों को ट्रैक करने के लिए, ऑक्सीकरण संख्या का उपयोग करने की एक अधिक व्यावहारिक विधि विकसित की गई है। इस विधि में यह माना जाता है कि इलेक्ट्रॉन का पूर्ण स्थानांतरण कम विद्युतऋणात्मक परमाणु से अधिक विद्युतऋणात्मक परमाणु की ओर होता है। उदाहरण के लिए, हम समीकरणों (8.18 से 8.20) को पुनः लिखते हैं ताकि अभिक्रिया में भाग लेने वाले प्रत्येक परमाणु पर आवेश दिखाया जा सके:
$$ \begin{array}{cccc} 2 \stackrel{0}{\mathrm{H_2}}(\mathrm{~g}) + \stackrel{0}{\mathrm{O_2}}(\mathrm{g}) & \rightarrow & 2 \stackrel{+1}{\mathrm{H_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{l}) \tag{8.21} \end{array} $$
$$ \begin{array}{llll} \stackrel {0}{\mathrm{H_2}}(\mathrm{~s}) + \stackrel{0}{\mathrm{Cl_2}}(\mathrm{~g}) & \rightarrow & 2 \stackrel{+1-1}{\mathrm{HCl}}(\mathrm{g}) \tag{8.22} \end{array} $$
$$ \begin{array}{cccc} \stackrel{-4 +1}{\mathrm{CH_4}}(\mathrm{~g}) + & 4 \stackrel{0}{\mathrm{Cl_2}}(\mathrm{~g}) \rightarrow & \stackrel{+4 -1}{\mathrm{C}\mathrm{Cl_4}} (\mathrm{l})+4 \stackrel{+1 -1 }{\mathrm{H } \mathrm{Cl}} (\mathrm{g})\tag{8.23} \end{array} $$
इस बात पर जोर दिया जा सकता है कि इलेक्ट्रॉन स्थानांतरण की यह मान्यता केवल लेखा-जोखा रखने के उद्देश्य से की जाती है और इस इकाई के बाद के चरण में यह स्पष्ट होगा कि यह रेडॉक्स अभिक्रियाओं के सरल वर्णन की ओर ले जाती है।
ऑक्सीकरण संख्या किसी यौगिक में एक तत्व की ऑक्सीकरण अवस्था को दर्शाती है जिसे निश्चित नियमों के अनुसार निर्धारित किया जाता है; ये नियम इस आधार पर बनाए गए हैं कि सहसंयोजी बंध में इलेक्ट्रॉन युग्म पूरी तरह से अधिक विद्युतऋणात्मक तत्व से संबद्ध माना जाता है।
किसी यौगिक/आयन में यह सदैव संभव नहीं होता कि याद रखा जाए या आसानी से पता लगाया जाए कि कौन-सा तत्व दूसरे से अधिक विद्युतऋणात्मक है। इसलिए, किसी यौगिक/आयन में तत्व की ऑक्सीकरण संख्या निर्धारित करने के लिए नियमों का एक समूह तैयार किया गया है। यदि किसी अणु/आयन में किसी तत्व के दो या दो से अधिक परमाणु उपस्थित हों, जैसे $\mathrm{Na_2} \mathrm{~S_2} \mathrm{O_3} / \mathrm{Cr_2} \mathrm{O_7}^{2-}$, तो उस तत्व के परमाणु की ऑक्सीकरण संख्या उस तत्व के सभी परमाणुओं की ऑक्सीकरण संख्या का औसत होगी। हम इस चरण पर ऑक्सीकरण संख्या की गणना के लिए नियमों को प्रस्तुत कर सकते हैं। ये नियम हैं:
1. मुक्त या असंयुक्त अवस्था में तत्वों में प्रत्येक परमाणु की ऑक्सीकरण संख्या शून्य होती है। स्पष्टतया $\mathrm{H_2}, \mathrm{O_2}, \mathrm{Cl_2}, \mathrm{O_3}, \mathrm{P_4}, \mathrm{~S_8}, \mathrm{Na}, \mathrm{Mg}, \mathrm{Al}$ में प्रत्येक परमाणु की ऑक्सीकरण संख्या शून्य है।
२. एकल परमाणु से बने आयनों के लिए, ऑक्सीकरण संख्या आयन पर आवेश के बराबर होती है। इस प्रकार (\mathrm{Na}^{+})आयन की ऑक्सीकरण संख्या (+1) है, (\mathrm{Mg}^{2+}) आयन की (+2), (\mathrm{Fe}^{3+}) आयन की (+3), (\mathrm{Cl}^{-})आयन की (-1), (\mathrm{O}^{2-}) आयन की (-2); और इसी तरह। अपने यौगिकों में सभी क्षार धातुओं की ऑक्सीकरण संख्या (+1) होती है, और सभी क्षारीय मृदा धातुओं की ऑक्सीकरण संख्या (+2) होती है। एल्युमिनियम को अपने सभी यौगिकों में (+3) की ऑक्सीकरण संख्या माना जाता है।
३. अधिकांश यौगिकों में ऑक्सीजन की ऑक्सीकरण संख्या (-2) होती है। हालांकि, हम यहाँ दो प्रकार के अपवादों का सामना करते हैं। एक अपवाद पेरॉक्साइड और सुपरॉक्साइड के मामले में आता है, जो ऑक्सीजन के ऐसे यौगिक हैं जिनमें ऑक्सीजन परमाणु सीधे एक-दूसरे से जुड़े होते हैं। जबकि पेरॉक्साइडों में (जैसे (\mathrm{H_2} \mathrm{O_2}), (\mathrm{Na_2} \mathrm{O_2})), प्रत्येक ऑक्सीजन परमाणु को (-1) की ऑक्सीकरण संख्या दी जाती है, सुपरॉक्साइडों में (जैसे (\mathrm{KO_2}, \mathrm{RbO_2})) प्रत्येक ऑक्सीजन परमाणु को (-(1/2)) की ऑक्सीकरण संख्या दी जाती है। दूसरा अपवाद विरले ही दिखाई देता है, अर्थात् जब ऑक्सीजन फ्लोरीन से बंधित होती है। ऐसे यौगिकों में, जैसे ऑक्सीजन डाइफ्लोराइड ((\mathrm{OF_2})) और डाइऑक्सीजन डाइफ्लोराइड ((\mathrm{O_2} \mathrm{~F_2})), ऑक्सीजन को क्रमशः (+2) और (+1) की ऑक्सीकरण संख्या दी जाती है। ऑक्सीजन को जो संख्या दी जाएगी वह इसकी बंधन अवस्था पर निर्भर करेगी, लेकिन यह संख्या अब केवल एक धनात्मक मान होगी।
4. हाइड्रोजन की ऑक्सीकरण संख्या +1 होती है, सिवाय तब जब वह धातुओं से द्विआधारी यौगिकों (यानी ऐसे यौगिक जिनमें दो तत्व होते हैं) में बंधित हो। उदाहरण के लिए, $\mathrm{LiH}$, $\mathrm{NaH}$, और $\mathrm{CaH_2}$ में इसकी ऑक्सीकरण संख्या -1 होती है।
5. अपने सभी यौगिकों में फ्लोरीन की ऑक्सीकरण संख्या -1 होती है। अन्य हैलोजन $(\mathrm{Cl}$, $\mathrm{Br}$, और I) की भी ऑक्सीकरण संख्या -1 होती है, जब वे अपने यौगिकों में हैलाइड आयनों के रूप में होते हैं। क्लोरीन, ब्रोमीन और आयोडीन जब ऑक्सीजन के साथ संयुक्त होते हैं, उदाहरण के लिए ऑक्सोएसिड्स और ऑक्सोऐनियनों में, तो इनकी ऑक्सीकरण संख्या धनात्मक होती है।
6. किसी यौगिक में सभी परमाणुओं की ऑक्सीकरण संख्या का बीजगणितीय योग शून्य होना चाहिए। बहुपरमाणुक आयन में, आयन के सभी परमाणुओं की ऑक्सीकरण संख्याओं का बीजगणितीय योग आयन पर आवेश के बराबर होना चाहिए। इस प्रकार, कार्बोनेट आयन $\left(\mathrm{CO_3}\right)^{2-}$ में तीन ऑक्सीजन परमाणुओं और एक कार्बन परमाणु की ऑक्सीकरण संख्या का योग -2 के बराबर होना चाहिए।
उपरोक्त नियमों के प्रयोग द्वारा हम किसी अणु या आयन में इच्छित तत्व की ऑक्सीकरण संख्या ज्ञात कर सकते हैं। यह स्पष्ट है कि धात्विक तत्वों की ऑक्सीकरण संख्या धनात्मक होती है और अधात्विक तत्वों की ऑक्सीकरण संख्या धनात्मक या ऋणात्मक हो सकती है। संक्रमण तत्वों के परमाणु सामान्यतः कई धनात्मक ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। किसी प्रतिनिधि तत्व की उच्चतम ऑक्सीकरण संख्या पहले दो समूहों के लिए समूह संख्या होती है और अन्य समूहों के लिए समूह संख्या माइनस 10 (दीर्घ रूप के आवर्त सारणी के अनुसार) होती है। इस प्रकार, इसका तात्पर्य है कि किसी तत्व के परमाणु द्वारा प्रदर्शित ऑक्सीकरण संख्या की उच्चतम मान आवर्त सारणी में आवर्त के अनुदिश सामान्यतः बढ़ती है। तीसरे आवर्त में ऑक्सीकरण संख्या का उच्चतम मान 1 से 7 तक परिवर्तित होता है जैसा कि नीचे तत्वों के यौगिकों में दर्शाया गया है।
एक पद जिसका प्रयोग प्रायः ऑक्सीकरण संख्या के साथ परस्पर रूप से किया जाता है, वह है ऑक्सीकरण अवस्था। इस प्रकार $\mathrm{CO_2}$ में कार्बन की ऑक्सीकरण अवस्था +4 है, जो उसकी ऑक्सीकरण संख्या भी है और इसी प्रकार ऑक्सीजन की ऑक्सीकरण अवस्था तथा ऑक्सीकरण संख्या दोनों -2 हैं। इसका तात्पर्य है कि ऑक्सीकरण संख्या किसी यौगिक में तत्व की ऑक्सीकरण अवस्था को दर्शाती है।
| समूह | $\mathbf{1}$ | $\mathbf{2}$ | $\mathbf{1 3}$ | $\mathbf{1 4}$ | $\mathbf{1 5}$ | $\mathbf{1 6}$ | $\mathbf{1 7}$ |
|---|---|---|---|---|---|---|---|
| तत्व | $\mathrm{Na}$ | $\mathrm{Mg}$ | $\mathrm{Al}$ | $\mathrm{Si}$ | $\mathrm{P}$ | $\mathrm{S}$ | $\mathrm{Cl}$ |
| यौगिक | $\mathrm{NaCl}$ | $\mathrm{MgSO_4}$ | $\mathrm{AlF_3}$ | $\mathrm{SiCl_4}$ | $\mathrm{P_4} \mathrm{O_10}$ | $\mathrm{SF_6}$ | $\mathrm{HClO}$ |
| समूह तत्व की उच्चतम ऑक्सीकरण संख्या अवस्था | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
किसी यौगिक में धातु की ऑक्सीकरण संख्या/अवस्था को कभी-कभी जर्मन रसायनज्ञ अल्फ्रेड स्टॉक द्वारा दिए गए संकेतन के अनुसार प्रस्तुत किया जाता है। इसे स्टॉक संकेतन के नाम से लोकप्रियता प्राप्त है। इसके अनुसार, ऑक्सीकरण संख्या को धातु के प्रतीक के बाद कोष्ठक में रोमन अंक में व्यक्त किया जाता है जो अणुसूत्र में ऑक्सीकरण संख्या को दर्शाता है। इस प्रकार ऑरस क्लोराइड और ऑरिक क्लोराइड को $\mathrm{Au}(\mathrm{I}) \mathrm{Cl}$ और $\mathrm{Au}(\mathrm{III}) \mathrm{Cl_3}$ लिखा जाता है। इसी प्रकार, स्टैनस क्लोराइड और स्टैनिक क्लोराइड को $\mathrm{Sn}$ (II) $\mathrm{Cl_2}$ और $\mathrm{Sn}(\mathrm{IV}) \mathrm{Cl_4}$ लिखा जाता है। ऑक्सीकरण संख्या में यह परिवर्तन ऑक्सीकरण अवस्था में परिवर्तन को दर्शाता है, जो बदले में यह पहचानने में सहायता करता है कि प्रजाति ऑक्सीकृत रूप में है या अपचयित रूप में। इस प्रकार, $\mathrm{Hg_2}(\mathrm{I}) \mathrm{Cl_2}$, $\mathrm{Hg}$ (II) $\mathrm{Cl_2}$ का अपचयित रूप है।
प्रश्न 8.3
स्टॉक संकेतन का प्रयोग कर निम्न यौगिकों को व्यक्त कीजिए: $\mathrm{HAuCl_4}, \mathrm{Tl_2} \mathrm{O}, \mathrm{FeO}$, $\mathrm{Fe_2} \mathrm{O_3}$, CuI, $\mathrm{CuO}, \mathrm{MnO}$ और $\mathrm{MnO_2}$।
हल
किसी यौगिक में वांछित तत्व की ऑक्सीकरण संख्या परिकलित करने के विभिन्न नियमों को लागू करने पर, प्रत्येक धात्विक तत्व की ऑक्सीकरण संख्या इस प्रकार है:
$ \begin{array}{ccc} \mathrm{HAuCl_4} & \rightarrow & \mathrm{Au} \text{ की } 3 \\ \mathrm{Tl_2} \mathrm{O} & \rightarrow & \mathrm{Tl} \text{ की } 1 \\ \mathrm{FeO} & \rightarrow & \mathrm{Fe} \text{ की } 2 \\ \mathrm{Fe_2} \mathrm{O_3} & \rightarrow & \mathrm{Fe} \text{ की } 3 \\ \mathrm{CuI} & \rightarrow & \mathrm{Cu} \text{ की } 1 \\ \mathrm{CuO} & \rightarrow & \mathrm{Cu} \text{ की } 2 \\ \mathrm{MnO} & \rightarrow & \mathrm{Mn} \text{ की } 2 \\ \mathrm{MnO_2} & \rightarrow & \mathrm{Mn} \text{ की } 4 \\ \end{array} $
इसलिए, इन यौगिकों को इस प्रकार व्यक्त किया जा सकता है:
$\mathrm{HAu}(\mathrm{III}) \mathrm{Cl_4}, \mathrm{Tl_2}$ (I)O, $\mathrm{Fe}(\mathrm{II}) \mathrm{O}, \mathrm{Fe_2}(\mathrm{III}) \mathrm{O_3}$, $\mathrm{Cu}(\mathrm{I}) \mathrm{I}, \mathrm{Cu}(\mathrm{II}) \mathrm{O}, \mathrm{Mn}(\mathrm{II}) \mathrm{O}, \mathrm{Mn}(\mathrm{IV}) \mathrm{O_2}$। ऑक्सीकरण संख्या के विचार को निरंतर ऑक्सीकरण, अपचयन, ऑक्सीकारक एजेंट (ऑक्सीडेंट), अपचायक एजेंट (रिडक्टेंट) और रेडॉक्स अभिक्रिया को परिभाषित करने के लिए लागू किया गया है। संक्षेप में, हम कह सकते हैं कि:
- ऑक्सीकरण: दिए गए पदार्थ में तत्व की ऑक्सीकरण संख्या में वृद्धि।
- अपचयन: दिए गए पदार्थ में तत्व की ऑक्सीकरण संख्या में कमी।
- ऑक्सीकारक एजेंट: एक अभिकर्मक जो दिए गए पदार्थ में किसी तत्व की ऑक्सीकरण संख्या बढ़ा सकता है। इन अभिकर्मकों को ऑक्सीडेंट भी कहा जाता है।
- अपचायक एजेंट: एक अभिकर्मक जो दिए गए पदार्थ में किसी तत्व की ऑक्सीकरण संख्या घटाता है। इन अभिकर्मकों को रिडक्टेंट भी कहा जाता है।
- रेडॉक्स अभिक्रियाएं: अभिक्रियाएं जिनमें परस्पर क्रिया करने वाले प्रजातियों की ऑक्सीकरण संख्या में परिवर्तन शामिल होता है।
समस्या 8.4
उस अभिक्रिया को उचित ठहराइए: $2 \mathrm{Cu_2} \mathrm{O}(\mathrm{s})+\mathrm{Cu_2} \mathrm{~S}(\mathrm{~s}) \rightarrow 6 \mathrm{Cu}(\mathrm{s})+\mathrm{SO_2}(\mathrm{~g})$ एक रेडॉक्स अभिक्रिया है। उस प्रजाति की पहचान कीजिए जो ऑक्सीकृत/अपचयित हुई है, जो ऑक्सीडेंट के रूप में कार्य करती है और जो रिडक्टेंट के रूप में कार्य करती है।
हल
आइए अब हम इस अभिक्रिया में उपस्थित प्रत्येक स्पीशीज़ को ऑक्सीकरण संख्या आवंटित करें। इससे हमें निम्नलिखित परिणाम मिलता है:
$$ \begin{aligned} & 2 \stackrel{+1}{\mathrm{Cu_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{s})+\stackrel{+1}{\mathrm{Cu_2}} \stackrel{-2}{\mathrm{~S}}(\mathrm{~s}) \rightarrow 6 \stackrel{0}{\mathrm{Cu}}(\mathrm{s})+\stackrel{+4-2}{\mathrm{SO_2}} \end{aligned} $$
इसलिए हम निष्कर्ष निकालते हैं कि इस अभिक्रिया में कॉपर +1 अवस्था से शून्य ऑक्सीकरण अवस्था में अपचयित होता है और सल्फर -2 अवस्था से +4 अवस्था में ऑक्सीकृत होता है। उपरोक्त अभिक्रिया इस प्रकार एक रेडॉक्स अभिक्रिया है।
इसके अतिरिक्त, $\mathrm{Cu_2} \mathrm{O}$ सल्फर की $\mathrm{Cu_2} \mathrm{~S}$ में ऑक्सीकरण संख्या बढ़ाने में सहायता करता है, इसलिए $\mathrm{Cu}(\mathrm{I})$ एक ऑक्सीकारक है; और $\mathrm{Cu_2} \mathrm{~S}$ का सल्फर $\mathrm{Cu_2} \mathrm{~S}$ स्वयं और $\mathrm{Cu_2} \mathrm{O}$ दोनों में उपस्थित कॉपर की ऑक्सीकरण संख्या घटाने में सहायता करता है; इसलिए $\mathrm{Cu_2} \mathrm{~S}$ का सल्फर एक अपचायक है।
8.3.1 रेडॉक्स अभिक्रियाओं के प्रकार
1. संयोजन अभिक्रियाएँ
एक संयोजन अभिक्रिया को इस प्रकार दर्शाया जा सकता है:
$$ \mathrm{A}+\mathrm{B} \rightarrow \mathrm{C} $$
इस तरह की अभिक्रिया को रेडॉक्स अभिक्रिया बनाने के लिए या तो A और B में से कोई एक या दोनों अवस्था में होना चाहिए। सभी दहन अभिक्रियाएँ, जो आधात्रीय डाइऑक्सीजन का उपयोग करती हैं, साथ ही डाइऑक्सीजन के अतिरिक्त अन्य तत्वों से संबंधित अभिक्रियाएँ भी रेडॉक्स अभिक्रियाएँ होती हैं। इस श्रेणी की कुछ महत्वपूर्ण उदाहरण हैं:
$$\stackrel{0}{\mathrm{C}}(\mathrm{s}) + \stackrel{0}{\mathrm{O_2}}(\mathrm{~g}) \xrightarrow{\Delta} \stackrel{+4-2}{\mathrm{CO_2}} (\mathrm{~g}) \tag{8.24} $$
$$3 \stackrel{0}{\mathrm{Mg}}(\mathrm{s})+ \stackrel{0}{\mathrm{N_2}}(\mathrm{~g}) \xrightarrow{\Delta} \stackrel{+2}{\mathrm{Mg_3}} \stackrel{-3}{\mathrm{~N_2}}(\mathrm{~s}) \tag{8.25}$$
$$\stackrel{-4+1}{\mathrm{CH_4}}(\mathrm{~g})+2 \stackrel{0}{\mathrm{O_2}}(\mathrm{g}) \xrightarrow{\Delta} \stackrel{+4-2}{\mathrm{CO_2}}(\mathrm{~g})+2 \stackrel{+1}{\mathrm{H_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{l})$$
2. वियोजन अभिक्रियाएँ
वियोजन अभिक्रियाएँ संयोजन अभिक्रियाओं के विपरीत होती हैं। ठीक-ठीक, एक वियोजन अभिक्रिया किसी यौगिक को दो या अधिक घटकों में तोड़ने का कार्य करती है जिनमें से कम से कम एक अवश्य मूल अवस्था में होता है। इस वर्ग की अभिक्रियाओं के उदाहरण इस प्रकार हैं:
$$2 \stackrel{+1}{\mathrm{H_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{l}) \xrightarrow{\Delta} 2 \stackrel{0}{\mathrm{H_2}}(\mathrm{~g}) + \stackrel{0}{\mathrm{O_2}}(\mathrm{~g})\tag{8.26}$$
$$\stackrel{+1-1}{\mathrm{NaH}}(\mathrm{s}) \xrightarrow{\Delta} 2 \stackrel{0}{\mathrm{Na}}(\mathrm{s})+ \stackrel{0}{\mathrm{H_2}} (\mathrm{~g}) \tag{8.27}$$
$$ 2 \stackrel{+1+5}{\mathrm{KCl}}\stackrel{-2}{\mathrm{O_3}}(\mathrm{~s}) \xrightarrow{\Delta} 2 \stackrel{+1-1}{\mathrm{KCl}}(\mathrm{s})+3 \stackrel{0}{\mathrm{O_2}}(\mathrm{~g}) \tag{8.28}$$
इस पर ध्यान दिया जाना चाहिए कि संयोजन अभिक्रियाओं में मीथेन में हाइड्रोजन की ऑक्सीकरण संख्या में कोई परिवर्तन नहीं होता है और अभिक्रिया (7.28) में पोटैशियम क्लोरेट में पोटैशियम की ऑक्सीकरण संख्या में भी कोई परिवर्तन नहीं होता है। यहाँ यह भी ध्यान दिया जाना चाहिए कि सभी वियोजन अभिक्रियाएँ रेडॉक्स अभिक्रियाएँ नहीं होती हैं। उदाहरण के लिए, कैल्शियम कार्बोनेट का वियोजन एक रेडॉक्स अभिक्रिया नहीं है।
$$\stackrel{+2}{\mathrm{Ca}}\stackrel{+4}{\mathrm{C}}\stackrel{-2}{\mathrm{O_3}} \mathrm{(s)} \xrightarrow{\Delta} \stackrel{+2-2}{\mathrm{CaO}} + \stackrel{+4-2}{\mathrm{CO_2}}\mathrm{(g)}$$
3. विस्थापन अभिक्रियाएँ
एक विस्थापन अभिक्रिया में, एक यौगिक में उपस्थित आयन (या परमाणु) को किसी अन्य तत्व के आयन (या परमाणु) द्वारा प्रतिस्थापित किया जाता है। इसे इस प्रकार दर्शाया जा सकता है:
$$ \mathrm{X}+\mathrm{YZ} \rightarrow \mathrm{XZ}+\mathrm{Y} $$
विस्थापन अभिक्रियाएँ दो श्रेणियों में बाँटी जाती हैं: धातु विस्थापन और अधातु विस्थापन।
(a) धातु विस्थापन: एक यौगिक में उपस्थित धातु को किसी अन्य धातु द्वारा प्रतिस्थापित किया जा सकता है जो अयुक्त अवस्था में हो। हमने पहले ही अनुभाग 7.2.1 के अंतर्गत इस श्रेणी की अभिक्रियाओं के बारे में चर्चा की है। धातु विस्थापन अभिक्रियाओं का उपयोग धातुकर्मीय प्रक्रियाओं में किया जाता है जिनमें अयस्कों में उपस्थित यौगिकों से शुद्ध धातुएँ प्राप्त की जाती हैं। ऐसी कुछ उदाहरण निम्नलिखित हैं:
$$\stackrel{+2+6-2}{\mathrm{CuSO_4}}(\mathrm{aq})+ \stackrel{0}{\mathrm{Zn}}(\mathrm{s}) \rightarrow \stackrel{0}{\mathrm{Cu}}(\mathrm{s})+\stackrel{+2+6-3}{\mathrm{ZnSO_4}}(\mathrm{aq}) \tag{8.29}$$
$$\stackrel{+5-2}{\mathrm{V_2O_5}}\mathrm{(s)} + 5 \stackrel{0}{\mathrm{Ca}}\mathrm{(s)} \xrightarrow{\Delta} 2 \stackrel{0}{\mathrm{V}} \mathrm{(s)} + 5 \stackrel{+2-2}{\mathrm{CaO}}\mathrm{(s)} \tag{8.30}$$
$$\stackrel{+4-1}{\mathrm{TiCl_4}}\mathrm{(l)} + 2 \stackrel{0}{\mathrm{Mg}}\mathrm{(s)} \xrightarrow{\Delta} \stackrel{0}{\mathrm{Ti}} \mathrm{(s)} + 2\stackrel{+2-1}{\mathrm{MgCl_2}}\mathrm{(s)} \tag{8.31}$$
$$\stackrel{+3-2}{\mathrm{Cr_2O_3}}\mathrm{(l)} + 2 \stackrel{0}{\mathrm{Al}}\mathrm{(s)} \xrightarrow{\Delta} \stackrel{+3-2}{\mathrm{Al_2O_3}} \mathrm{(s)} + 2\stackrel{0}{\mathrm{Cr}}\mathrm{(s)} \tag{8.32}$$
प्रत्येक स्थिति में, अपचायक धातु एक बेहतर अपचायक एजेंट होता है जिसे अपचयित किया जा रहा है, जो स्पष्ट रूप से इलेक्ट्रॉन खोने की अधिक क्षमता दर्शाता है जिसे अपचयित किया जा रहा है।
(b) अधातु विस्थापन: अधातु विस्थापन रेडॉक्स अभिक्रियाओं में हाइड्रोजन विस्थापन और ऑक्सीजन विस्थापन शामिल होता है जो शायद ही कभी होता है।
सभी क्षारीय धातुएं और कुछ क्षारीय मृदा धातुएं $(\mathrm{Ca}, \mathrm{Sr}$, और $\mathrm{Ba})$ जो बहुत अच्छे अपचायक हैं, ठंडे पानी से हाइड्रोजन को विस्थापित करेंगी।
$$2 \stackrel{0}{\mathrm{Na}}\mathrm{(s)} + 2 \stackrel{+1-2}{\mathrm{H_2O}}\mathrm{(l)} \rightarrow 2 \stackrel{+1-2+1}{\mathrm{NaOH}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Hg}}\mathrm{(g)} \tag{8.33}$$
$$ \stackrel{0}{\mathrm{2Ca}}\mathrm{(s)} + 2 \stackrel{+1-2}{\mathrm{H_2O}}\mathrm{(l)} \rightarrow 2 \stackrel{+2-2+1}{\mathrm{Ca(OH)_2}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Hg}}\mathrm{(g)} \tag{8.34}$$
कम सक्रिय धातुएँ जैसे मैग्नीशियम और आयरन भाप के साथ प्रतिक्रिया करके डाइहाइड्रोजन गैस उत्पन्न करती हैं:
$$ \stackrel{0}{\mathrm{Mg}}\mathrm{(s)} + \stackrel{+1-2}{2\mathrm{H_2O}}\mathrm{(l)} \xrightarrow{\Delta} \stackrel{+2-2+1}{\mathrm{Mg(OH)_2}} \mathrm{(s)} + \stackrel{0}{\mathrm{Hg}}\mathrm{(g)} \tag{8.35}$$
$$ \stackrel{0}{2\mathrm{Fe}}\mathrm{(s)} + \stackrel{+1-2}{3\mathrm{H_2O}}\mathrm{(l)} \xrightarrow{\Delta} \stackrel{+3-2}{\mathrm{Fe_2O_3}} \mathrm{(s)} + \stackrel{0}{3\mathrm{Hg}}\mathrm{(g)} \tag{8.36}$$
बहुत-सी धातुएँ, जिनमें वे भी शामिल हैं जो ठंडे पानी से प्रतिक्रिया नहीं करतीं, अम्लों से हाइड्रोजन को विस्थापित करने में सक्षम होती हैं। अम्लों से डाइहाइड्रोजन ऐसी धातुओं द्वारा भी उत्पन्न की जा सकती है जो भाप से प्रतिक्रिया नहीं करतीं। कैडमियम और टिन ऐसी धातुओं के उदाहरण हैं। अम्लों से हाइड्रोजन के विस्थापन के कुछ उदाहरण इस प्रकार हैं:
$$ \stackrel{0}{\mathrm{Zn}}\mathrm{(s)} + \stackrel{+1-1}{2\mathrm{HCl}}\mathrm{(aq)} \rightarrow \stackrel{+2-1}{\mathrm{ZnCl_2}} \mathrm{(aq)} + \stackrel{0}{\mathrm{H_2}}\mathrm{(g)} \tag{8.37}$$
$$ \stackrel{0}{\mathrm{Mg}}\mathrm{(s)} + \stackrel{+1-1}{2\mathrm{HCl}}\mathrm{(aq)} \rightarrow \stackrel{+2-1}{\mathrm{MgCl_2}} \mathrm{(aq)} + \stackrel{0}{\mathrm{H_2}}\mathrm{(g)} \tag{8.38}$$
$$ \stackrel{0}{\mathrm{Fe}}\mathrm{(s)} + \stackrel{+1-1}{2\mathrm{HCl}}\mathrm{(aq)} \rightarrow \stackrel{+2-1}{\mathrm{FeCl_2}} \mathrm{(aq)} + \stackrel{0}{\mathrm{H_2}}\mathrm{(g)} \tag{8.39}$$
अभिक्रियाएँ (8.37 से 8.39) प्रयोगशाला में डाइहाइड्रोजन गैस तैयार करने के लिए प्रयोग की जाती हैं। यहाँ, धातुओं की सक्रियता हाइड्रोजन गैस के निष्कासन की दर में परिलक्षित होती है, जो कि सबसे कम सक्रिय धातु $\mathrm{Fe}$ के लिए सबसे धीमी होती है, और सबसे अधिक सक्रिय धातु, Mg के लिए सबसे तेज़ होती है। बहुत कम सक्रिय धातुएँ, जो मूल अवस्था में पाई जाती हैं जैसे चाँदी (Ag), और सोना (Au), हाइड्रोक्लोरिक अम्ल के साथ भी अभिक्रिया नहीं करती हैं।
खंड (8.2.1) में हम पहले ही चर्चा कर चुके हैं कि धातुएँ - जिंक $(\mathrm{Zn})$, तांबा $(\mathrm{Cu})$ और चाँदी (Ag) इलेक्ट्रॉन खोने की प्रवृत्ति के माध्यम से अपनी अपचायक सक्रियता को क्रम $\mathrm{Zn}>$ $\mathrm{Cu}>\mathrm{Ag}$ में दर्शाती हैं। धातुओं की तरह, हैलोजनों के लिए भी सक्रियता श्रेणी मौजूद है। ये तत्व ऑक्सीकारक एजेंट के रूप में अपनी शक्ति में तब्दीली दिखाते हैं जब हम आवर्त सारणी के समूह 17 में फ्लोरीन से आयोडीन की ओर नीचे जाते हैं। इसका तात्पर्य है कि फ्लोरीन इतना सक्रिय है कि यह विलयन में क्लोराइड, ब्रोमाइड और आयोडाइड आयनों को प्रतिस्थापित कर सकता है। वास्तव में, फ्लोरीन इतना सक्रिय है कि यह पानी पर आक्रमण करता है और पानी की ऑक्सीजन को विस्थापित कर देता है:
$$ \stackrel{+1-2}{2\mathrm{H_2O}}\mathrm{(l)} + \stackrel{0}{2\mathrm{F_2}}\mathrm{(g)} \rightarrow \stackrel{+1-1}{4\mathrm{HF}} \mathrm{(aq)} + \stackrel{0}{\mathrm{O_2}}\mathrm{(g)} \tag{8.40}$$
इसी कारण से क्लोरीन, ब्रोमीन और आयोडीन के विस्थापन अभिक्रियाएँ जिनमें फ्लोरीन का उपयोग होता है, आमतौर पर जलीय विलयन में नहीं की जातीं। दूसरी ओर, क्लोरीन जलीय विलयन में ब्रोमाइड और आयोडाइड आयनों को विस्थापित कर सकता है जैसा कि नीचे दिखाया गया है:
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{+1-1}{2\mathrm{KBr}}\mathrm{(aq)} \rightarrow \stackrel{+1-1}{2\mathrm{KCl}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Br_2}}\mathrm{(l)} \tag{8.41}$$
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{+1-1}{2\mathrm{KI}}\mathrm{(aq)} \rightarrow \stackrel{+1-1}{2\mathrm{KCl}} \mathrm{(aq)} + \stackrel{0}{\mathrm{I_2}}\mathrm{(s)} \tag{8.42}$$
चूँकि $\mathrm{Br_2}$ और $\mathrm{I_2}$ रंगीन होते हैं और $\mathrm{CCl_4}$ में घुल जाते हैं, इन्हें विलयन के रंग से आसानी से पहचाना जा सकता है। उपरोक्त अभिक्रियाओं को आयनिक रूप में इस प्रकार लिखा जा सकता है:
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{-1}{2\mathrm{Br^-}}\mathrm{(aq)} \rightarrow \stackrel{-1}{2\mathrm{Cl^-}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Br_2}}\mathrm{(s)} \tag{8.41a}$$
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{-1}{2\mathrm{I^-}}\mathrm{(aq)} \rightarrow \stackrel{-1}{2\mathrm{Cl^-}} \mathrm{(aq)} + \stackrel{0}{\mathrm{I_2}}\mathrm{(s)} \tag{8.42a}$$
प्रतिक्रियाएँ (8.41) और (8.42) प्रयोगशाला में $\mathrm{Br}^{-}$ और $\mathrm{I}^{-}$ की पहचान के आधार बनाती हैं, जिस परीक्षण को आमतौर पर ‘लेयर टेस्ट’ कहा जाता है। यहाँ यह उल्लेख करना अनुचित नहीं होगा कि ब्रोमीन भी विलयन में आयोडाइड आयन को विस्थापित कर सकता है:
$$ \stackrel{0}{\mathrm{Br_2}(\mathrm{l})}+\stackrel{-1}{2 \mathrm{I}^{-}}(\mathrm{aq}) \rightarrow \stackrel{-1}{2 \mathrm{Br}^{-}} (\mathrm{aq})+ \stackrel{0}{\mathrm{I_2}} (\mathrm{~s}) \tag{8.43} $$
हैलोजन विस्थापन प्रतिक्रियाओं का एक सीधा औद्योगिक अनुप्रयोग है। हैलोजनों को उनके हैलाइड्स से पुनः प्राप्त करने के लिए एक ऑक्सीकरण प्रक्रिया की आवश्यकता होती है, जिसे इस प्रकार दर्शाया गया है:
$$2 \mathrm{X}^{-} \rightarrow \mathrm{X_2}+2 \mathrm{e}^{-} \tag{8.44}$$
यहाँ $\mathrm{X}$ एक हैलोजन तत्व को दर्शाता है। जबकि $\mathrm{Cl}^{-}$, $\mathrm{Br}^{-}$ और $\mathrm{I}^{-}$ को ऑक्सीकृत करने के रासायनिक साधन उपलब्ध हैं, क्योंकि फ्लोरीन सबसे मजबूत ऑक्सीकारक एजेंट है; $\mathrm{F}^{-}$ आयनों को रासायनिक साधनों से $\mathrm{F_2}$ में बदलने का कोई तरीका नहीं है। $\mathrm{F_2}$ को $\mathrm{F}^{-}$ से प्राप्त करने का एकमात्र तरीका विद्युत-अपघटनीय ऑक्सीकरण है, जिसके विवरण आप बाद के चरण में पढ़ेंगे।
4. असमानुपातन प्रतिक्रियाएँ
विषमानुपातन अभिक्रियाएँ ऑक्सी-अपचय अभिक्रियाओं का एक विशेष प्रकार हैं। एक विषमानुपातन अभिक्रिया में एक तत्व एक ही ऑक्सीकरण अवस्था में एक साथ ऑक्सीकृत और अपचयित होता है। विषमानुपातन अभिक्रिया में क्रियाकलापों में से एक पदार्थ हमेशा ऐसा तत्व रखता है जो कम से कम तीन ऑक्सीकरण अवस्थाओं में विद्यमान रह सकता है। अभिक्रिया में भाग लेने वाले पदार्थ के रूप में वह तत्व मध्यवर्ती ऑक्सीकरण अवस्था में होता है; और उस तत्व की उच्च तथा निम्न दोनों ऑक्सीकरण अवस्थाएँ अभिक्रिया में बनती हैं। हाइड्रोजन पेरॉक्साइड का विघटन इस अभिक्रिया का एक परिचित उदाहरण है, जिसमें ऑक्सीजन विषमानुपातन अनुभव करता है।
$$\stackrel{+1-1}{2\mathrm{H_2O_2}}\mathrm{(aq)} \rightarrow \stackrel{+1-2}{2\mathrm{H_2O}} \mathrm{(l)} + \stackrel{0}{\mathrm{O_2}}\mathrm{(g)} \tag{8.45}$$
यहाँ पेरॉक्साइड की ऑक्सीजन, जो -1 अवस्था में उपस्थित है, $\mathrm{O_2}$ में शून्य ऑक्सीकरण अवस्था में तथा $\mathrm{H_2} \mathrm{O}$ में -2 ऑक्सीकरण अवस्था में परिवर्तित हो जाती है।
फॉस्फोरस, सल्फर और क्लोरीन क्षारीय माध्यम में विषमानुपातन अनुभव करते हैं जैसा नीचे दिखाया गया है :
$$\stackrel{0}{\mathrm{P_4}}\mathrm{(s)}+ \stackrel{}{3\mathrm{OH^-}}\mathrm{(aq)} + \stackrel{}{3\mathrm{H_2O}}\mathrm{(l)} \rightarrow \stackrel{-3}{2\mathrm{P}} \mathrm{H_3} \mathrm{(g)} + 3\mathrm{H_2P}\stackrel{+1}{\mathrm{O_2^-}}\mathrm{(aq)} \tag{8.46}$$
$$\stackrel{0}{\mathrm{S_8}}\mathrm{(s)}+ \stackrel{}{12\mathrm{OH^-}}\mathrm{(aq)} \rightarrow \stackrel{-2}{4\mathrm{S}^{2-}}\mathrm{(aq)} + \stackrel{+2}{2\mathrm{S_2O_3}^{2-}} \mathrm{(aq)} + 6\mathrm{H_2O}\mathrm{(l)} \tag{8.47}$$
$$\stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)}+ \stackrel{}{2\mathrm{OH^-}}\mathrm{(aq)} \rightarrow \stackrel{+1}{4\mathrm{ClO^-}}\mathrm{(aq)} + \stackrel{-1}{2\mathrm{Cl^-}} \mathrm{(aq)} + \mathrm{H_2O}\mathrm{(l)} \tag{8.48}$$
अभिक्रिया (8.48) घरेलू ब्लीचिंग एजेंटों के निर्माण का वर्णन करती है। अभिक्रिया में बना हुआ हाइपोक्लोराइट आयन $\left(\mathrm{ClO}^{-}\right)$ रंग-देने वाले दागों को रहित यौगिकों में ऑक्सीकृत करता है।
यहाँ उल्लेख करना रोचक है कि जबकि ब्रोमीन और आयोडीन अभिक्रिया (8.48) में क्लोरीन द्वारा प्रदर्शित प्रवृत्ति का अनुसरण करते हैं, फ्लोरीन क्षार के साथ अभिक्रिया करते समय इस व्यवहार से विचलन दिखाता है। फ्लोरीन के मामले में होने वाली अभिक्रिया इस प्रकार है:
$$2 \mathrm{~F_2}(\mathrm{~g})+2 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow 2 \mathrm{~F}^{-}(\mathrm{aq})+\mathrm{OF_2}(\mathrm{~g})+\mathrm{H_2} \mathrm{O}(\mathrm{l}) \tag{8.49}$$
(इस बात को सावधानी से नोट किया जाना चाहिए कि अभिक्रिया (8.49) में फ्लुओरीन निस्संदेह जल पर आक्रमण कर कुछ ऑक्सीजन भी उत्पन्न करेगा)। फ्लुओरीन द्वारा दिखाया गया यह विचलन हमारे लिए आश्चर्यजनक नहीं है क्योंकि हमें फ्लुओरीन की सीमा का पता है कि, सबसे अधिक विद्युतऋणात्मक तत्व होने के कारण, यह कोई धनात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं कर सकता। इसका अर्थ है कि हैलोजनों में, फ्लुओरीन विसमानुपातन प्रवृत्ति नहीं दिखाता।
प्रश्न 8.5
निम्नलिखित में से कौन-सी स्पीशीज़ विसमानुपातन अभिक्रिया नहीं दिखातीं और क्यों?
(\mathrm{ClO}^{-}, \mathrm{ClO_2}^{-}, \mathrm{ClO_3}^{-})और (\mathrm{ClO_4}^{-})
साथ ही उन प्रत्येक स्पीशीज़ के लिए अभिक्रिया लिखें जो विसमानुपातित होती हैं।
हल
ऊपर सूचीबद्ध क्लोरीन के ऑक्सोऐनियनों में, (\mathrm{ClO_4}^{-})विसमानुपातित नहीं होता क्योंकि इस ऑक्सोऐनियन में क्लोरीन अपनी उच्चतम ऑक्सीकरण अवस्था +7 में उपस्थित है। क्लोरीन के अन्य तीन ऑक्सोऐनियनों के लिए विसमानुपातन अभिक्रियाएँ इस प्रकार हैं:
(\stackrel{+1}{2\mathrm{ClO^-}} \longrightarrow \stackrel{-1}{2\mathrm{Cl^-}}+ \stackrel{+5}{\mathrm{ClO_3^-}})
(\stackrel{+}{6\mathrm{Cl}} \mathrm{O_2}^- \xrightarrow{hv} \stackrel{+5}{4\mathrm{Cl}} \mathrm{C_3}^- + \stackrel{-1}{2\mathrm{Cl^-}})
(\stackrel{+5}{4\mathrm{Cl}} \mathrm{O_3}^- \longrightarrow \stackrel{-1}{\mathrm{Cl^-}} + 3\stackrel{+7}{\mathrm{Cl}}\mathrm{O_4}^-)
प्रश्न 8.6
निम्नलिखित ऑक्सी-अपचय अभिक्रियाओं के वर्गीकरण की एक योजना सुझाएँ
(a) (\mathrm{N_2}) (g) (+\mathrm{O_2}) (g) (\rightarrow 2 \mathrm{NO}) (g)
(b) (2 \mathrm{~Pb}\left(\mathrm{NO_3}\right)_{2}) (घ) (\rightarrow 2 \mathrm{PbO}) (घ) (+4 \mathrm{NO_2}) (ग) + (\mathrm{O_2}(\mathrm{~ग}))
(c) (\mathrm{NaH}) (घ) (+\mathrm{H_2} \mathrm{O}) (द्र) (\rightarrow \mathrm{NaOH}\left(\right.) जलीय) (+\mathrm{H_2}) (ग)
(d) (2 \mathrm{NO_2}) (ग) (+2 \mathrm{OH}^{-})(जलीय) (\rightarrow \mathrm{NO_2}^{-}(\mathrm{जलीय})+) (\mathrm{NO_3}^{-}(\mathrm{जलीय})+\mathrm{H_2} \mathrm{O}(\mathrm{द्र}))
हल
अभिक्रिया (a) में, नाइट्रिक ऑक्साइड यौगिक मूलभूत पदार्थों, नाइट्रोजन और ऑक्सीजन के संयोजन से बनता है; इसलिए यह संयोजन ऑक्सी-अपचय अभिक्रिया का उदाहरण है। अभिक्रिया (b) में लेड नाइट्रेट के तीन घटकों में टूटना शामिल है; इसलिए इसे अपघटन ऑक्सी-अपचय अभिक्रिया के अंतर्गत वर्गीकृत किया गया है। अभिक्रिया (c) में, जल के हाइड्रोजन को हाइड्राइड आयन द्वारा डाइहाइड्रोजन गैस में विस्थापित किया गया है। इसलिए इसे विस्थापन ऑक्सी-अपचय अभिक्रिया कहा जा सकता है। अभिक्रिया (d) में (\mathrm{NO_2}) (+4 अवस्था) का (\mathrm{NO_2}^{-})(+3 अवस्था) और (\mathrm{NO_3}^{-})(+5 अवस्था) में विषमानुपातन होता है। इसलिए अभिक्रिया (d) विषमानुपातन ऑक्सी-अपचय अभिक्रिया का उदाहरण है।
भिन्न ऑक्सीकरण संख्या का विरोधाभास
कभी-कभी हम कुछ ऐसे यौगिकों के साथ सामना करते हैं जिनमें यौगिक में किसी विशेष तत्व की ऑक्सीकरण संख्या भिन्न होती है। उदाहरण हैं:
(\mathrm{C_3} \mathrm{O_2}) [जहाँ कार्बन की ऑक्सीकरण संख्या (4/3) है],
(\mathrm{Br_3} \mathrm{O_8}) [जहाँ ब्रोमीन की ऑक्सीकरण संख्या (16/3) है]
और $\mathrm{Na_2} \mathrm{~S_4} \mathrm{O_6}$ (जहाँ सल्फर की ऑक्सीकरण संख्या 2.5 है)।
हम जानते हैं कि भिन्नात्मक ऑक्सीकरण संख्या का विचार हमें अविश्वसनीय लगता है, क्योंकि इलेक्ट्रॉन कभी भी भिन्न रूप में साझा/स्थानांतरित नहीं होते हैं। वास्तव में यह भिन्नात्मक ऑक्सीकरण अवस्था परीक्षणाधीन तत्व की औसत ऑक्सीकरण अवस्था होती है और संरचनात्मक मापदंडों से पता चलता है कि तत्व जिसके लिए भिन्नात्मक ऑक्सीकरण अवस्था प्राप्त होती है, वह विभिन्न ऑक्सीकरण अवस्थाओं में उपस्थित होता है। प्रजातियों $\mathrm{C_3} \mathrm{O_2}, \mathrm{Br_3} \mathrm{O_8}$ और $\mathrm{S_4} \mathrm{O_6}^{2-}$ की संरचना निम्नलिखित बंधन परिस्थितियों को प्रकट करती है:

प्रत्येक प्रजाति में तारांकित चिह्नित तत्व उसी तत्व के बाकी परमाणुओं से भिन्न ऑक्सीकरण अवस्था (ऑक्सीकरण संख्या) प्रदर्शित कर रहा है। यह दर्शाता है कि $\mathrm{C_3} \mathrm{O_2}$ में दो कार्बन परमाणु प्रत्येक +2 ऑक्सीकरण अवस्था में हैं, जबकि तीसरा शून्य ऑक्सीकरण अवस्था में है और औसत $4 / 3$ है। तथापि, वास्तविक चित्र यह है कि दोनों सिरों के कार्बन +2 हैं और मध्य कार्बन शून्य है। इसी प्रकार $\mathrm{Br_3} \mathrm{O_8}$ में दोनों सिरों के ब्रोमीन परमाणु प्रत्येक +6 ऑक्सीकरण अवस्था में हैं और मध्य ब्रोमीन +4 ऑक्सीकरण अवस्था में है। एक बार फिर औसत, जो वास्तविकता से भिन्न है, $16 / 3$ है। इसी तरह, प्रजाति $\mathrm{S_4} \mathrm{O_6}^{2-}$ में दोनों सिरों के सल्फर प्रत्येक +5 ऑक्सीकरण अवस्था प्रदर्शित करते हैं और दो मध्य सल्फर शून्य हैं। $\mathrm{S_4} \mathrm{O_6}{ }^{2-}$ के चार सल्फरों की ऑक्सीकरण संख्याओं का औसत 2.5 है, जबकि वास्तविकता यह है कि प्रत्येक सल्फर के लिए क्रमशः $+5,0,0$ और +5 ऑक्सीकरण संख्या है।
इस प्रकार, हम सामान्य रूप से यह निष्कर्ष निकाल सकते हैं कि आंशिक ऑक्सीकरण अवस्था के विचार को सावधानी के साथ लेना चाहिए और वास्तविकता केवल संरचनाओं द्वारा ही प्रकट होती है। इसके अतिरिक्त, जब भी हम किसी विशेष तत्व की किसी स्पीशीज़ में आंशिक ऑक्सीकरण अवस्था के साथ सामना करते हैं, तो हमें यह समझना चाहिए कि यह केवल औसत ऑक्सीकरण संख्या है। वास्तविकता में (जो केवल संरचनाओं द्वारा प्रकट होती है), वह तत्व उस विशेष स्पीशीज़ में एक से अधिक पूर्ण संख्या वाली ऑक्सीकरण अवस्थाओं में उपस्थित होता है। $\mathrm{Fe_3} \mathrm{O_4}, \mathrm{Mn_3} \mathrm{O_4}$, $\mathrm{Pb_3} \mathrm{O_4}$ कुछ अन्य उदाहरण हैं ऐसे यौगिकों के, जो मिश्र ऑक्साइड हैं, जहाँ हम धातु परमाणु की आंशिक ऑक्सीकरण अवस्थाओं के साथ सामना करते हैं। हालांकि, ऑक्सीकरण अवस्थाएँ आंशिक हो सकती हैं जैसे $\mathrm{O_2}^{+}$और $\mathrm{O_2}^{-}$में जहाँ यह क्रमशः $+1 / 2$ और $-1 / 2$ है।
प्रश्न 8.7
निम्नलिखित अभिक्रियाएँ भिन्न-भिन्न क्यों होती हैं?
$$ \begin{array}{r} \mathrm{Pb_3} \mathrm{O_4}+8 \mathrm{HCl} \rightarrow 3 \mathrm{PbCl_2}+\mathrm{Cl_2}+4 \mathrm{H_2} \mathrm{O} \text { और } \\ \mathrm{Pb_3} \mathrm{O_4}+4 \mathrm{HNO_3} \rightarrow 2 \mathrm{~Pb}\left(\mathrm{NO_3}\right)_{2}+\mathrm{PbO_2}+ 2 \mathrm{H_2} \mathrm{O}\\ \end{array} $$
हल
$\mathrm{Pb_3} \mathrm{O_4}$ वास्तव में $\mathrm{PbO}$ के 2 मोल और $\mathrm{PbO_2}$ के 1 मोल का एक स्टॉइकियोमेट्रिक मिश्रण है। $\mathrm{PbO_2}$ में लेड +4 ऑक्सीकरण अवस्था में उपस्थित होता है, जबकि $\mathrm{PbO}$ में लेड की स्थिर ऑक्सीकरण अवस्था +2 है। इस प्रकार $\mathrm{PbO_2}$ एक ऑक्सीडेंट (ऑक्सीकारक एजेंट) के रूप में कार्य कर सकता है और, इसलिए, $\mathrm{HCl}$ के $\mathrm{Cl}^{-}$आयन को क्लोरीन में ऑक्सीडाइज़ कर सकता है। हमें यह भी ध्यान रखना चाहिए कि $\mathrm{PbO}$ एक क्षारीय ऑक्साइड है। इसलिए, अभिक्रिया
$\mathrm{Pb_3} \mathrm{O_4}+8 \mathrm{HCl} \rightarrow 3 \mathrm{PbCl_2}+\mathrm{Cl_2}+4 \mathrm{H_2} \mathrm{O}$ को दो अभिक्रियाओं में विभाजित किया जा सकता है, अर्थात्:
$$ \begin{aligned} & 2 \mathrm{PbO}+4 \mathrm{HCl} \rightarrow 2 \mathrm{PbCl_2}+2 \mathrm{H_2} \mathrm{O} \\ & \text { (अम्ल-क्षार अभिक्रिया) } \\ \end{aligned} $$
$$ \begin{aligned} & & \stackrel{+4}{\mathrm{Pb}} \mathrm{O_2} +4 \stackrel{-1}{\mathrm{HCl}} \rightarrow \stackrel{+2}{\mathrm{PbCl_2}} + \stackrel{0}{\mathrm{Cl_2}}+2 \mathrm{H_2} \mathrm{O} \\ & &\text { (रेडॉक्स अभिक्रिया) } \end{aligned} $$
चूँकि $\mathrm{HNO_3}$ स्वयं एक ऑक्सीकारक एजेंट है, इसलिए यह संभावना कम है कि $\mathrm{PbO_2}$ और $\mathrm{HNO_3}$ के बीच अभिक्रिया हो। हालाँकि, $\mathrm{PbO}$ और $\mathrm{HNO_3}$ के बीच अम्ल-क्षार अभिक्रिया होती है जैसा कि नीचे दिया गया है:
$$ 2 \mathrm{PbO}+4 \mathrm{HNO_3} \rightarrow 2 \mathrm{~Pb}\left(\mathrm{NO_3}\right)_{2}+2 \mathrm{H_2} \mathrm{O} $$
यह $\mathrm{HNO_3}$ के विरुद्ध $\mathrm{PbO_2}$ की निष्क्रिय प्रकृति है जो इस अभिक्रिया को $\mathrm{HCl}$ के साथ बाद में होने वाली अभिक्रिया से भिन्न बनाती है।
8.3.2 ऑक्सी-अपचय अभिक्रियाओं का संतुलन
ऑक्सी-अपचय प्रक्रियाओं के लिए रासायनिक समीकरणों को संतुलित करने के दो तरीके प्रयुक्त होते हैं। इनमें से एक विधि अपचायक और ऑक्सीकारक की ऑक्सीकरण संख्या में आने वाले परिवर्तन पर आधारित है और दूसरी विधि ऑक्सी-अपचय अभिक्रिया को दो अर्ध-अभिक्रियाओं में विभाजित करने पर आधारित है — एक जिसमें ऑक्सीकरण होता है और दूसरी जिसमें अपचयन होता है। दोनों विधियाँ प्रयोग में हैं और इनके प्रयोग का चयन उस व्यक्ति पर निर्भर करता है जो उनका उपयोग कर रहा है।
(a) ऑक्सीकरण संख्या विधि: ऑक्सीकरण-अपचयन अभिक्रियाओं के लिए समीकरण लिखते समय, जैसे अन्य अभिक्रियाओं के लिए होता है, अभिकारकों और उत्पादों के लिए संरचनाओं और सूत्रों को जानना आवश्यक होता है। ऑक्सीकरण संख्या विधि को अब निम्नलिखित चरणों में स्पष्ट किया गया है:
चरण 1: प्रत्येक अभिकारक और उत्पाद के लिए सही सूत्र लिखें।
चरण 2: अभिक्रिया में सभी तत्वों को ऑक्सीकरण संख्या देकर उन परमाणुओं की पहचान करें जिनकी ऑक्सीकरण संख्या में परिवर्तन होता है।
चरण 3: प्रत्येक परमाणु के लिए और संपूर्ण अणु/आयन के लिए जिसमें वह हो रहा है, ऑक्सीकरण संख्या में वृद्धि या कमी की गणना करें। यदि ये बराबर नहीं हैं तो उपयुक्त संख्या से गुणा करें ताकि ये बराबर हो जाएँ। (यदि आपको लगे कि दो पदार्थों का अपचयन हो रहा है और किसी का ऑक्सीकरण नहीं हो रहा या इसके विपरीत, तो कुछ गलत है। या तो अभिकारकों या उत्पादों के सूत्र गलत हैं या ऑक्सीकरण संख्या सही ढंग से निर्धारित नहीं की गई हैं)।
चरण 4: यदि अभिक्रिया जल में हो रही है तो आयनों की भागीदारी सुनिश्चित करें, उपयुक्त पक्ष पर अभिव्यक्ति में $\mathrm{H}^{+}$ या $\mathrm{OH}^{-}$ आयनों को जोड़ें ताकि अभिकारकों और उत्पादों के कुल आयनिक आवेश बराबर हो जाएं। यदि अभिक्रिया अम्लीय विलयन में की जा रही है, तो समीकरण में $\mathrm{H}^{+}$ आयनों का प्रयोग करें; यदि क्षारीय विलयन में है, तो $\mathrm{OH}^{-}$ आयनों का प्रयोग करें।
चरण 5: अभिव्यक्ति के दोनों पक्षों पर हाइड्रोजन परमाणुओं की संख्या को बराबर करने के लिए अभिकारकों या उत्पादों में पानी $\left(\mathrm{H_2} \mathrm{O}\right)$ के अणु जोड़ें। अब ऑक्सीजन परमाणुओं की संख्या भी जांचें। यदि अभिकारकों और उत्पादों में ऑक्सीजन परमाणुओं की संख्या समान है, तो समीकरण संतुलित रेडॉक्स अभिक्रिया को दर्शाता है।
आइए अब नीचे दी गई कुछ समस्याओं की सहायता से इस विधि में शामिल चरणों की व्याख्या करें:
समस्या 8.8
पोटैशियम डाइक्रोमेट(VI), (\mathrm{K_2} \mathrm{Cr_2} \mathrm{O_7}) का अम्लीय विलयन में सोडियम सल्फाइट, (\mathrm{Na_2} \mathrm{SO_3}) के साथ अभिक्रिया करने पर क्रोमियम(III) आयन और सल्फेट आयन देने के लिए निवल आयनिक समीकरण लिखिए।
हल
चरण 1: अस्थायी आयनिक समीकरण है:
$$ \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+\mathrm{SO_3}^{2-}(\mathrm{aq}) \rightarrow \mathrm{Cr}^{3+}(\mathrm{aq}) +\mathrm{SO_4}^{2-}(\mathrm{aq}) $$
चरण 2: (\mathrm{Cr}) और (\mathrm{S}) के लिए ऑक्सीकरण संख्याएँ निर्धारित कीजिए
(\stackrel{+6}{\mathrm{Cr_2}} \stackrel{-2}{\mathrm{O_7}^{2-}}(\mathrm{aq})+\stackrel{+4-2}{\mathrm{SO_3}^{2-}}(\mathrm{aq}) \rightarrow \stackrel{+3}{\mathrm{Cr}}(\mathrm{aq})+ \stackrel{+6-2}{\mathrm{SO_4}{ }^{2-}}(\mathrm{aq}))
इससे संकेत मिलता है कि डाइक्रोमेट आयन ऑक्सीकारक है और सल्फाइट आयन अपचायक है।
चरण 3: ऑक्सीकरण संख्या में वृद्धि और कमी की गणना करें और उन्हें बराबर करें: चरण-2 से हम देख सकते हैं कि क्रोमियम और सल्फर की ऑक्सीकरण अवस्था में परिवर्तन हो रहा है। क्रोमियम की ऑक्सीकरण अवस्था +6 से +3 हो जाती है। समीकरण के दाहिने हाथ की ओर क्रोमियम की ऑक्सीकरण अवस्था में +3 की कमी होती है। सल्फर की ऑक्सीकरण अवस्था +4 से +6 हो जाती है। समीकरण के दाहिने हाथ की ओर सल्फर की ऑक्सीकरण अवस्था में +2 की वृद्धि होती है। ऑक्सीकरण अवस्था की वृद्धि और कमी को बराबर करने के लिए, दाहिने हाथ की ओर क्रोमियम आयन से पहले अंक 2 और सल्फेट आयन से पहले अंक 3 रखें और समीकरण के दोनों ओर क्रोमियम और सल्फर परमाणुओं को संतुलित करें। इस प्रकार हम प्राप्त करते हैं
$\stackrel{+6}{\mathrm{Cr_2}} \stackrel{-2}{\mathrm{O_7}^{2-}}(\mathrm{aq})+3\stackrel{+4-2}{\mathrm{SO_3}^{2-}}(\mathrm{aq}) \rightarrow \stackrel{+3}{\mathrm{Cr^{3+}}}(\mathrm{aq})+ 3\stackrel{+6-2}{\mathrm{SO_4}{ }^{2-}}(\mathrm{aq})$
चरण 4: चूंकि अभिक्रिया अम्लीय माध्यम में होती है, और आगे आयनिक आवेश दोनों ओर बराबर नहीं हैं, आयनिक आवेशों को बराबर करने के लिए बाईं ओर $8 \mathrm{H}^{+}$ जोड़ें
$$ \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+3\mathrm{SO_3}^{2-}(\mathrm{aq}) + 8\mathrm{H^+} \rightarrow 2\mathrm{Cr}^{3+}(\mathrm{aq}) + 3\mathrm{SO_4}^{2-}(\mathrm{aq}) $$
चरण 5: अंत में, हाइड्रोजन परमाणुओं की गिनती करें, और दाहिनी ओर उपयुक्त संख्या में जल अणुओं (अर्थात् $4 \mathrm{H_2} \mathrm{O}$) जोड़कर संतुलित रेडॉक परिवर्तन प्राप्त करें।
$$ \begin{aligned} & \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+3 \mathrm{SO_3}{ }^{2-}(\mathrm{aq})+8 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow \\ & \quad 2 \mathrm{Cr}^{3+}(\mathrm{aq})+3 \mathrm{SO_4}{ }^{2-}(\mathrm{aq})+4 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \end{aligned} $$
प्रश्न 8.9
परमैंगनेट आयन ब्रोमाइड आयन से क्षारीय माध्यम में अभिक्रिया करके मैंगनीज़ डाइऑक्साइड और ब्रोमेट आयन देता है। अभिक्रिया के लिए संतुलित आयनिक समीकरण लिखिए।
हल
चरण 1: असंतुलित आयनिक समीकरण है:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{Br}^{-}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+\mathrm{BrO_3}^{-}(\mathrm{aq})$
चरण 2: $\mathrm{Mn}$ और $\mathrm{Br}$ के लिए ऑक्सीकरण संख्याएँ निर्धारित कीजिए
$\stackrel{+7}{\mathrm{Mn}} \mathrm{O_4}^{-} (\mathrm{aq})+\stackrel{-1}{\mathrm{Br^-}}(\mathrm{aq}) \longrightarrow \stackrel{+4}{\mathrm{Mn}} \mathrm{O_2}(\mathrm{s})+\stackrel{+5}{\mathrm{BrO_3}^{-}}(\mathrm{aq})$
इससे संकेत मिलता है कि परमैंगनेट आयन ऑक्सीकारक है और ब्रोमाइड आयन अपचायक है।
चरण 3: ऑक्सीकरण संख्या में वृद्धि और कमी की गणना कीजिए, और वृद्धि को कमी के बराबर बनाइए।
$\stackrel{+7}{2 \mathrm{Mn}} \mathrm{O_4}^{-} (\mathrm{aq})+\stackrel{-1}{\mathrm{Br}}(\mathrm{aq}) \rightarrow 2 \stackrel{+4}{\mathrm{Mn}} \mathrm{O_2}(\mathrm{~s})+ \stackrel{+5}{\mathrm{Br}} \mathrm{O_3}^{-}(\mathrm{aq})$
चरण 4: चूँकि अभिक्रिया क्षारीय माध्यम में हो रही है और आयनिक आवेश दोनों ओर बराबर नहीं हैं, दाहिनी ओर आयनिक आवेश को बराबर करने के लिए $2 \mathrm{OH}^{-}$ आयन जोड़ें।
$2 \mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{Br}^{-}(\mathrm{aq}) \rightarrow 2 \mathrm{MnO_2}(\mathrm{~s})+ \mathrm{BrO_3}^{-}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq})$
चरण 5: अंत में, हाइड्रोजन परमाणुओं की गिनती करें और बाएँ ओर उपयुक्त संख्या में जल अणु (अर्थात् एक $\mathrm{H_2} \mathrm{O}$ अणु) जोड़कर संतुलित रेडॉक्स परिवर्तन प्राप्त करें।
$$ 2 \mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{Br}^{-}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow 2 \mathrm{MnO_2}(\mathrm{~s}) +\mathrm{BrO_3}^{-}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq}) $$
(b) अर्ध-अभिक्रिया विधि: इस विधि में दोनों अर्ध समीकरणों को पृथक-पृथक संतुलित किया जाता है और फिर उन्हें संतुलित समीकरण देने के लिए एक साथ जोड़ा जाता है।
मान लीजिए हमें अम्लीय माध्यम में $\mathrm{Fe}^{2+}$ आयनों के $\mathrm{Fe}^{3+}$ आयनों में ऑक्सीकरण का समीकरण संतुलित करना है, जिसमें डाइक्रोमेट आयन $\left(\mathrm{Cr_2} \mathrm{O_7}\right)^{2-}$ द्वारा $\mathrm{Cr_2} \mathrm{O_7}^{2-}$ आयनों को $\mathrm{Cr}^{3+}$ आयनों में अपचयित किया जाता है। इस कार्य में निम्नलिखित चरण सम्मिलित हैं।
चरण 1: अभिक्रिया के लिए असंतुलित समीकरण आयनिक रूप में लिखें:
$$\mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{Cr}^{3+}(\mathrm{aq}) \tag{8.50}$$
चरण 2: समीकरण को अर्ध-अभिक्रियाओं में विभाजित करें:
ऑक्सीकरण अर्ध:
$$\mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})$$
निर्वात अर्ध:
$$\mathrm{Cr}^{+6}{ } _{2} \mathrm{O} _{7}^{2-}(\mathrm{aq}) \rightarrow \mathrm{Cr}^{+3}(\mathrm{aq})$$
चरण 3: प्रत्येक अर्ध अभिक्रिया में $O$ और $\mathrm{H}$ के अतिरिक्त परमाणुओं को संतुलित करें। यहाँ ऑक्सीकरण अर्ध अभिक्रिया $\mathrm{Fe}$ परमाणुओं के संदर्भ में पहले से ही संतुलित है। निर्वात अर्ध अभिक्रिया के लिए, हम $\mathrm{Cr}^{3+}$ को 2 से गुणा करते हैं ताकि $\mathrm{Cr}$ परमाणु संतुलित हो जाएं।
$$\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq}) \tag{8.53}$$
चरण 4: अम्लीय माध्यम में होने वाली अभिक्रियाओं के लिए, $\mathrm{O}$ परमाणुओं को संतुलित करने के लिए $\mathrm{H_2} \mathrm{O}$ जोड़ें और $\mathrm{H}$ परमाणुओं को संतुलित करने के लिए $\mathrm{H}^{+}$ जोड़ें।
इस प्रकार, हमें प्राप्त होता है:
$$\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+7 \mathrm{H_2} \mathrm{O}(\mathrm{l})\tag{8.54}$$
चरण 5: आवेश को संतुलित करने के लिए अर्ध अभिक्रिया के एक पक्ष में इलेक्ट्रॉन जोड़ें। यदि आवश्यक हो, तो उपयुक्त संख्या में एक या दोनों अर्ध अभिक्रियाओं को गुणा करके दोनों अर्ध अभिक्रियाओं में इलेक्ट्रॉनों की संख्या को समान बनाएं।
इस प्रकार ऑक्सीकरण अर्ध अभिक्रिया को आवेश संतुलित करने के लिए पुनः लिखा गया है:
$$\mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{e}^{-} \tag{8.55}$$
अब अपचयन अर्ध अभिक्रिया में बायीं ओर कुल बारह धनात्मक आवेश हैं और दायीं ओर केवल छह धनात्मक आवेश हैं। इसलिए, हम बायीं ओर छह इलेक्ट्रॉन जोड़ते हैं।
$$ \begin{equation*} \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq})+6 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+ 7\mathrm{H_2O} \tag{8.56} \end{equation*} $$
दोनों अर्ध अभिक्रियाओं में इलेक्ट्रॉनों की संख्या को बराबर करने के लिए, हम ऑक्सीकरण अर्ध अभिक्रिया को 6 से गुणा करते हैं और इस प्रकार लिखते हैं:
$$6 \mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow 6 \mathrm{Fe}^{3+}(\mathrm{aq})+6 \mathrm{e}^{-} \tag{8.57}$$
चरण 6: हम दोनों अर्ध अभिक्रियाओं को जोड़कर समग्र अभिक्रिया प्राप्त करते हैं और प्रत्येक ओर के इलेक्ट्रॉनों को रद्द कर देते हैं। इससे निवल आयनिक समीकरण इस प्रकार प्राप्त होता है:
$$6 \mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 6 \mathrm{Fe}^{3+}(\mathrm{aq})+ 2 \mathrm{Cr}^{3+}(\mathrm{aq})+7 \mathrm{H_2} \mathrm{O}(\mathrm{l})$$
चरण 7: सत्यापित करें कि समीकरण में दोनों ओर एक ही प्रकार और संख्या के परमाणु तथा समान आवेश हैं। यह अंतिम जाँच बताती है कि समीकरण परमाणुओं की संख्या और आवेशों के सापेक्ष पूरी तरह संतुलित है।
क्षारीय माध्यम में अभिक्रिया के लिए, पहले परमाणुओं को संतुलित करें जैसा कि अम्लीय माध्यम में किया जाता है। फिर प्रत्येक $\mathrm{H}^{+}$आयन के लिए, समीकरण के दोनों ओर समान संख्या में $\mathrm{OH}^{-}$आयन जोड़ें। जहाँ समीकरण के एक ही पक्ष पर $\mathrm{H}^{+}$और $\mathrm{OH}^{-}$दिखाई दें, इन्हें मिलाकर $\mathrm{H_2} \mathrm{O}$ बनाएँ।
समस्या 8.10
परमैंगनेट(VII) आयन, $\mathrm{MnO_4}^{-}$क्षारीय विलयन में आयोडाइड आयन, $\mathrm{I}^{-}$को आण्विक आयोडीन $\left(\mathrm{I_2}\right)$ और मैंगनीज (IV) ऑक्साइड $\left(\mathrm{MnO_2}\right)$ बनाने के लिए ऑक्सीकृत करता है। इस रेडॉक्स अभिक्रिया को दर्शाने के लिए एक संतुलित आयनिक समीकरण लिखें।
हल
चरण 1: सबसे पहले हम अस्थायी आयनिक समीकरण लिखते हैं, जो है
$\mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+\mathrm{I_2}(\mathrm{~s})$
चरण 2: दो अर्ध-अभिक्रियाएँ हैं:
$$ \begin{aligned} & \text { ऑक्सीकरण अर्ध : } \stackrel{-1}{\mathrm{I^-}} \mathrm{(aq)} \rightarrow \stackrel{0}{\mathrm{I_3}}(\mathrm{s}) \end{aligned} $$
$$ \begin{aligned} & \text { अपचयन अर्ध : } \stackrel{+7}{\mathrm{Mn}} \mathrm{O_4}^{-}\mathrm{(aq)} \rightarrow \stackrel{+4}{\mathrm{Mn}} \mathrm{O_2}(\mathrm{s}) \end{aligned} $$
चरण 3: ऑक्सीकरण अर्ध अभिक्रिया में I परमाणुओं को संतुलित करने के लिए, हम इसे इस प्रकार पुनः लिखते हैं:
$$ 2 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{I_2}(\mathrm{~s}) $$
चरण 4: अपचयन अर्ध अभिक्रिया में $O$ परमाणुओं को संतुलित करने के लिए, हम दाईं ओर दो जल अणु जोड़ते हैं:
$\mathrm{MnO_4}^{-}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}$ (s) $+2 \mathrm{H_2} \mathrm{O}$ (l)
$\mathrm{H}$ परमाणुओं को संतुलित करने के लिए, हम बाईं ओर चार $\mathrm{H}^{+}$ आयन जोड़ते हैं:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O} \mathrm{(l)}$
चूँकि अभिक्रिया एक क्षारीय विलयन में होती है, इसलिए चार $\mathrm{H}^{+}$ आयनों के लिए हम समीकरण के दोनों ओर चार $\mathrm{OH}^{-}$ आयन जोड़ते हैं:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq})+4 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow\mathrm{MnO_2}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})+4 \mathrm{OH}^{-}(\mathrm{aq})$
$\mathrm{H}^{+}$ और $\mathrm{OH}^{-}$ आयनों को पानी से प्रतिस्थापित करने पर, परिणामी समीकरण है:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+4 \mathrm{OH}^{-}(\mathrm{aq})$
चरण 5 : इस चरण में हम दो अर्ध-अभिक्रियाओं के आवेशों को इस प्रकार संतुलित करते हैं:
$$ \begin{gathered} 2 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{I_2}(\mathrm{~s})+2 \mathrm{e}^{-} \\ \mathrm{MnO_4}^{-}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})+3 \mathrm{e}^{-} \rightarrow \mathrm{MnO_2}(\mathrm{~s}) +4 \mathrm{OH}^{-}(\mathrm{aq}) \end{gathered} $$
अब इलेक्ट्रॉनों की संख्या को समान करने के लिए, हम ऑक्सीकरण अर्ध-अभिक्रिया को 3 से और अपचयन अर्ध-अभिक्रिया को 2 से गुणा करते हैं।
$6 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow 3 \mathrm{I_2}$ (s) $+6 \mathrm{e}^{-}$
$2 \mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H_2} \mathrm{O}$ (l) $+6 \mathrm{e}^{-} \rightarrow 2 \mathrm{MnO_2}(\mathrm{~s})+8 \mathrm{OH}^{-}(\mathrm{aq})$
चरण 6: दोनों ओर से इलेक्ट्रॉनों को रद्द करने के बाद निवल अभिक्रिया प्राप्त करने के लिए दो अर्ध-अभिक्रियाओं को जोड़ें।
$6 \mathrm{I}^{-}(\mathrm{aq})+2 \mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow 3 \mathrm{I_2}(\mathrm{~s})+ 2 \mathrm{MnO_2}(\mathrm{~s})+8 \mathrm{OH}^{-}(\mathrm{aq})$
चरण 7: अंतिम सत्यापन दर्शाता है कि समीकरण दोनों ओर परमाणुओं की संख्या और आवेशों के संदर्भ में संतुलित है।
8.3.3 अनुमापन के आधार के रूप में रेडॉक्स अभिक्रियाएँ
अम्ल-क्षार प्रणालियों में हम एक pH संवेदी सूचक का उपयोग करके एक विलयन की दूसरे के विरुद्ध ताकत ज्ञात करने के लिए अनुमापन विधि से परिचित होते हैं। इसी प्रकार, रेडॉक्स प्रणालियों में एक रिडक्टेंट/ऑक्सिडेंट की ताकत निर्धारित करने के लिए रेडॉक्स संवेदी सूचक का उपयोग करके अनुमापन विधि अपनाई जा सकती है। रेडॉक्स अनुमापन में सूचकों के उपयोग को नीचे दर्शाया गया है:
(i) एक स्थिति में, स्वयं अभिकर्मक गहराई से रंगीन होता है, उदाहरण के लिए, परमैंगनेट आयन, $\mathrm{MnO_4}^{-}$। यहाँ $\mathrm{MnO_4}^{-}$स्वयं सूचक के रूप में कार्य करता है। इसमें दृश्य अंत बिंदु तब प्राप्त होता है जब अंतिम अपचायक $\left(\mathrm{Fe}^{2+}\right.$ या $\left.\mathrm{C_2} \mathrm{O_4}{ }^{2-}\right)$ का ऑक्सीकरण हो जाता है और $\mathrm{MnO_4}^{-}$की सान्द्रता $10^{-6} \mathrm{~mol} \mathrm{dm}^{-3}$ $\left(10^{-6} \mathrm{mol} \mathrm{L}^{-1}\right)$ जितनी कम होने पर भी एक स्थायी गुलाबी रंग की झलक प्रकट होती है। इससे यह सुनिश्चित होता है कि रंग समतुल्यता बिंदु से थोड़ा आगे निकलने पर भी न्यूनतम ‘अतिक्रमण’ होता है, वह बिंदु जहाँ अपचायक और ऑक्सीकारक अपने मोल स्टॉइकियोमेट्री के अनुसार बराबर होते हैं।
(ii) यदि कोई नाटकीय स्व-रंग परिवर्तन नहीं होता है (जैसा कि $\mathrm{MnO_4}^{-}$टाइट्रेशन में होता है), तो ऐसे सूचक होते हैं जो अभिकर्मक के अंतिम अंश के उपभोग के तुरंत बाद ऑक्सीकृत हो जाते हैं, जिससे एक नाटकीय रंग परिवर्तन उत्पन्न होता है। सबसे अच्छा उदाहरण $\mathrm{Cr_2} \mathrm{O_7}^{2-}$ द्वारा प्रदान किया जाता है, जो स्वयं सूचक नहीं है, लेकिन समतुल्यता बिंदु के ठीक बाद सूचक पदार्थ डाइफेनिलएमिन को ऑक्सीकृत कर एक गहरा नीला रंग उत्पन्न करता है, इस प्रकार अंत बिंदु को संकेतित करता है।
(iii) एक और विधि है जो रोचक और काफी सामान्य है। इसका उपयोग उन अभिकर्मकों तक सीमित है जो $\mathrm{I}^{-}$आयनों को ऑक्सीकृत करने में सक्षम होते हैं, उदाहरण के लिए,
$$\mathrm{Cu}(\mathrm{II}) : 2 \mathrm{Cu}^{2+}(\mathrm{aq})+4 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{Cu_2} \mathrm{I_2}(\mathrm{~s})+\mathrm{I_2}(\mathrm{aq}) \tag{8.59}$$
यह विधि इस तथ्य पर आधारित है कि आयोडीन स्वयं स्टार्च के साथ गहरा नीला रंग देता है और थायोसल्फेट आयनों $\left(\mathrm{S_2} \mathrm{O_3}{ }^{2-}\right)$ के साथ एक अत्यंत विशिष्ट अभिक्रिया करता है, जो कि एक रेडॉक अभिक्रिया भी है:
$$\mathrm{I_2}(\mathrm{aq})+2 \mathrm{~S_2} \mathrm{O_3}^{2-}(\mathrm{aq}) \rightarrow 2 \mathrm{I}^{-}(\mathrm{aq})+\mathrm{S_4} \mathrm{O_6}{ }^{2-}(\mathrm{aq}) \tag{8.60}$$
$\mathrm{I_2}$, यद्यपि पानी में अविलेय है, $\mathrm{KI}$ युक्त विलयन में $\mathrm{KI_3}$ के रूप में विलीन रहता है।
$\mathrm{Cu}^{2+}$ आयनों द्वारा आयोडाइड आयनों पर अभिक्रिया से आयोडीन के मुक्त होने के पश्चात स्टार्च मिलाने पर एक गहरा नीला रंग प्रकट होता है। यह रंग तुरंत गायब हो जाता है जैसे ही आयोडीन थायोसल्फेट आयनों द्वारा उपभोग लिया जाता है। इस प्रकार, अंत-बिंदु को आसानी से ट्रैक किया जा सकता है और शेष केवल स्टॉइकियोमेट्रिक गणना है।
8.3.4 ऑक्सीकरण संख्या की अवधारणा की सीमाएँ
जैसा कि आपने उपरोक्त चर्चा में देखा है, रेडॉक प्रक्रमों की अवधारणा समय के साथ विकसित होती रही है। यह विकास प्रक्रिया जारी है। वास्तव में, हाल ही में ऑक्सीकरण प्रक्रिया को इलेक्ट्रॉन घनत्व में कमी के रूप में और अपचयन प्रक्रिया को अभिक्रिया में संलग्न परमाणु(ओं) के चारों ओर इलेक्ट्रॉन घनत्व में वृद्धि के रूप में देखा जाता है।
8.4 रेडॉक अभिक्रियाएँ और इलेक्ट्रोड प्रक्रम
प्रतिक्रिया (8.15) से संबंधित प्रयोग तब भी देखा जा सकता है जब जिंक की छड़ को कॉपर सल्फेट विलयन में डुबोया जाता है। रेडॉक्स प्रतिक्रिया होती है और इस दौरान जिंक जिंक आयनों में ऑक्सीकृत हो जाता है और कॉपर आयन इलेक्ट्रॉनों के जिंक से सीधे कॉपर आयन में स्थानांतरण के कारण धातु कॉपर में अपचयित हो जाते हैं। इस प्रतिक्रिया के दौरान ऊष्मा भी निकलती है। अब हम प्रयोग को इस प्रकार संशोधित करते हैं कि समान रेडॉक्स प्रतिक्रिया के लिए इलेक्ट्रॉनों का स्थानांतरण अप्रत्यक्ष रूप से हो। इसके लिए जिंक धातु को कॉपर सल्फेट विलयन से अलग करना आवश्यक होता है। हम एक बीकर में कॉपर सल्फेट विलयन लेते हैं और उसमें कॉपर की पट्टी या छड़ डालते हैं। हम दूसरे बीकर में जिंक सल्फेट विलयन लेते हैं और उसमें जिंक की छड़ या पट्टी डालते हैं। अब प्रतिक्रिया किसी भी बीकर में नहीं होती और प्रत्येक बीकर में धातु और उसके लवण विलयन के अंतरापृष्ठ पर समान प्रजाति के अपचयित और ऑक्सीकृत दोनों रूप मौजूद होते हैं। ये ऑक्सीकरण और अपचयन अर्ध-प्रतिक्रियाओं में भाग ले रही प्रजातियों को दर्शाते हैं। रेडॉक्स युगल को इस प्रकार परिभाषित किया जाता है कि वह एक साथ ऑक्सीकरण या अपचयन अर्ध-प्रतिक्रिया में भाग ले रही किसी पदार्थ के ऑक्सीकृत और अपचयित रूपों को रखता है।
इसे ऑक्सीकृत रूप को अपचयित रूप से एक ऊर्ध्वाधर रेखा या स्लैश द्वारा अलग करके दर्शाया जाता है जो एक इंटरफेस (जैसे ठोस/विलयन) को दर्शाता है। उदाहरण के लिए इस प्रयोग में दो रेडॉक्स युग्मों को $\mathrm{Zn}^{2+} / \mathrm{Zn}$ और $\mathrm{Cu}^{2+} / \mathrm{Cu}$ के रूप में दर्शाया गया है। दोनों ही मामलों में ऑक्सीकृत रूप को अपचयित रूप से पहले रखा गया है।

चित्र 8.3 डेनियल सेल की व्यवस्था। ऐनोड पर Zn के ऑक्सीकरण के कारण उत्पन्न इलेक्ट्रॉन बाह्य परिपथ से होकर कैथोड तक जाते हैं जहाँ ये तांबे के आयनों को अपचयित करते हैं। सेल के अंदर परिपथ लवण सेतु के माध्यम से आयनों के प्रवास द्वारा पूर्ण होता है। यह ध्यान देने योग्य है कि धारा की दिशा इलेक्ट्रॉन प्रवाह की दिशा के विपरीत होती है।
अब हम कॉपर सल्फेट विलयन वाले बीकर और जिंक सल्फेट विलयन वाले बीकर को आमने-सामने रखते हैं (चित्र 7.3)। हम दोनों बीकरों के विलयनों को एक नमक पुल (सॉल्ट ब्रिज) से जोड़ते हैं—यह एक U-आकार की नली होती है जिसमें पोटैशियम क्लोराइड या अमोनियम नाइट्रेट का विलयन भरा होता है, जिसे आमतौर पर अगर-अगर के साथ उबालकर जेल जैसी ठोस अवस्था में ठंडा किया जाता है। यह दोनों विलयनों के बीच बिना उन्हें मिलाए विद्युत संपर्क प्रदान करता है। जिंक और कॉपर की छड़ों को एक धातु के तार से जोड़ा जाता है, जिसमें एक एमीटर और एक स्विच लगाने की व्यवस्था होती है। चित्र 7.3 में दिखाया गया यह पूरा सेट-अप डेनियल सेल के नाम से जाना जाता है। जब स्विक बंद (off) स्थिति में होता है, तो किसी भी बीकर में कोई अभिक्रिया नहीं होती और धातु के तार में कोई धारा प्रवाहित नहीं होती। जैसे ही स्विच चालू (on) किया जाता है, हम निम्नलिखित प्रेक्षण करते हैं:
1. अब इलेक्ट्रॉनों का स्थानांतरण सीधे $\mathrm{Zn}$ से $\mathrm{Cu}^{2+}$ तक नहीं होता, बल्कि दोनों छड़ों को जोड़ने वाले धातु के तार के माध्यम से होता है, जैसा कि तीर से स्पष्ट है जो धारा के प्रवाह को दर्शाता है।
2. एक बीकर के विलयन से दूसरे बीकर के विलयन तक विद्युत प्रवाह आयनों के नमक पुल के माध्यम से प्रवास करके होता है। हम जानते हैं कि धारा का प्रवाह तभी संभव है जब कॉपर और जिंक की छड़ों—जिन्हें यहाँ इलेक्ट्रोड कहा जाता है—के बीच विभव अंतर हो।
प्रत्येक इलेक्ट्रोड से जुड़ी विभव को इलेक्ट्रोड विभव कहा जाता है। यदि इलेक्ट्रोड अभिक्रिया में भाग लेने वाली प्रत्येक प्रजाति की सांद्रता इकाई है (यदि कोई गैस इलेक्ट्रोड अभिक्रिया में दिखाई देती है, तो वह 1 वायुमंडलीय दबाव पर सीमित है) और आगे अभिक्रिया $298 \mathrm{~K}$ पर की जाती है, तो प्रत्येक इलेक्ट्रोड के विभव को मानक इलेक्ट्रोड विभव कहा जाता है। परंपरा से, हाइड्रोजन इलेक्ट्रोड का मानक इलेक्ट्रोड विभव $\left(\mathrm{E}^{\ominus}\right)$ 0.00 वोल्ट है। प्रत्येक इलेक्ट्रोड प्रक्रिया के लिए इलेक्ट्रोड विभव का मान इस प्रक्रिया में सक्रिय प्रजातियों के ऑक्सीकृत/अपचयित रूप में बने रहने की सापेक्ष प्रवृत्ति का माप है। एक ऋणात्मक $\mathrm{E}^{\ominus}$ का अर्थ है कि रेडॉक्स युग्म $\mathrm{H}^{+} / \mathrm{H_2}$ युग्म की तुलना में एक मजबूत अपचायक है। एक धनात्मक $\mathrm{E}^{\ominus}$ का अर्थ है कि रेडॉक्स युग्म $\mathrm{H}^{+} / \mathrm{H_2}$ युग्म की तुलना में एक कमजोर अपचायक है। मानक इलेक्ट्रोड विभव बहुत महत्वपूर्ण हैं और हम उनसे बहुत सी अन्य उपयोगी जानकारी प्राप्त कर सकते हैं। कुछ चयनित इलेक्ट्रोड प्रक्रियाओं (अपचयन अभिक्रियाओं) के लिए मानक इलेक्ट्रोड विभव के मान टेबल 8.1 में दिए गए हैं। आप कक्षा बारहवीं में इलेक्ट्रोड अभिक्रियाओं और सेलों के बारे में अधिक जानेंगे।
टेबल 7.1 298 K पर मानक इलेक्ट्रोड विभव
आयन जलीय प्रजातियों के रूप में उपस्थित हैं और $H_2O$ द्रव के रूप में; गैसों और ठोसों को क्रमशः g और s द्वारा दर्शाया गया है।

-
एक ऋणात्मक E⁰ का अर्थ है कि रेडॉक्स युग्म, $ H^{+} / H_2 $ युग्म की तुलना में एक प्रबल अपचायक है।
-
एक धनात्मक E⁰ का अर्थ है कि रेडॉक्स युग्म, $H^{+} / H_2 $ युग्म की तुलना में एक दुर्बल अपचायक है।
सारांश
रेडॉक्स अभिक्रियाएँ एक महत्वपूर्ण वर्ग की अभिक्रियाएँ हैं जिनमें ऑक्सीकरण और अपचयन एक साथ होते हैं। तीन स्तरीय संकल्पना—पारंपरिक, इलेक्ट्रॉनिक और ऑक्सीकरण संख्या—जो सामान्यतः पाठ्यपुस्तकों में उपलब्ध होती है, को विस्तार से प्रस्तुत किया गया है। ऑक्सीकरण, अपचयन, ऑक्सीकारक (ऑक्सीडेंट) और अपचायक (रिडक्टेंट) को प्रत्येक संकल्पना के अनुसार देखा गया है। ऑक्सीकरण संख्याएँ एक सुसंगत नियमों के समुच्चय के अनुसार निर्धारित की जाती हैं। ऑक्सीकरण संख्या और आयन-इलेक्ट्रॉन विधि दोनों ही रेडॉक्स अभिक्रियाओं के समीकरण लिखने में उपयोगी साधन हैं। रेडॉक्स अभिक्रियाओं को चार श्रेणियों में वर्गीकृत किया गया है: संयोजन, वियोजन, विस्थापन और विषमानुपातन अभिक्रियाएँ। यहाँ रेडॉक्स युग्म और इलेक्ट्रोड प्रक्रम की संकल्पना प्रस्तुत की गई है। रेडॉक्स अभिक्रियाएँ इलेक्ट्रोड प्रक्रमों और सेलों के अध्ययन में व्यापक अनुप्रयोग पाती हैं।



