यूनिट 12 एल्डिहाइड, कीटोन और कार्बोक्सिलिक एसिड
Subject Hub
सामान्य Learning Resources
कार्बोनिल यौगिक कार्बनिक रसायन के लिए अत्यंत महत्वपूर्ण हैं। ये कपड़ों, स्वाद-योजकों, प्लास्टिक और दवाओं के घटक होते हैं।
पिछली इकाई में आपने कार्बन-ऑक्सीजन एकल बंध वाले क्रियात्मक समूहों वाले कार्बनिक यौगिकों का अध्ययन किया है। इस इकाई में हम उन कार्बनिक यौगिकों के बारे में पढ़ेंगे जिनमें कार्बन-ऑक्सीजन द्विबंध ( $>\mathrm{C}=\mathrm{O}$ ) होता है, जिसे कार्बोनिल समूह कहा जाता है और यह कार्बनिक रसायन का सबसे महत्वपूर्ण क्रियात्मक समूहों में से एक है।
ऐल्डिहाइडों में कार्बोनिल समूह एक कार्बन और हाइड्रोजन से बंधित होता है जबकि कीटोनों में यह दो कार्बन परमाणुओं से बंधित होता है। कार्बोनिल यौगिक जिनमें कार्बोनिल समूह का कार्बन कार्बन या हाइड्रोजन और हाइड्रॉक्सिल खंड (-OH) के ऑक्सीजन से बंधित होता है, उन्हें कार्बोक्सिलिक अम्ल कहा जाता है, जबकि यौगिक जहां कार्बन कार्बन या हाइड्रोजन और $-\mathrm{NH}_{2}$ खंड के नाइट्रोजन से या हैलोजन से बंधित होता है, उन्हें क्रमशः एमाइड और एसिल हैलाइड कहा जाता है। एस्टर और एनहाइड्राइड कार्बोक्सिलिक अम्ल के व्युत्पन्न होते हैं। इन यौगिकों वर्गों के सामान्य सूत्र नीचे दिए गए हैं:

एल्डिहाइड, कीटोन और कार्बोक्सिलिक अम्ल पौधों और जंतु जगत में व्यापक रूप से पाए जाते हैं। ये जीवन की जैव रासायनिक प्रक्रियाओं में महत्वपूर्ण भूमिका निभाते हैं। ये प्रकृति में सुगंध और स्वाद जोड़ते हैं, उदाहरण के लिए, वैनिलिन (वेनिला बीन से), सैलिसिलैल्डिहाइड (मीडो स्वीट से) और सिनामैल्डिहाइड (दालचीनी से) में बहुत सुगंध होती है।

इनका उपयोग कई खाद्य उत्पादों और फार्मास्यूटिकल्स में स्वाद जोड़ने के लिए किया जाता है। इन परिवारों में से कुछ को सॉल्वैंट्स (जैसे कि एसीटोन) के रूप में उपयोग करने और चिपकाने वाले पदार्थ, पेंट, रेजिन, इत्र, प्लास्टिक, कपड़े आदि जैसी सामग्रियों को तैयार करने के लिए बनाया जाता है।
12.1 कार्बोनिल समूह की नामकरण और संरचना
12.1.1 नामकरण
I. एल्डिहाइड और कीटोन
एल्डिहाइड और कीटोन सबसे सरल और सबसे महत्वपूर्ण कार्बोनिल यौगिक हैं। एल्डिहाइड और कीटोन के नामकरण की दो प्रणालियाँ हैं।
(a) सामान्य नाम
एल्डिहाइड और कीटोन को अक्सर उनके IUPAC नामों के बजाय सामान्य नामों से पुकारा जाता है। अधिकांश एल्डिहाइड के सामान्य नाम संगत कार्बोक्सिलिक अम्लों के सामान्य नामों [अनुभाग 12.6.1] से -ic अंत को एल्डिहाइड से बदलकर बनाए जाते हैं। साथ ही, नाम अम्ल या एल्डिहाइड के मूल स्रोत के लिए लैटिन या ग्रीक शब्द को दर्शाते हैं। कार्बन श्रृंखला में प्रतिस्थापन का स्थान ग्रीक अक्षरों $\alpha, \beta, \gamma, \delta$, आदि द्वारा दर्शाया जाता है। $\alpha$-कार्बन वह होता है जो सीधे एल्डिहाइड समूह से जुड़ा होता है, $\beta$ कार्बन अगला होता है, और इसी तरह। उदाहरण के लिए

कीटोन के सामान्य नाम कार्बोनिल समूह से बंधे दो एल्किल या एरिल समूहों के नाम रखकर बनाए जाते हैं। प्रतिस्थापनों के स्थानों को ग्रीक अक्षरों $\alpha \alpha^{\prime}, \beta \beta^{\prime}$ और इसी तरह कार्बोनिल समूह के बगल वाले कार्बन परमाणुओं से शुरू करके दर्शाया जाता है, जिन्हें $\alpha \alpha^{\prime}$ के रूप में दर्शाया जाता है। कुछ कीटोन के ऐतिहासिक सामान्य नाम होते हैं, सबसे सरल डाइमेथिल कीटोन को एसीटोन कहा जाता है। एल्किल फेनिल कीटोन को आमतौर पर एसिल समूह का नाम फेनोन शब्द से पहले जोड़कर रखा जाता है। उदाहरण के लिए

(b) IUPAC नाम
खुली श्रृंखला वाले ऐलिफैटिक ऐल्डिहाइड और कीटोन के IUPAC नाम संबंधित एल्केन के नाम से प्राप्त किए जाते हैं, जिसमें अंतिम –e को क्रमशः –al और –one से प्रतिस्थापित किया जाता है। ऐल्डिहाइड के मामले में सबसे लंबी कार्बन श्रृंखला की गिनती ऐल्डिहाइड समूह के कार्बन से शुरू की जाती है, जबकि कीटोन के मामले में गिनती कार्बोनिल समूह के निकटतम सिरे से शुरू होती है। प्रतिस्थापी समूहों को वर्णानुक्रम में उपसर्ग के रूप में लगाया जाता है, साथ ही उनकी स्थिति दर्शाने वाली संख्याएं भी दी जाती हैं। यही नियम चक्रीय कीटोनों पर भी लागू होता है, जहां कार्बोनिल कार्बन को एक नंबर दिया जाता है। जब ऐल्डिहाइड समूह किसी वलय से जुड़ा होता है, तो चक्रएल्केन के पूरे नाम के बाद carbaldehyde प्रत्यय जोड़ा जाता है। वलय के कार्बन परमाणुओं की गिनती उस कार्बन परमाणु से शुरू होती है जो ऐल्डिहाइड समूह से जुड़ा होता है। सबसे सरल एरोमैटिक ऐल्डिहाइड, जिसमें ऐल्डिहाइड समूह बेंजीन वलय पर होता है, का नाम बेंजीनकार्बैल्डिहाइड है। हालांकि, सामान्य नाम बेंजैल्डिहाइड को भी IUPAC द्वारा स्वीकार किया जाता है। अन्य एरोमैटिक ऐल्डिहाइडों को प्रतिस्थापित बेंजैल्डिहाइड के रूप में नामित किया जाता है।

कुछ ऐल्डिहाइड और कीटोन के सामान्य और IUPAC नाम टेबल 12.1 में दिए गए हैं।
टेबल 12.1: कुछ ऐल्डिहाइड और कीटोन के सामान्य और IUPAC नाम

12.1.2 कार्बोनिल समूह की संरचना
कार्बोनिल कार्बन परमाणु $s p^{2}$-संकरित होता है और तीन सिग्मा ($\sigma$) बंध बनाता है। कार्बन का चौथा संयोजक इलेक्ट्रॉन इसकी $p$-कक्षक में रहता है और ऑक्सीजन के $p$-कक्षक के साथ अतिव्यापन करके ऑक्सीजन के साथ एक $\pi$-बंध बनाता है। इसके अतिरिक्त, ऑक्सीजन परमाणु के पास दो असंयोजक इलेक्ट्रॉन युग्म भी होते हैं। इस प्रकार, कार्बोनिल कार्बन और उससे जुड़े तीन परमाणु एक ही तल में होते हैं और $\pi$-इलेक्ट्रॉन बादल इस तल के ऊपर और नीचे होता है। बंध कोण लगभग $120^{\circ}$ होते हैं, जैसा कि त्रिकोणीय समतलीय संरचना से अपेक्षित होता है (चित्र 12.1)।

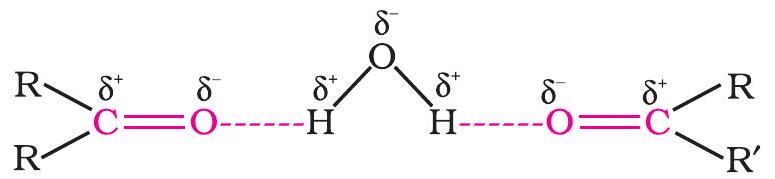
कार्बन-ऑक्सीजन द्विबंध ऑक्सीजन की कार्बन की तुलना में अधिक विद्युतऋणता के कारण ध्रुवित होता है। इसलिए, कार्बोनिल कार्बन एक इलेक्ट्रॉनस्नेही (लुइस अम्ल) होता है, और कार्बोनिल ऑक्सीजन एक न्यूक्लियोस्नेही (लुइस क्षारक) केंद्र होता है। कार्बोनिल यौगिकों में पर्याप्त द्विध्रुव आघूर्ण होते हैं और ये ईथरों की तुलना में अधिक ध्रुवी होते हैं। कार्बोनिल समूह की उच्च ध्रुवता को एक उदासीन (A) और एक द्विध्रुवीय (B) संरचना के अनुनाद के आधार पर समझाया गया है जैसा कि दिखाया गया है।
12.2 एल्डिहाइड और कीटोन की तैयारी
एल्डिहाइड और कीटोन की तैयार की जाने वाली कुछ महत्वपूर्ण विधियाँ इस प्रकार हैं:
12.2.1 एल्डिहाइड और कीटोन की तैयारी
1. एल्कोहलों के ऑक्सीकरण द्वारा
एल्डिहाइड और कीटोन सामान्यतः प्राथमिक और द्वितीयक एल्कोहलों के क्रमशः ऑक्सीकरण द्वारा तैयार किए जाते हैं (इकाई 11, कक्षा XII)।
2. एल्कोहलों के डिहाइड्रोजनीकरण द्वारा
यह विधि वाष्पशील एल्कोहलों के लिए उपयुक्त है और औद्योगिक अनुप्रयोग की है। इस विधि में एल्कोहल के वाष्प को भारी धातु उत्प्रेरकों $(\mathrm{Ag}$ या $\mathrm{Cu})$ पर प्रवाहित किया जाता है। प्राथमिक और द्वितीयक एल्कोहल क्रमशः ऐल्डिहाइड और कीटोन देते हैं (इकाई 11, कक्षा बारहवीं)।
3. हाइड्रोकार्बनों से
(i) एल्कीनों की ओज़ोनोलिसिस द्वारा: जैसा कि हम जानते हैं, एल्कीनों की ओज़ोनोलिसिस के बाद जिंक धूल और पानी के साथ अभिक्रिया करने पर ऐल्डिहाइड, कीटोन या दोनों का मिश्रण प्राप्त होता है, जो एल्कीन के प्रतिस्थापन प्रतिरूप पर निर्भर करता है (इकाई 13, कक्षा ग्यारहवीं)।
(ii) एल्काइनों की हाइड्रेशन द्वारा: एथाइन में $\mathrm{H_2} \mathrm{SO_4}$ और $\mathrm{HgSO_4}$ की उपस्थिति में पानी का योग करने पर एसिटैल्डिहाइड प्राप्त होता है। इस अभिक्रिया में अन्य सभी एल्काइन कीटोन देते हैं (इकाई 13, कक्षा ग्यारहवीं)।
12.2.2 ऐल्डिहाइडों की तैयारी
1. एसिल क्लोराइड (एसिड क्लोराइड) से
एसिल क्लोराइड (एसिड क्लोराइड) को बेरियम सल्फेट पर पैलेडियम उत्प्रेरक के साथ हाइड्रोजनीकृत किया जाता है। इस अभिक्रिया को रोज़ेनमंड अपचयन कहा जाता है।

2. नाइट्राइलों और एस्टरों से
नाइट्राइलों को हाइड्रोक्लोरिक एसिड की उपस्थिति में स्टैनस क्लोराइड के साथ अपचयित करने पर संगत इमीन प्राप्त होता है, जो जल अपघटन पर संगत ऐल्डिहाइड देता है।
इस अभिक्रिया को स्टीफन अभिक्रिया कहा जाता है।
वैकल्पिक रूप से, नाइट्राइलों को डाइआइसोब्यूटिलएल्यूमिनियम हाइड्राइड, (DIBAL-H) द्वारा चयनात्मक रूप से इमीनों में अपचयित किया जाता है, जो जल अपघटन पर ऐल्डिहाइड देते हैं:

इसी प्रकार, एस्टर भी DIBAL-H से अल्डिहाइड में अपचयित होते हैं।

3. हाइड्रोकार्बन से
एरोमैटिक अल्डिहाइड (बेंज़ैल्डिहाइड और इसके व्युत्पन्न) निम्नलिखित विधियों द्वारा एरोमैटिक हाइड्रोकार्बन से तैयार किए जाते हैं:
(i) मेथिलबेंज़ीन के ऑक्सीकरण द्वारा
प्रबल ऑक्सीकारक एजेंट टॉलूईन और इसके व्युत्पन्नों को बेंज़ोइक अम्लों में ऑक्सीकृत करते हैं। हालांकि, उपयुक्त अभिकर्मकों के साथ ऑक्सीकरण को अल्डिहाइड स्तर पर रोकना संभव है जो मेथिल समूह को एक ऐसे मध्यवर्ती में परिवर्तित करते हैं जिसे आगे ऑक्सीकृत करना कठिन होता है। इस उद्देश्य के लिए निम्नलिखित विधियाँ प्रयोग की जाती हैं।
(a) क्रोमिल क्लोराइड (\left(\mathrm{CrO_2} \mathrm{Cl_2}\right)) का प्रयोग : क्रोमिल क्लोराइड मेथिल समूह को एक क्रोमियम संकुल में ऑक्सीकृत करता है, जो जलअपघटन पर संगत बेंज़ैल्डिहाइड देता है।

इस अभिक्रिया को एटार्ड अभिक्रिया कहा जाता है।
(b) क्रोमिक ऑक्साइड (\left(\mathrm{CrO_3}\right)) का प्रयोग : टॉलूईन या प्रतिस्थापित टॉलूईन को ऐसीटिक ऐनहाइड्राइड में क्रोमिक ऑक्साइड के साथ उपचारित करने पर बेंज़िलिडीन डाइऐसीटेट में परिवर्तित किया जाता है। बेंज़िलिडीन डाइऐसीटेट को जलीय अम्ल के साथ जलअपघटित कर संगत बेंज़ैल्डिहाइड प्राप्त किया जा सकता है।

(ii) साइड चेन क्लोरिनेशन के बाद हाइड्रोलिसिस द्वारा
टॉलूईन का साइड चेन क्लोरिनेशन बेंज़ल क्लोराइड देता है, जो हाइड्रोलिसिस पर बेंज़ैल्डिहाइड देता है। यह बेंज़ैल्डिहाइड के निर्माण की एक वाणिज्यिक विधि है।

(iii) गैटरमैन-कोच अभिक्रिया द्वारा
जब बेंज़ीन या इसका व्युत्पन्न कार्बन मोनोऑक्साइड और हाइड्रोजन क्लोराइड के साथ बिना पानी वाले एल्युमिनियम क्लोराइड या क्युप्रस क्लोराइड की उपस्थिति में उपचारित किया जाता है, तो यह बेंज़ैल्डिहाइड या प्रतिस्थापित बेंज़ैल्डिहाइड देता है।

12.2.3 कीटोन की तैयारी
1. एसिल क्लोराइड से
एसिल क्लोराइड्स का डाइऐल्किलकैडमियम के साथ उपचार, जो कि कैडमियम क्लोराइड और ग्रिग्नार्ड रिएजेंट की अभिक्रिया द्वारा तैयार किया जाता है, कीटोन देता है।
$$ \begin{aligned} & 2 \mathrm{R}-\mathrm{Mg}-\mathrm{X}+\mathrm{CdCl_2} \longrightarrow \mathrm{R_2} \mathrm{Cd}+2 \mathrm{Mg}(\mathrm{X}) \mathrm{Cl} \end{aligned} $$
$$ \mathrm{2R^\prime}-\underset{\large\mathrm{O}}{\underset{\text{||}}{\mathrm{C}}} - \mathrm{Cl} + \mathrm{R_2Cd} \longrightarrow \mathrm{2R^\prime}-\underset{\large\mathrm{O}}{\underset{\text{||}}{\mathrm{C}}} - \mathrm{R} + \mathrm{CdCl_2} $$
2. नाइट्राइल से
नाइट्राइल को ग्रिग्नार्ड अभिकर्मक के साथ उपचारित करने के बाद जल-अपघटन करने पर एक कीटोन प्राप्त होता है।

3. बेंजीन या प्रतिस्थापित बेंजीन से
जब बेंजीन या प्रतिस्थापित बेंजीन को अनहाइड्रस एल्युमिनियम क्लोराइड की उपस्थिति में एसिड क्लोराइड के साथ उपचारित किया जाता है, तो यह संगत कीटोन देता है। इस अभिक्रिया को फ्राइडेल-क्राफ्ट्स एसिलीकरण अभिक्रिया कहा जाता है।

उदाहरण 12.1 निम्न रूपांतरणों को करने के लिए प्रयुक्त अभिकर्मकों के नाम दीजिए:
(i) हेक्सेन-1-ऑल से हेक्सेनल
(ii) साइक्लोहेक्सानॉल से साइक्लोहेक्सानोन
(iii) $p$-फ्लोरोटॉलूईन से
(iv) एथेननाइट्राइल से एथेनल $p$-फ्लोरोबेंज़ैल्डिहाइड
(v) एलिल अल्कोहल से प्रोपेनल
(vi) ब्यूट-2-ईन से एथेनल
हल
(i) $\mathrm{C_5} \mathrm{H_5} \mathrm{NH}^{+} \mathrm{CrO_3} \mathrm{Cl}-(\mathrm{PCC})$
(ii) अनहाइड्रस $\mathrm{CrO_3}$
(iii) $\mathrm{CrO_3}$ एसेटिक एनहाइड्राइड की उपस्थिति में/
(iv) (डाइआइसोब्यूटिल)एल्युमिनियम 1.$\mathrm{CrO_2} \mathrm{Cl_2}$ 2. $\mathrm{HOH}$
(v) PCC हाइड्राइड (DIBAL-H)
(vi) $\mathrm{O_3} / \mathrm{H_2} \mathrm{O}-\mathrm{Zn}$ धूल
12.3 भौतिक गुण
एल्डिहाइड्स और कीटोन्स के भौतिक गुण इस प्रकार वर्णित हैं।
मेथेनल कमरे के तापमान पर एक गैस होता है।
एथेनल एक वाष्पशील द्रव होता है।
अन्य एल्डिहाइड्स और कीटोन्स कमरे के तापमान पर द्रव या ठोस होते हैं।
एल्डिहाइड्स और कीटोन्स के क्वथनांक समान आण्विक द्रव्यमान वाले हाइड्रोकार्बन और ईथरों की तुलना में अधिक होते हैं।
यह एल्डिहाइड्स और कीटोन्स में द्विध्रुव-द्विध्रुव अन्योन्यक्रियाओं के कारण उत्पन्न होने वाले दुर्बल आण्विक संघटन के कारण होता है।
इसके अतिरिक्त, इनके क्वथनांक समान आण्विक द्रव्यमान वाले एल्कोहलों की तुलना में कम होते हैं क्योंकि इनमें अंतराअणु हाइड्रोजन बंधन की अनुपस्थिति होती है।
आण्विक द्रव्यमान 58 और 60 वाले निम्नलिखित यौगिकों को बढ़ते हुए क्वथनांक के क्रम में व्यवस्थित किया गया है।
| b.p.(K) | आण्विक द्रव्यमान | |
|---|---|---|
| n-ब्यूटेन | 273 | 58 |
| मेथॉक्सीएथेन | 281 | 60 |
| प्रोपेनल | 322 | 58 |
| एसीटोन | 329 | 58 |
| प्रोपेन-1-ऑल | 370 | 60 |
एल्डिहाइड्स और कीटोन्स के निचले सदस्य जैसे मेथेनल, एथेनल और प्रोपेनोन सभी अनुपातों में पानी में मिश्रणीय होते हैं, क्योंकि ये पानी के साथ हाइड्रोजन बंध बनाते हैं।
हालांकि, एल्किल श्रृंखला की लंबाई बढ़ाने पर एल्डिहाइडों और कीटोनों की विलेयता तेजी से घट जाती है। सभी एल्डिहाइड और कीटोन बेंजीन, ईथर, मेथानॉल, क्लोरोफॉर्म आदि जैसे कार्बनिक विलायकों में काफी विलेय होते हैं। निचले एल्डिहाइडों में तीखी सुगंध होती है। जैसे-जैसे अणु का आकार बढ़ता है, सुगंध कम तीखी और अधिक सुगंधित हो जाती है। वास्तव में, कई प्राकृतिक रूप से पाए जाने वाले एल्डिहाइड और कीटोन इत्र और स्वाद बनाने वाले एजेंटों के मिश्रण में उपयोग किए जाते हैं।
उदाहरण 12.2
निम्नलिखित यौगिकों को उनके क्वथनांक के बढ़ते क्रम में व्यवस्थित कीजिए:
$\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CHO}, \mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_2} \mathrm{OH}, \mathrm{H_5} \mathrm{C_2}-\mathrm{O}-\mathrm{C_2} \mathrm{H_5}, \mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_3}$
हल इन यौगिकों के आण्विक द्रव्यमान 72 से 74 की सीमा में हैं। चूंकि केवल ब्यूटेन-1-ओल के अणु व्यापक अंतर-अणु हाइड्रोजन बंधन के कारण संबद्ध होते हैं, इसलिए ब्यूटेन-1-ओल का क्वथनांक सबसे अधिक होगा। ब्यूटेनल एथॉक्सीएथेन की तुलना में अधिक ध्रुवीय है। इसलिए, पूर्व में अंतर-अणु द्विध्रुव-द्विध्रुव आकर्षण अधिक मजबूत है। $n$-पेंटेन के अणुओं में केवल कमजोर वान डेर वाल्स बल होते हैं। इसलिए दिए गए यौगिकों के क्वथनांक का बढ़ता क्रम इस प्रकार है:
$\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_3}<\mathrm{H_5} \mathrm{C_2}-\mathrm{O}-\mathrm{C_2} \mathrm{H_5}<\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CHO}<\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_2} \mathrm{OH}$
12.4 रासायनिक अभिक्रियाएँ
चूँकि ऐल्डिहाइड और कीटोन दोनों में कार्बोनिल कार्यात्मक समूह होता है, वे समान रासायनिक अभिक्रियाएँ करते हैं।
1. न्यूक्लियोफिलिक योग अभिक्रियाएँ
ऐल्कीनों में देखी जाने वाली इलेक्ट्रोफिलिक योग अभिक्रियाओं (इकाई 13, कक्षा XI देखें) के विपरीत, ऐल्डिहाइड और कीटोन न्यूक्लियोफिलिक योग अभिक्रियाएँ करते हैं।
(i) न्यूक्लियोफिलिक योग अभिक्रियाओं की क्रियाविधि
एक न्यूक्लियोफाइल ध्रुवीय कार्बोनिल समूह के इलेक्ट्रोफिलिक कार्बन पर उस दिशा से आक्रमण करता है जो कार्बोनिल कार्बन के $s p^{2}$ संकरित कक्षकों के तल के लगभग लंबवत होती है (चित्र 12.2)। इस प्रक्रिया में कार्बन का संकरण $s p^{2}$ से $s p^{3}$ में बदल जाता है, और एक चतुष्फलकीय ऐल्कॉक्साइड मध्यवर्ती उत्पन्न होता है। यह मध्यवर्ती अभिक्रिया माध्यम से एक प्रोटॉन ग्रहण कर विद्युत-तटस्थ उत्पाद देता है। कुल परिणाम यह है कि कार्बन-ऑक्सीजन द्विबंध पर $\mathrm{Nu}^{-}$ और $\mathrm{H}^{+}$ का योग होता है जैसा कि चित्र 12.2 में दिखाया गया है।

चित्र 12.2: कार्बोनिल कार्बन पर न्यूक्लियोफिलिक आक्रमण
(ii) क्रियाशीलता
एल्डिहाइड्स नाभिकस्नेही योगात्मक अभिक्रियाओं में कीटोनों की तुलना में आमतौर पर अधिक सक्रिय होते हैं, जो आकृति विज्ञान और इलेक्ट्रॉनिक कारणों से होता है। आकृति विज्ञान की दृष्टि से, कीटोनों में दो अपेक्षाकृत बड़े प्रतिस्थापक होते हैं जो नाभिकस्नेही के कार्बोनिल कार्बन तक पहुँचने में बाधा डालते हैं, जबकि एल्डिहाइड्स में केवल एक ऐसा प्रतिस्थापक होता है। इलेक्ट्रॉनिक रूप से, एल्डिहाइड्स कीटोनों की तुलना में अधिक सक्रिय होते हैं क्योंकि दो एल्किल समूह कार्बोनिल कार्बन की इलेक्ट्रॉनलोभिता को पूर्ववर्ती की तुलना में अधिक प्रभावी रूप से कम करते हैं।
उदाहरण 12.3 क्या आप उम्मीद करेंगे कि बेंज़ैल्डिहाइड नाभिकस्नेही योगात्मक अभिक्रियाओं में प्रोपेनल की तुलना में अधिक सक्रिय होगा या कम सक्रिय? अपने उत्तर की व्याख्या कीजिए।
हल बेंज़ैल्डिहाइड के कार्बोनिल समूह का कार्बन परमाणु प्रोपेनल में उपस्थित कार्बोनिल समूह के कार्बन परमाणु की तुलना में कम इलेक्ट्रॉनलोभी होता है। बेंज़ैल्डिहाइड में कार्बोनिल समूह की ध्रुवता नीचे दिखाए अनुसार अनुनाद के कारण कम हो जाती है और इसलिए यह प्रोपेनल की तुलना में कम सक्रिय है।
(iii) नाभिकस्नेही योगात्मक और नाभिकस्नेही योगात्मक-विलोपन अभिक्रियाओं के कुछ महत्वपूर्ण उदाहरण:
(क) हाइड्रोजन सायनाइड (HCN) का योग: ऐल्डिहाइड और कीटोन हाइड्रोजन सायनाइड (HCN) के साथ अभिक्रिया करके सायनोहाइड्रिन देते हैं। यह अभिक्रिया शुद्ध HCN के साथ बहुत धीमे होती है। इसलिए इसे एक क्षार द्वारा उत्प्रेरित किया जाता है और उत्पन्न सायनाइड आयन (CN⁻) एक प्रबल न्यूक्लोफाइल होने के कारण कार्बोनिल यौगिकों में सरलता से योग होकर संगत सायनोहाइड्रिन देता है। सायनोहाइड्रिन उपयोगी संश्लेषण मध्यवर्ती होते हैं।

(ख) सोडियम हाइड्रोजनसल्फाइट का योग: सोडियम हाइड्रोजनसल्फाइट ऐल्डिहाइड और कीटोनों में योग होकर योगज उत्पाद बनाता है।
साम्य की स्थिति अधिकांश ऐल्डिहाइडों के लिए दाहिनी ओर तथा अधिकांश कीटोनों के लिए बाईं ओर होती है, जो स्टेरिक कारणों से होता है। हाइड्रोजनसल्फाइट योग यौगिक जल में विलेय होता है और इसे तनु खनिज अम्ल या क्षार के साथ उपचारित करके पुनः मूल कार्बोनिल यौगिक में परिवर्तित किया जा सकता है। इसलिए ये ऐल्डिहाइडों के पृथक्करण और शुद्धीकरण के लिए उपयोगी होते हैं।

(ग) ग्रिग्नार्ड अभिकर्मक का योग: (इकाई 11, कक्षा XII देखें)।
(द) एल्कोहलों का योग: ऐल्डिहाइड एक समतुल्य मोनोहाइड्रिक एल्कोहल के साथ सूखे हाइड्रोजन क्लोराइड की उपस्थिति में अभिक्रिया करके एक अल्कॉक्सीऐल्कोहल मध्यवर्ती उत्पन्न करते हैं, जिसे हेमीऐसिटल कहा जाता है, जो आगे एक और एल्कोहल अणु के साथ अभिक्रिया करके एक जेम-डाइअल्कॉक्सी यौगिक बनाता है जिसे ऐसिटल कहा जाता है जैसा कि अभिक्रिया में दिखाया गया है।

कीटोन समान परिस्थितियों में एथिलीन ग्लाइकोल के साथ अभिक्रिया करके चक्रीय उत्पाद बनाते हैं जिन्हें एथिलीन ग्लाइकोल कीटल्स कहा जाता है।
सूखा हाइड्रोजन क्लोराइड कार्बोनिल यौगिकों की ऑक्सीजन को प्रोटोनेट करता है और इसलिए कार्बोनिल कार्बन की इलेक्ट्रॉनिकता बढ़ाता है जो एथिलीन ग्लाइकोल के न्यूक्लियोफिलिक आक्रमण को सरल बनाता है। ऐसिटल और कीटल जलीय खनिज अम्लों से हाइड्रोलिस होकर क्रमशः संगत ऐल्डिहाइड और कीटोन देते हैं।
(ए) अमोनिया और इसके व्युत्पन्नों का योग: न्यूक्लियोफाइल, जैसे कि अमोनिया और इसके व्युत्पन्न $\mathrm{H_2} \mathrm{~N}-\mathrm{Z}$ ऐल्डिहाइड और कीटोनों के कार्बोनिल समूह में योग करते हैं। अभिक्रिया उत्क्रमणीय है और अम्ल द्वारा उत्प्रेरित होती है।

$$ \mathrm{Z}=\text { अल्किल, ऐरिल, } \mathrm{OH}, \mathrm{NH_2}, \mathrm{C_6} \mathrm{H_5} \mathrm{NH}, \mathrm{NHCONH_2} \text{, आदि। } $$
तालिका 12.2- साम्यावस्था उत्पाद निर्माण के पक्ष में होता है क्योंकि मध्यवर्ती का शीघ्र निर्जलीकरण होकर $>\mathrm{C}=\mathrm{N}-\mathrm{Z}$ बनता है।

2. अपचयन
(i) एल्कोहलों में अपचयन: ऐल्डिहाइड और कीटोन क्रमशः प्राथमिक और द्वितीयक एल्कोहलों में सोडियम बोरोहाइड्राइड $\left(\mathrm{NaBH_4}\right)$ या लिथियम ऐल्युमिनियम हाइड्राइड $\left(\mathrm{LiAlH_4}\right)$ द्वारा तथा उत्प्रेरक हाइड्रोजनीकरण द्वारा (इकाई 11, कक्षा XII) अपचयित होते हैं।
(ii) हाइड्रोकार्बनों में अपचयन: ऐल्डिहाइड और कीटोन के कार्बोनिल समूह को जिंक-अमलगम और सांद्र हाइड्रोक्लोरिक अम्ल [क्लेमेन्सन अपचयन] के साथ अथवा हाइड्राज़ीन के साथ उपचारित करके उच्च क्वथनांक विलायक जैसे एथिलीन ग्लाइकोल में सोडियम या पोटैशियम हाइड्रॉक्साइड के साथ गरम करने पर $\mathrm{CH_2}$ समूह में अपचयित किया जाता है (वोल्फ-किशनर अपचयन)।

बर्नहार्ड टॉलेन्स (1841-1918) जर्मनी के गॉटिंगन विश्वविद्यालय में रसायन विज्ञान के प्रोफेसर थे।
3. ऑक्सीकरण
एल्डिहाइड्स की ऑक्सीकरण अभिक्रियाएँ कीटोन्स से भिन्न होती हैं। एल्डिहाइड्स सामान्य ऑक्सीकारक अभिकर्मकों—जैसे नाइट्रिक अम्ल, पोटैशियम परमैंगनेट, पोटैशियम डाइक्रोमेट आदि—के साथ आसानी से कार्बोक्सिलिक अम्लों में ऑक्सीकृत हो जाते हैं। यहाँ तक कि हल्के ऑक्सीकारक, मुख्यतः टॉलेन्स अभिकर्मक और फेहलिंग अभिकर्मक भी एल्डिहाइड्स को ऑक्सीकृत कर देते हैं।
कीटोन्स आमतौर पर कठोर परिस्थितियों—अर्थात् प्रबल ऑक्सीकारकों और उच्च तापमान—के अंतर्गत ही ऑक्सीकृत होते हैं। इनके ऑक्सीकरण में कार्बन-कार्बन बंध टूटता है, जिससे मूल कीटोन से कम कार्बन परमाणु वाले कार्बोक्सिलिक अम्लों का मिश्रण प्राप्त होता है।

नीचे दिए गए हल्के ऑक्सीकारक एल्डिहाइड्स और कीटोन्स के बीच भेद करने के लिए प्रयुक्त होते हैं:
(i) टॉलेन्स परीक्षण: जब एल्डिहाइड को ताज़े तैयार अमोनियाकीय सिल्वर नाइट्रेट विलयन (टॉलेन्स अभिकर्मक) के साथ गरम किया जाता है, तो चाँदी धातु के बनने से एक चमकदार चाँदी का दर्पण बनता है। एल्डिहाइड्स संगत कार्बॉक्सिलेट ऐनियन में ऑक्सीकृत हो जाते हैं। यह अभिक्रिया क्षारीय माध्यम में होती है।
$\mathrm{RCHO}+2\left[\mathrm{Ag}\left(\mathrm{NH_3}\right)_{2}\right]^{+}+3 \overline{\mathrm{O}} \mathrm{H} \longrightarrow \mathrm{RCO} \overline{\mathrm{O}}+2 \mathrm{Ag}+2 \mathrm{H_2} \mathrm{O}+4 \mathrm{NH_3}$
(ii) फ़ेलिंग परीक्षण: फ़ेलिंग अभिकर्मक दो विलयनों से बना होता है, फ़ेलिंग विलयन A और फ़ेलिंग विलयन B। फ़ेलिंग विलयन A जलीय कॉपर सल्फ़ेट है और फ़ेलिंग विलयन B क्षारीय सोडियम पोटैशियम टार्ट्रेट (रॉशेल नमक) है। परीक्षण से पहले इन दोनों विलयनों को बराबर मात्रा में मिलाया जाता है। किसी ऐल्डिहाइड को फ़ेलिंग अभिकर्मक के साथ गरम करने पर भूरी-लाल अवक्षेप प्राप्त होता है। ऐल्डिहाइड संगत कार्बॉक्सिलेट ऐनियन में ऑक्सीकृत हो जाते हैं। एरोमैटिक ऐल्डिहाइड इस परीक्षण में प्रतिक्रिया नहीं करते।
$$ \mathrm{R}-\mathrm{CHO}+2 \mathrm{Cu}^{2+}+5 \overline{\mathrm{O}} \mathrm{H} \longrightarrow \underset{\text { भूरी-लाल अवक्षेप }}{\mathrm{RCO} \overline{\mathrm{O}}+\mathrm{Cu_2} \mathrm{O}+3 \mathrm{H_2} \mathrm{O}} $$
(iii) हैलोफ़ॉर्म अभिक्रिया द्वारा मेथिल कीटोनों का ऑक्सीकरण: वे ऐल्डिहाइड और कीटोन जिनमें कार्बोनिल कार्बन पर कम-से-कम एक मेथिल समूह जुड़ा हो (मेथिल कीटोन), सोडियम हाइपोहैलाइट द्वारा ऑक्सीकृत होकर संगत कार्बॉक्सिलिक अम्लों के सोडियम लवण बनाते हैं जिनमें कार्बोनिल यौगिक की तुलना में एक कार्बन कम होता है। मेथिल समूह हैलोफ़ॉर्म में रूपांतरित हो जाता है। यह ऑक्सीकरण अणु में उपस्थित कार्बन-कार्बन द्विबंध को प्रभावित नहीं करता, यदि वह मौजूद हो।

सोडियम हाइपोआयोडाइट के साथ आयोडोफ़ॉर्म अभिक्रिया का उपयोग (\mathrm{CH_3} \mathrm{CO}) समूह या (\mathrm{CH_3} \mathrm{CH}(\mathrm{OH})) समूह की पहचान के लिए भी किया जाता है जो ऑक्सीकरण पर (\mathrm{CH_3} \mathrm{CO}) समूह उत्पन्न करता है।
उदाहरण 12.4
एक कार्बनिक यौगिक (A) जिसका आण्विक सूत्र $\mathrm{C_8} \mathrm{H_8} \mathrm{O}$ है, 2,4-DNP अभिकर्मक के साथ नारंगी-लाल अवक्षेप बनाता है और सोडियम हाइड्रॉक्साइड की उपस्थिति में आयोडीन के साथ गरम करने पर पीला अवक्षेप देता है। यह न तो Tollens’ या Fehlings’ अभिकर्मक को अपचयित करता है, और न ही ब्रोमीन वाटर या Baeyer’s अभिकर्मक को विरंजित करता है। क्रोमिक अम्ल के साथ कठोर ऑक्सीकरण पर, यह एक कार्बोक्सिलिक अम्ल (B) देता है जिसका आण्विक सूत्र $\mathrm{C_7} \mathrm{H_6} \mathrm{O_2}$ है। यौगिकों (A) और (B) की पहचान कीजिए और शामिल अभिक्रियाओं की व्याख्या कीजिए।
हल (A) 2,4-DNP व्युत्पन्न बनाता है। इसलिए, यह एक ऐल्डिहाइड या कीटोन है। चूंकि यह Tollens’ या Fehling अभिकर्मक को अपचयित नहीं करता, (A) एक कीटोन होना चाहिए। (A) आयोफॉर्म परीक्षण में सकारात्मक प्रतिक्रिया देता है। इसलिए, यह एक मेथिल कीटोन होना चाहिए। (A) के आण्विक सूत्र से उच्च असंतृप्तता का संकेत मिलता है, फिर भी यह ब्रोमीन वाटर या Baeyer’s अभिकर्मक को विरंजित नहीं करता। इससे संकेत मिलता है कि असंतृप्तता एक एरोमेटिक वलय के कारण है।
यौगिक (B), एक कीटोन का ऑक्सीकरण उत्पाद होने के नाते, एक कार्बोक्सिलिक अम्ल होना चाहिए। $(\mathrm{B})$ के आण्विक सूत्र से संकेत मिलता है कि यह बेन्ज़ोइक अम्ल होना चाहिए और इसलिए यौगिक (A) एक मोनोसब्स्टिट्यूटेड एरोमेटिक मेथिल कीटोन होना चाहिए। (A) के आण्विक सूत्र से संकेत मिलता है कि यह फेनिल मेथिल कीटोन (एसीटोफेनोन) होना चाहिए। अभिक्रियाएं इस प्रकार हैं:

4. α-हाइड्रोजन के कारण होने वाली अभिक्रियाएँ
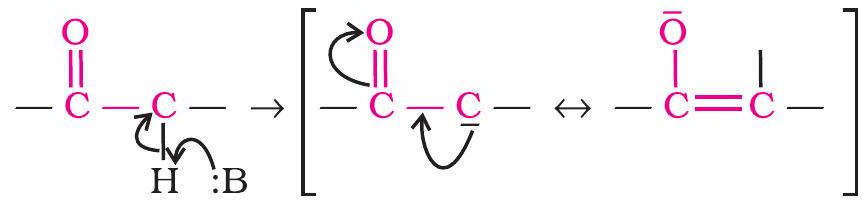
एल्डिहाइडों और कीटोनों के α-हाइड्रोजन की अम्लता: एल्डिहाइड और कीटोन अपने α-हाइड्रोजन की अम्ल प्रकृति के कारण कई अभिक्रियाएँ देते हैं।
कार्बोनिल यौगिकों के α-हाइड्रोजन परमाणुओं की अम्लता कार्बोनिल समूह के प्रबल इलेक्ट्रॉन-अपाकर्षी प्रभाव तथा संयुग्मी आधार के अनुनाद स्थिरीकरण के कारण होती है।
(i) एल्डोल संघनन: कम से कम एक α-हाइड्रोजन वाले एल्डिहाइड और कीटोन तनु क्षार कीउपस्थिति में उत्प्रेरक के रूप में अभिक्रिया कर β-हाइड्रॉक्सी एल्डिहाइड (एल्डोल) या β-हाइड्रॉक्सी कीटोन (कीटोल) बनाते हैं। इसे एल्डोल अभिक्रिया कहते हैं।

एल्डोल नाम उत्पादों में मौजूद दो कार्यात्मक समूहों—एल्डिहाइड और एल्कोहॉल—के नामों से लिया गया है। एल्डोल और कीटोल सरलता से जल खोकर α,β-असंतृप्त कार्बोनिल यौगिक देते हैं, जो एल्डोल संघनन उत्पाद होते हैं, और इस अभिक्रिया को एल्डोल संघनन कहा जाता है। यद्यपि कीटोन कीटोल (एक कीटो और एक एल्कोहॉल समूह युक्त यौगिक) देते हैं, एल्डिहाइडों से समानता के कारण सामान्य नाम एल्डोल संघनन कीटोनों की अभिक्रियाओं पर भी लागू होता है।

(ii) क्रॉस ऐल्डो संघनन: जब ऐल्डो संघनन दो भिन्न ऐल्डिहाइडों और/या कीटोनों के बीच किया जाता है, तो इसे क्रॉस ऐल्डो संघनन कहा जाता है। यदि दोनों में α-हाइड्रोजन परमाणु हों, तो यह चार उत्पादों का मिश्रण देता है। इसे नीचे एथैनल और प्रोपैनल के मिश्रण की ऐल्डो अभिक्रिया द्वारा दर्शाया गया है।

5. अन्य अभिक्रियाएँ
(i) कैनिज़ारो अभिक्रिया: ऐल्डिहाइड जिनमें α-हाइड्रोजन परमाणु नहीं होता, वे सांद्र क्षार के साथ गरम करने पर स्व-ऑक्सीकरण और अपचयन (विषमानुपातन) अभिक्रिया करते हैं। इस अभिक्रिया में, ऐल्डिहाइड का एक अणु अल्कोहल में अपचयित होता है जबकि दूसरा कार्बोक्सिलिक अम्ल लवण में ऑक्सीकृत होता है।

(ii) विद्युतस्नेही प्रतिस्थापन अभिक्रिया: एरोमैटिक ऐल्डिहाइड और कीटोन वलय पर विद्युतस्नेही प्रतिस्थापन अभिक्रिया करते हैं जिसमें कार्बोनिल समूह निष्क्रियकारी और मेटा-निर्देशक समूह के रूप में कार्य करता है।

12.5 ऐल्डिहाइडों और कीटोनों के उपयोग
रासायनिक उद्योग में एल्डिहाइड और कीटोन को विलायक, प्रारंभिक पदार्थ और अन्य उत्पादों के संश्लेषण के लिए अभिकर्मक के रूप में उपयोग किया जाता है। फॉर्मल्डिहाइड फॉर्मलिन (40%) विलयन के रूप में जाना जाता है जो जैविक नमूनों को संरक्षित करने और बैकेलाइट (एक फेनॉल-फॉर्मल्डिहाइड रेजिन), यूरिया-फॉर्मल्डिहाइड गोंद और अन्य बहुलक उत्पादों को तैयार करने के लिए उपयोग किया जाता है। एसिटल्डिहाइड का उपयोग मुख्य रूप से एसिटिक एसिड, एथिल एसीटेट, विनाइल एसीटेट, बहुलकों और दवाओं के निर्माण में प्रारंभिक पदार्थ के रूप में किया जाता है। बेंज़ल्डिहाइड का उपयोग इत्र और रंग उद्योगों में किया जाता है। एसीटोन और एथिल मेथिल कीटोन सामान्य औद्योगिक विलायक हैं। कई एल्डिहाइड और कीटोन, जैसे ब्यूटिराल्डिहाइड, वेनिलिन, एसीटोफेनोन, कैम्फर आदि, अपनी गंध और स्वाद के लिए जाने जाते हैं।
कार्बोक्सिलिक अम्ल
कार्बोक्सिल कार्यात्मक समूह, $-\mathrm{COOH}$ युक्त कार्बन यौगिकों को कार्बोक्सिलिक अम्ल कहा जाता है। कार्बोक्सिल समूह, एक कार्बोनिल समूह से बना होता है जो एक हाइड्रॉक्सिल समूह से जुड़ा होता है, इसलिए इसका नाम कार्बोक्सिल है। कार्बोक्सिलिक अम्ल एलिफैटिक $(\mathrm{RCOOH})$ या एरोमैटिक $(\mathrm{ArCOOH})$ हो सकते हैं, यह इस बात पर निर्भर करता है कि कार्बोक्सिलिक कार्बन से जुड़ा समूह, अल्किल या एरिल है। प्रकृति में बड़ी संख्या में कार्बोक्सिलिक अम्ल पाए जाते हैं। एलिफैटिक कार्बोक्सिलिक अम्लों के कुछ उच्च सदस्य $\left(\mathrm{C_12}-\mathrm{C_18}\right)$ जिन्हें फैटी अम्ल कहा जाता है, प्राकृतिक वसा में ग्लिसरॉल के एस्टर के रूप में पाए जाते हैं। कार्बोक्सिलिक अम्ल कई अन्य महत्वपूर्ण कार्बनिक यौगिकों जैसे एनहाइड्राइड, एस्टर, एसिड क्लोराइड, एमाइड आदि के लिए प्रारंभिक पदार्थ के रूप में कार्य करते हैं।
12.6 कार्बोक्सिल समूह की नामकरण और संरचना
12.6.1 नामकरण
चूँकि कार्बोक्सिलिक अम्ल प्रकृति से पृथक किए गए प्रारंभिक कार्बनिक यौगिकों में से हैं, इनमें से बड़ी संख्या में सामान्य नामों से जाने जाते हैं। सामान्य नाम -ic acid प्रत्यय से समाप्त होते हैं और इनको उनके प्राकृतिक स्रोतों के लैटिन या ग्रीक नामों से लिया गया है। उदाहरण के लिए, फॉर्मिक अम्ल $(\mathrm{HCOOH})$ पहली बार लाल चींटियों से प्राप्त किया गया था (लैटिन: formica का अर्थ है चींटी), एसिटिक अम्ल $\left(\mathrm{CH_3} \mathrm{COOH}\right)$ सिरके से (लैटिन: acetum, का अर्थ है सिरका), ब्यूटिरिक अम्ल $\left(\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{COOH}\right)$ बासी मक्खन से (लैटिन: butyrum, का अर्थ है मक्खन)।
IUPAC पद्धति में, ऐलिफैटिक कार्बोक्सिलिक अम्लों का नामन उससे संबंधित ऐल्केन के नाम में -e को oic acid से प्रतिस्थापित करके किया जाता है। कार्बन श्रृंखला की संख्या देते समय कार्बोक्सिलिक कार्बन को संख्या एक दी जाती है। एक से अधिक कार्बोक्सिल समूह वाले यौगिकों के नामकरण के लिए, कार्बोक्सिल समूहों को छोड़कर ऐल्किल श्रृंखला की संख्या दी जाती है और कार्बोक्सिल समूहों की संख्या को गुणात्मक उपसर्ग, dicarboxylic acid, tricarboxylic acid आदि को मूल ऐल्किल श्रृंखला के नाम में जोड़कर दर्शाया जाता है। $-\mathrm{COOH}$ समूहों की स्थिति को गुणात्मक उपसर्ग से पहले अरबी संख्या द्वारा दर्शाया जाता है। कुछ कार्बोक्सिलिक अम्लों को उनके सामान्य और IUPAC नामों के साथ तालिका 12.3 में सूचीबद्ध किया गया है।
तालिका 12.3 कुछ कार्बोक्सिलिक अम्लों के नाम और संरचनाएँ

12.6.2 कार्बोक्सिल समूह की संरचना
कार्बोक्सिलिक अम्लों में, कार्बोक्सिल कार्बन से बने बंध एक ही तल में होते हैं और लगभग 120° के कोण पर अलग-अलग होते हैं। कार्बोक्सिलिक कार्बन, कार्बोनिल कार्बन की तुलना में कम इलेक्ट्रॉनलोभी होता है, क्योंकि नीचे दिखाया गया अनुनाद संरचना संभव है:

12.7 कार्बोक्सिलिक अम्लों की तैयारी की विधियाँ
कार्बोक्सिलिक अम्लों की तैयारी की कुछ महत्वपूर्ण विधियाँ इस प्रकार हैं।
1. प्राथमिक एल्कोहलों और ऐल्डिहाइडों से
प्राथमिक एल्कोहल सामान्य ऑक्सीकरण एजेंटों जैसे पोटेशियम परमैंगनेट (KMnO₄) तटीय, अम्लीय या क्षारीय माध्यम में या पोटेशियम डाइक्रोमेट (K₂Cr₂O₇) और क्रोमियम ट्राइऑक्साइड (CrO₃) अम्लीय माध्यम में (जोन्स अभिकर्मक) द्वारा सरलता से कार्बोक्सिलिक अम्लों में ऑक्सीकृत हो जाते हैं।
$$ \begin{aligned} & \mathrm{RCH_2} \mathrm{OH} \xrightarrow[2 \cdot \mathrm{H_3} \mathrm{O}]{\text { l. क्षारीय } \mathrm{KMnO_4}} \mathrm{RCOOH} \\ & \underset{\substack{\text { 1-डेकानॉल }}}{\mathrm{CH_3}\left(\mathrm{CH_2}\right)_8 \mathrm{CH_2} \mathrm{OH}} \mathrm{CrO_3} \xrightarrow [\text { जोन्स अभिकर्मक }]{\mathrm{H_2} \mathrm{SO_4}} \underset{\text { डेकानोइक अम्ल }}{\mathrm{CH_3}\left(\mathrm{CH_2}\right)_8 \mathrm{COOH}} \end{aligned} $$
कार्बोक्सिलिक अम्लों को एल्डिहाइडों से भी हल्के ऑक्सीकरण अभिकर्मकों के प्रयोग से तैयार किया जाता है (अनुभाग 12.4)।
2. एल्किलबेंजीनों से
एरोमैटिक कार्बोक्सिलिक अम्लों को क्रोमिक अम्ल या अम्लीय या क्षारीय पोटैशियम परमैंगनेट के साथ एल्किल बेंजीनों के प्रबल ऑक्सीकरण द्वारा तैयार किया जा सकता है। पूरी साइड चेन को कार्बोक्सिल समूह में ऑक्सीकृत किया जाता है, चाहे साइड चेन की लंबाई कुछ भी हो। प्राथमिक और द्वितीयक एल्किल समूह इस प्रकार ऑक्सीकृत होते हैं जबकि तृतीयक समूह प्रभावित नहीं होता। उपयुक्त रूप से प्रतिस्थापित एल्कीनों को भी इन ऑक्सीकरण अभिकर्मकों के साथ कार्बोक्सिलिक अम्लों में ऑक्सीकृत किया जाता है (कक्षा XI, इकाई 13 देखें)।

3. नाइट्राइलों और एमाइडों से
नाइट्राइलों को $\mathrm{H}^{+}$ या $\mathrm{OH}$ उत्प्रेरक की उपस्थिति में एमाइडों और फिर अम्लों में जलअपघटित किया जाता है। एमाइड स्तर पर अभिक्रिया को रोकने के लिए हल्की अभिक्रिया परिस्थितियों का उपयोग किया जाता है।

4. ग्रिग्नार्ड अभिकर्मकों से
ग्रिग्नार्ड अभिकर्मक कार्बन डाइऑक्साइड (सूखी बर्फ) के साथ अभिक्रिया कर काबॉक्सिलिक अम्लों के लवण बनाते हैं, जो खनिज अम्ल से अम्लीकरण के बाद संगत काबॉक्सिलिक अम्ल देते हैं।

जैसा कि हम जानते हैं, ग्रिग्नार्ड अभिकर्मक और नाइट्राइल्स एल्किल हैलाइड्स से तैयार किए जा सकते हैं (कक्षा XII, इकाई 10 देखें)। उपरोक्त विधियाँ (3 और 4) एल्किल हैलाइड्स को संगत काबॉक्सिलिक अम्लों में परिवर्तित करने में उपयोगी हैं, जिनमें कार्बन परमाणु की संख्या एल्किल हैलाइड्स की तुलना में एक अधिक होती है (श्रेणी में आरोही क्रम)।
5. एसिल हैलाइड्स और ऐनहाइड्राइड्स से
एसिड क्लोराइड्स जल के साथ हाइड्रोलिस होने पर काबॉक्सिलिक अम्ल देते हैं या जलीय क्षार के साथ अधिक सरलता से हाइड्रोलिस होकर काबॉक्सिलेट आयन देते हैं, जो अम्लीकरण पर संगत काबॉक्सिलिक अम्ल प्रदान करते हैं। दूसरी ओर, ऐनहाइड्राइड्स जल के साथ हाइड्रोलिस होकर संगत अम्ल(ों) देते हैं।

6. एस्टर्स से
एस्टर्स की अम्लीय हाइड्रोलिस सीधे काबॉक्सिलिक अम्ल देती है, जबकि क्षारीय हाइड्रोलिस काबॉक्सिलेट देती है, जो अम्लीकरण पर संगत काबॉक्सिलिक अम्ल देते हैं।

उदाहरण 12.5
(i) ब्यूटेन-1-ऑल से ब्यूटेनोइक अम्ल
(ii) बेंज़िल ऐल्कोहल से फ़ेनिलेथेनोइक अम्ल
(iii) 3-नाइट्रोब्रोमोबेंज़ीन से 3-नाइट्रोबेंज़ोइक अम्ल
(iv) 4-मेथिलऐसीटोफ़ेनोन से बेंज़ीन-1,4-डाइकार्बॉक्सिलिक अम्ल
(v) साइक्लोहेक्सीन से हेक्सेन-1,6-डाइओइक अम्ल
(vi) ब्यूटेनल से ब्यूटेनोइक अम्ल।
हल

12.8 भौतिक गुण
नौ कार्बन परमाणुओं तक की ऐलिफैटिक कार्बॉक्सिलिक अम्ल कमरे के तापमान पर रंगहीन द्रव होती हैं जिनकी अप्रिय गंध होती है। उच्चतर अम्ल मोम जैसे ठोस होते हैं और इनकी कम वाष्पशीलता के कारण व्यावहारिक रूप से गंधहीन होते हैं। कार्बॉक्सिलिक अम्ल, तुलनात्मक आण्विक द्रव्यमानों के ऐल्डिहाइड, कीटोन और यहां तक कि ऐल्कोहलों की तुलना में उच्च क्वथनांक वाले द्रव होते हैं। यह कार्बॉक्सिलिक अम्ल अणुओं के आंतरिक अणुकीय हाइड्रोजन बंधन के माध्यम से अधिक व्यापक संघटन के कारण होता है। वाष्प अवस्था में भी हाइड्रोजन बंध पूरी तरह टूटते नहीं हैं। वास्तव में, अधिकांश कार्बॉक्सिलिक अम्ल वाष्प अवस्था या अप्रोटिक विलायकों में डाइमर के रूप में विद्यमान रहते हैं।

चार कार्बन परमाणुओं तक वाले सरल ऐलिफैटिक कार्बोक्सिलिक अम्ल जल में मिश्रणीय होते हैं क्योंकि वे जल से हाइड्रोजन बंध बनाते हैं। कार्बन परमाणुओं की संख्या बढ़ने के साथ विलेयता घटती है। उच्चतर कार्बोक्सिलिक अम्ल व्यावहारिक रूप से जल में अविलेय होते हैं क्योंकि हाइड्रोकार्बन भाग की हाइड्रोफोबिक अन्योन्यक्रिया बढ़ जाती है। बेन्ज़ोइक अम्ल, सरलतम एरोमैटिक कार्बोक्सिलिक अम्ल, ठंडे जल में लगभग अविलेय होता है। कार्बोक्सिलिक अम्ल बेंजीन, ईथर, अल्कोहल, क्लोरोफॉर्म आदि जैसे कम ध्रुवीय कार्बनिक विलायकों में भी विलेय होते हैं।
12.9 रासायनिक अभिक्रियाएँ
कार्बोक्सिलिक अम्लों की अभिक्रियाओं को इस प्रकार वर्गीकृत किया गया है:
12.9.1 $\mathrm{O}-\mathrm{H}$ बंध के विखंडन से संबंधित अभिक्रियाएँ
अम्लता
धातुओं और क्षारों के साथ अभिक्रियाएँ कार्बोक्सिलिक अम्ल, अल्कोहलों की तरह, धनात्मक धातुओं के साथ हाइड्रोजन उत्सर्जित करते हैं और क्षारों के साथ लवण बनाते हैं, जैसा कि फ़ीनॉल्स में होता है। फिर भी, फ़ीनॉल्स के विपरीत, वे कार्बोनेट और हाइड्रोजनकार्बोनेट जैसे कमजोर क्षारों से भी कार्बन डाइऑक्साइड उत्सर्जित करने वाली अभिक्रिया करते हैं। यह अभिक्रिया किसी कार्बनिक यौगिक में कार्बॉक्सिल समूह की उपस्थिति का पता लगाने के लिए प्रयुक्त होती है।
$$ \begin{aligned} & 2 \mathrm{R}-\mathrm{COOH}+2 \mathrm{Na} \longrightarrow \underset{\text{सोडियम कार्बॉक्सिलेट}}{2 \mathrm{R}-\mathrm{CO} \overline{\mathrm{O}} \mathrm{Na}}+\mathrm{H} _{2} \\ \end{aligned} $$
$$ \begin{aligned} & \mathrm{R}-\mathrm{COOH}+\mathrm{NaOH} \longrightarrow \mathrm{R}-\mathrm{COO} \mathrm{N}^{+}+\mathrm{H} _{2} \mathrm{O} \\ & \mathrm{R}-\mathrm{COOH}+\mathrm{NaHCO} _{3} \longrightarrow \mathrm{R}-\mathrm{CO} \overline{\mathrm{O} N} \mathrm{Na}^{+}+\mathrm{H} _{2} \mathrm{O}+\mathrm{CO} _{2} \end{aligned} $$
कार्बोक्सिलिक अम्ल जल में वियोजित होकर अनुनाद स्थिरीकृत कार्बोक्सिलेट ऋणायन और हाइड्रोनियम आयन देते हैं।

उपरोक्त अभिक्रिया के लिए:
$$ K_{e q}=\frac{\left[\stackrel{+}{\mathrm{H_3}}\right][\mathrm{RCO} \stackrel{-}{\mathrm{O}}]}{\left[\mathrm{H_2} \mathrm{O}\right][\mathrm{RCOOH}]} \quad K_{a}=K_{e q}\left[\mathrm{H_2} \mathrm{O}\right]=\frac{[\stackrel{+}{\mathrm{H}}][\mathrm{RCO} \stackrel{-}{\mathrm{RC}}]}{[\mathrm{RCOOH}]} $$
जहाँ $K_{e q}$ साम्य स्थिरांक है और $K_{a}$ अम्ल वियोजन स्थिरांक है।
सुविधा के लिए, किसी अम्ल की सामर्थ्य आमतौर पर उसके $K_{a}$ मान के बजाय $\mathrm{p} K_{a}$ मान से दर्शाई जाती है।
$$ \mathrm{p} K_{a}=-\log K_{a} $$
हाइड्रोक्लोरिक अम्ल का $\mathrm{p} K_{a}$ -7.0 है, जबकि ट्राइफ्लुओरोएसिटिक अम्ल (सबसे प्रबल कार्बोक्सिलिक अम्ल), बेन्ज़ोइक अम्ल और एसिटिक अम्ल के $\mathrm{p} K_{a}$ क्रमशः 0.23, 4.19 और 4.76 हैं।
जितना छोटा $\mathrm{p} K_{a}$ होगा, उतना ही मजबूत अम्ल होगा (यह प्रोटॉन दाता के रूप में उतना ही बेहतर होगा)। मजबूत अम्लों के $\mathrm{p} K_{a}$ मान $<1$ होते हैं, जिन अम्लों के $\mathrm{p} K_{a}$ मान 1 और 5 के बीच होते हैं उन्हें मध्यम रूप से मजबूत अम्ल माना जाता है, कमजोर अम्लों के $\mathrm{p} K_{a}$ मान 5 और 15 के बीच होते हैं, और अत्यंत कमजोर अम्लों के $\mathrm{p} K_{a}$ मान $>15$ होते हैं।
कार्बोक्सिलिक अम्ल खनिज अम्लों से कमजोर होते हैं, लेकिन ये एल्कोहलों और कई सरल फ़ीनोलों ( $\mathrm{p} K_{a}$ ~16 है और फ़ीनोल के लिए 10 है) की तुलना में अधिक मजबूत अम्ल होते हैं। वास्तव में, कार्बोक्सिलिक अम्ल उन सबसे अधिक अम्लीय कार्बनिक यौगिकों में से हैं जिन्हें आपने अब तक पढ़ा है। आप पहले से ही जानते हैं कि फ़ीनोल एल्कोहलों की तुलना में अधिक अम्लीय क्यों होते हैं। फ़ीनोलों की तुलना में कार्बोक्सिलिक अम्लों की उच्च अम्लीयता को इसी प्रकार समझा जा सकता है। कार्बोक्सिलिक अम्ल का संयुग्मी आधार, कार्बॉक्सिलेट आयन, दो समतुल्य अनुनाद संरचनाओं द्वारा स्थिर होता है जिनमें ऋणात्मक आवेश अधिक विद्युतऋणात्मक ऑक्सीजन परमाणु पर होता है। फ़ीनोल का संयुग्मी आधार, फ़ीनॉक्साइड आयन, असमतुल्य अनुनाद संरचनाएँ रखता है जिनमें ऋणात्मक आवेश कम विद्युतऋणात्मक कार्बन परमाणु पर होता है। इसलिए, फ़ीनॉक्साइड आयन में अनुनाद उतना महत्वपूर्ण नहीं होता जितना कि कार्बॉक्सिलेट आयन में। इसके अतिरिक्त, कार्बॉक्सिलेट आयन में ऋणात्मक आवेश दो विद्युतऋणात्मक ऑक्सीजन परमाणुओं पर विकेन्द्रित होता है, जबकि फ़ीनॉक्साइड आयन में यह कम प्रभावी रूप से एक ऑक्सीजन परमाणु और कम विद्युतऋणात्मक कार्बन परमाणुओं पर विकेन्द्रित होता है (इकाई 11, कक्षा XII)। इस प्रकार, कार्बॉक्सिलेट आयन फ़ीनॉक्साइड आयन की तुलना में अधिक स्थिर होता है, इसलिए कार्बोक्सिलिक अम्ल फ़ीनोलों की तुलना में अधिक अम्लीय होते हैं।
कार्बोक्सिलिक अम्लों की अम्लता पर प्रतिस्थापकों का प्रभाव: प्रतिस्थापक संयुग्मी आधार की स्थिरता को प्रभावित कर सकते हैं और इस प्रकार कार्बोक्सिलिक अम्लों की अम्लता को भी प्रभावित करते हैं। इलेक्ट्रॉन खींचने वाले समूह कार्बोक्सिलिक अम्लों की अम्लता को बढ़ाते हैं क्योंकि वे प्रेरण और/या अनुनाद प्रभावों के द्वारा ऋण आवेश के विस्थापन के माध्यम से संयुग्मी आधार को स्थिर करते हैं। इसके विपरीत, इलेक्ट्रॉन देने वाले समूह संयुग्मी आधार को अस्थिर करके अम्लता को घटाते हैं।

इलेक्ट्रॉन खींचने वाला समूह (EWG) कार्बॉक्सिलेट ऐनियन को स्थिर करता है और अम्ल को मजबूत बनाता है

इलेक्ट्रॉन देने वाला समूह (EDG) कार्बॉक्सिलेट ऐनियन को अस्थिर करता है और अम्ल को कमजोर बनाता है
निम्न समूहों का बढ़ती अम्लता क्रम में प्रभाव है $\mathrm{Ph}<\mathrm{I}<\mathrm{Br}<\mathrm{Cl}<\mathrm{F}<\mathrm{CN}<\mathrm{NO_2}<\mathrm{CF_3}$
इस प्रकार, निम्न अम्लों को बढ़ती अम्लता के क्रम में व्यवस्थित किया गया है (pKa मानों के आधार पर):
$ \begin{array}{l} \mathrm{CF_3COOH > CCl_3COOH > CHCl_2COOH > NO_2CH_2COOH > NC-CH_2COOH >} \\ \xleftarrow{} \end{array} $
$ \begin{array}{l} \mathrm{FCH_2COOH > ClCH_2COOH > BrCH_2COOH > HCOOH > ClCH_2CH_2COOH >} \\ \text{(जारी) } \xleftarrow{} \end{array} $
$ \begin{array}{l} \mathrm{C_6H_5COOH > C_6H_5CH_2COOH > CH_3COOH > CH_3CH_2COOH} \\ \text{(जारी) } \xleftarrow{} \end{array} $
कार्बोक्सिलिक अम्ल से फ़ेनिल या विनिल जैसे समूहों का सीधा संलग्न होना, संबंधित कार्बोक्सिलिक अम्ल की अम्लता को बढ़ाता है, नीचे दिखाए गए अनुनाद प्रभाव के कारण अपेक्षित कमी के विपरीत:

ऐसा इसलिए है क्योंकि जिस $s p^{2}$ संकरित कार्बन से कार्बॉक्सिल कार्बन जुड़ा होता है, उसकी विद्युत्-ऋणात्मकता अधिक होती है। एरोमैटिक कार्बोक्सिलिक अम्ल के फ़ेनिल पर इलेक्ट्रॉन खींचने वाले समूहों की उपस्थिति उनकी अम्लता बढ़ाती है, जबकि इलेक्ट्रॉन देने वाले समूह उनकी अम्लता घटाते हैं।

12.9.2 $\mathbf{C}-\mathbf{O H}$ बंध विखंडन से संबंधित अभिक्रियाएँ
1. ऐनहाइड्राइड बनना
कार्बोक्सिलिक अम्लों को खनिज अम्ल जैसे $\mathrm{H_2} \mathrm{SO_4}$ या $\mathrm{P_2} \mathrm{O_5}$ के साथ गरम करने पर संगत ऐनहाइड्राइड मिलता है।

2. एस्टरीकरण
कार्बोक्सिलिक अम्लों को अल्कोहलों या फ़ीनॉल्स के साथ खनिज अम्ल जैसे सान्द्र $\mathrm{H_2} \mathrm{SO_4}$ या $\mathrm{HCl}$ गैस की उपस्थिति में उत्प्रेरक के रूप में एस्टर बनाया जाता है।
$$ \mathrm{RCOOH}+\mathrm{R}^{\prime} \mathrm{OH} \rightleftharpoons \stackrel{\mathrm{H}^{+}}{\rightleftharpoons} \mathrm{RCOOR}^{\prime}+\mathrm{H_2} \mathrm{O} $$
कार्बोक्सिलिक अम्लों के एस्टरीकरण की क्रियाविधि:
कार्बोक्सिलिक अम्लों का एल्कोहलों के साथ एस्टरीकरण न्यूक्लियोफिलिक ऐसिल प्रतिस्थापन का एक प्रकार है। कार्बोनिल ऑक्सीजन का प्रोटोनेशन कार्बोनिल समूह को एल्कोहल के न्यूक्लियोफिलिक योग के प्रति सक्रिय कर देता है। टेट्राहेड्रल मध्यवर्ती में प्रोटोन स्थानांतर हाइड्रॉक्सिल समूह को –+OH2 समूह में बदल देता है, जो एक बेहतर छोड़ने वाला समूह होने के नाते तटस्थ जल अणु के रूप में बाहर निकल जाता है। इस प्रकार बना प्रोटोनेटेड एस्टर अंततः एक प्रोटोन खोकर एस्टर देता है।

3. $\mathrm{PCl_5}, \mathrm{PCl_3}$ और $\mathrm{SOCl_2}$ के साथ अभिक्रियाएँ
कार्बोक्सिलिक अम्लों का हाइड्रॉक्सिल समूह, एल्कोहलों के समान व्यवहार करता है और $\mathrm{PCl_5}, \mathrm{PCl_3}$ या $\mathrm{SOCl_2}$ के साथ उपचारित करने पर आसानी से क्लोरीन परमाणु से प्रतिस्थापित हो जाता है। थायोनिल क्लोराइड $\left(\mathrm{SOCl_2}\right)$ को प्राथमिकता दी जाती है क्योंकि अन्य दो उत्पाद गैसीय होते हैं और अभिक्रिया मिश्रण से बाहर निकल जाते हैं जिससे उत्पादों की शुद्धि आसान हो जाती है।
$$ \begin{aligned} & \mathrm{RCOOH}+\mathrm{PCl} _{5} \longrightarrow \mathrm{RCOCl}+\mathrm{PCl} _{3}+\mathrm{HCl} \\ & 3 \mathrm{RCOOH}+\mathrm{PCl} _{3} \longrightarrow 3 \mathrm{RCOCl}+\mathrm{H} _{3} \mathrm{PO} _{3} \\ & \mathrm{RCOOH}+\mathrm{SOCl} _{2} \longrightarrow \mathrm{RCOCl}+\mathrm{SO} _{2}+\mathrm{HCl} \end{aligned} $$
4. अमोनिया के साथ अभिक्रिया
कार्बोक्सिलिक अम्ल अमोनिया के साथ अभिक्रिया कर अमोनियम लवण देते हैं, जिसे उच्च ताप पर आगे गरम करने पर एमाइड प्राप्त होते हैं। उदाहरण के लिए:

12.9.3 $(-\mathrm{COOH})$ समूह से संबंधित अभिक्रियाएँ
1. अपचयन
कार्बोक्सिलिक अम्ल लिथियम ऐल्यूमिनियम हाइड्राइड या बेहतर रूप से डाइबोरेन द्वारा प्राथमिक ऐल्कोहॉलों में अपचयित होते हैं। डाइबोरेन एस्टर, नाइट्रो, हेलो आदि कार्यात्मक समूहों को आसानी से अपचयित नहीं करता। सोडियम बोरोहाइड्राइड कार्बॉक्सिल समूह को अपचयित नहीं करता।
$$ \text { R-COOH } \xrightarrow[\text { (ii) } \mathrm{H_3} \mathrm{O}^{+}]{\text {(i) } \mathrm{LiAlH_4} / \text { ईथर } \quad \text { या } \mathrm{B_2} \mathrm{H_6}} \mathrm{R}-\mathrm{CH_2} \mathrm{OH} $$
2. डिकार्बोक्सिलेशन
कार्बोक्सिलिक अम्ल अपने सोडियम लवणों को सोडालाइम (NaOH और CaO 3 : 1 के अनुपात में) के साथ गरम करने पर कार्बन डाइऑक्साइड खोकर हाइड्रोकार्बन बनाते हैं। इस अभिक्रिया को डिकार्बोक्सिलेशन कहा जाता है।
$$ \mathrm{R}-\mathrm{COONa} \xrightarrow[\text{गरम}]{\mathrm{NaOH} \& \mathrm{CaO}} \mathrm{R}-\mathrm{H}+\mathrm{Na_2} \mathrm{CO_3} $$
कार्बोक्सिलिक अम्लों के क्षार धातु लवण अपने जलीय विलयन के विद्युत-विश्लेषण पर भी डिकार्बोक्सिलीकरण करते हैं और अम्ल के एल्किल समूह में उपस्थित कार्बन परमाणुओं की संख्या से दुगुने कार्बन परमाणुओं वाले हाइड्रोकार्बन बनाते हैं। इस अभिक्रिया को कोल्बे विद्युत-विश्लेषण (इकाई 13, कक्षा XI) कहा जाता है।
12.9.4 हाइड्रोकार्बन भाग में प्रतिस्थापन अभिक्रियाएँ
1. हैलोजनीकरण
$\alpha$-हाइड्रोजन युक्त कार्बोक्सिलिक अम्ल, क्लोरीन या ब्रोमीन के साथ लाल फॉस्फोरस की थोड़ी मात्रा की उपस्थिति में $\alpha$-स्थिति पर हैलोजनीकृत होकर $\alpha$-हैलोकार्बोक्सिलिक अम्ल देते हैं। इस अभिक्रिया को हेल-वोलहार्ड-ज़ेलिन्स्की अभिक्रिया कहा जाता है।

2. वलय प्रतिस्थापन
अरोमैटिक कार्बोक्सिलिक अम्ल इलेक्ट्रॉन-स्नेही प्रतिस्थापन अभिक्रियाएँ करते हैं जिनमें कार्बोक्सिल समूह निष्क्रियक और मेटा-निर्देशक समूह के रूप में कार्य करता है। ये फ्राइडेल-क्राफ्ट्स अभिक्रिया नहीं करते (क्योंकि कार्बॉक्सिल समूह निष्क्रियक है और उत्प्रेरक ऐलुमिनियम क्लोराइड (लुइस अम्ल) कार्बॉक्सिल समूह से बंध जाता है)।

पाठ्यांत प्रश्न
8.8 यहाँ दिखाए गए प्रत्येक युग्म में से आप किस अम्ल को अधिक प्रबल अपेक्षा करेंगे?
(i) (\mathrm{CH} _{3} \mathrm{CO} _{2} \mathrm{H}) या (\mathrm{CH} _{2} \mathrm{FCO} _{2} \mathrm{H})
(ii) (\mathrm{CH} _{2} \mathrm{FCO} _{2} \mathrm{H}) या (\mathrm{CH} _{2} \mathrm{ClCO} _{2} \mathrm{H})
(iii) (\mathrm{CH} _{2} \mathrm{FCH} _{2} \mathrm{CH} _{2} \mathrm{CO} _{2} \mathrm{H}) या (\mathrm{CH} _{3} \mathrm{CHFCH} _{2} \mathrm{CO} _{2} \mathrm{H})
(iv)

12.10 कार्बोक्सिलिक अम्लों के उपयोग
मेथानोइक अम्ल का उपयोग रबर, टेक्सटाइल, डाइंग, चमड़ा और इलेक्ट्रोप्लेटिंग उद्योगों में किया जाता है। एथानोइक अम्ल का उपयोग सॉल्वेंट के रूप में और खाद्य उद्योग में सिरके के रूप में किया जाता है। हेक्सेनडाइओइक अम्ल का उपयोग नायलॉन-6, 6 के निर्माण में किया जाता है। बेन्ज़ोइक अम्ल के एस्टर का उपयोग परफ्यूमरी में किया जाता है। सोडियम बेन्ज़ोएट का उपयोग खाद्य संरक्षक के रूप में किया जाता है। उच्च फैटी अम्लों का उपयोग साबुन और डिटर्जेंट के निर्माण के लिए किया जाता है।
सारांश
एल्डिहाइड, कीटोन और कार्बोक्सिलिक एसिड कार्बोनिल समूह युक्त कुछ महत्वपूर्ण कार्बनिक यौगिकों की श्रेणियाँ हैं। ये अत्यधिक ध्रुवीय अणु होते हैं। इसलिए, ये तुलनात्मक आण्विक द्रव्यमान वाले हाइड्रोकार्बन और सपाट ध्रुवीय यौगिक जैसे ईथरों की तुलना में उच्च तापमान पर उबलते हैं। निचले सदस्य जल में अधिक विलेय होते हैं क्योंकि वे जल से हाइड्रोजन बंध बनाते हैं। उच्च सदस्य, कार्बन परमाणुओं की हाइड्रोफोबिक श्रृंखला के बड़े आकार के कारण, जल में अविलेय होते हैं लेकिन सामान्य कार्बनिक विलायकों में विलेय होते हैं। एल्डिहाइड प्राथमिक अल्कोहलों के डिहाइड्रोजनेशन या नियंत्रित ऑक्सीकरण और ऐसिल हैलाइडों के नियंत्रित या चयनात्मक अपचयन द्वारा तैयार किए जाते हैं। एरोमैटिक एल्डिहाइड निम्नलिखित विधियों से भी तैयार किए जा सकते हैं: (i) मेथिलबेंजीन का क्रोमिल क्लोराइड या $\mathrm{CrO_3}$ की उपस्थिति में एसेटिक एनहाइड्राइड के साथ ऑक्सीकरण, (ii) कार्बन मोनोऑक्साइड और हाइड्रोक्लोरिक एसिड की उपस्थिति में एनहाइड्रस एल्युमिनियम क्लोराइड के साथ एरीन का फॉर्मिलेशन, और (iii) क्यप्रस क्लोराइड या बेंज़ल क्लोराइड के हाइड्रोलिसिस द्वारा। कीटोन द्वितीयक अल्कोहलों के ऑक्सीकरण और अल्काइनों के हाइड्रेशन द्वारा तैयार किए जाते हैं। कीटोन ऐसिल क्लोराइड और डाइऐल्किलकैडमियम की अभिक्रिया द्वारा भी तैयार किए जाते हैं। एरोमैटिक कीटोनों की तैयारी के लिए एक अच्छी विधि ऐसिल क्लोराइड या एनहाइड्राइड के साथ एरोमैटिक हाइड्रोकार्बन की फ्राइडल-क्राफ्ट्स ऐसिलेशन है। एल्डिहाइड और कीटोन दोनों को अल्कीनों की ओजोनोलिसिस द्वारा तैयार किया जा सकता है। एल्डिहाइड और कीटोन कार्बोनिल समूह पर न्यूक्लियोफिलिक योग अभिक्रियाएँ करते हैं, जैसे $\mathrm{HCN}, \mathrm{NaHSO_3}$, अल्कोहल (या डाइऑल्स), अमोनिया व्युत्पन्न, और ग्रिग्नार्ड अभिकर्मक। एल्डिहाइड और कीटोन में $\alpha$-हाइड्रोजन अम्लीय होते हैं। इसलिए, कम से कम एक $\alpha$-हाइड्रोजन वाले एल्डिहाइड और कीटोन एक आधार की उपस्थिति में एल्डोल संघनन करते हैं जिससे क्रमशः $\alpha$-हाइड्रॉक्सिएल्डिहाइड (एल्डोल) और $\alpha$-हाइड्रॉक्सीकीटोन (कीटोल) प्राप्त होते हैं। $\alpha$-हाइड्रोजन रहित एल्डिहाइड सान्द्र क्षार की उपस्थिति में कैनिज़ारो अभिक्रिया करते हैं। एल्डिहाइड और कीटोन को $\mathrm{NaBH_4}, \mathrm{LiAlH_4}$ द्वारा या उत्प्रेरक हाइड्रोजनेशन द्वारा अल्कोहलों में अपचयित किया जाता है। एल्डिहाइड और कीटोन के कार्बोनिल समूह को क्लेमेन्सन अपचयन या वोल्फ-किश्नर अपचयन द्वारा मेथिलीन समूह में अपचयित किया जा सकता है। एल्डिहाइड आसानी से टॉलेन अभिकर्मक और फेहलिंग अभिकर्मक जैसे हल्के ऑक्सीकारकों द्वारा कार्बोक्सिलिक एसिडों में ऑक्सीकृत होते हैं। ये ऑक्सीकरण अभिक्रियाएँ एल्डिहाइड को कीटोन से अलग करने के लिए प्रयोग की जाती हैं। कार्बोक्सिलिक एसिड प्राथमिक अल्कोहलों, एल्डिहाइड और अल्कीनों के ऑक्सीकरण, नाइट्राइलों के हाइड्रोलिसिस, और ग्रिग्नार्ड अभिकर्मकों को कार्बन डाइऑक्साइड के साथ उपचार द्वारा तैयार किए जाते हैं। एरोमैटिक कार्बोक्सिलिक एसिड एल्किलबेंजीनों की साइड-चेन ऑक्सीकरण द्वारा भी तैयार किए जाते हैं। कार्बोक्सिलिक एसिड अल्कोहलों और अधिकांस सरल फ़िनॉल्स की तुलना में काफी अधिक अम्लीय होते हैं। कार्बोक्सिलिक एसिड को $\mathrm{LiAlH_4}$ द्वारा, या बेहतर रूप से ईथर विलयन में डाइबोरेन द्वारा प्राथमिक अल्कोहलों में अपचयित किया जाता है और लाल फॉस्फोरस की उपस्थिति में $\mathrm{Cl_2}$ और $\mathrm{Br_2}$ के साथ $\alpha$-हैलोजनेशन भी करते हैं (हेल-वोल्हार्ड ज़ेलिन्स्की अभिक्रिया)। मेथानल, इथानल, प्रोपेनोन, बेंज़ैल्डिहाइड, फॉर्मिक एसिड, एसेटिक एसिड और बेंज़ोइक एसिड उद्योग में अत्यधिक उपयोगी यौगिक हैं।



