यूनिट 13 अमीन्स
Subject Hub
सामान्य Learning Resources
एमीनों का प्रमुख व्यावसायिक उपयोग दवाओं और रेशों के संश्लेषण में मध्यवर्ती के रूप में होता है।
एमीन कार्बनिक यौगिकों का एक महत्वपूर्ण वर्ग बनाते हैं, जिन्हें अमोनिया अणु के एक या अधिक हाइड्रोजन परमाणुओं को एल्किल/एरिल समूहों से प्रतिस्थापित करके प्राप्त किया जाता है। प्रकृति में, ये प्रोटीन, विटामिन, क्षार और हार्मोन में पाए जाते हैं। संश्लेषित उदाहरणों में बहुलक, रंगद्रव्य और औषधियाँ शामिल हैं। दो जैविक रूप से सक्रिय यौगिक, अर्थात् एड्रेनालिन और एफ़ेड्रिन, जिनमें द्वितीयक एमीनो समूह होता है, रक्तचाप बढ़ाने के लिए प्रयुक्त होते हैं। नोवोकेन, एक संश्लेषित एमीनो यौगिक, दंत चिकित्सा में एक संज्ञाहरण के रूप में प्रयुक्त होता है। बेनाड्रिल, एक प्रसिद्ध प्रतिहिस्टामिनिक औषधि, में भी तृतीयक एमीनो समूह होता है। चतुष्कोणीय अमोनियम लवण सर्फेक्टेंट के रूप में प्रयुक्त होते हैं। डायज़ोनियम लवण विभिन्न एरोमैटिक यौगिकों, जिनमें रंग शामिल हैं, की तैयारी में मध्यवर्ती होते हैं। इस इकाई में, आप एमीनों और डायज़ोनियम लवणों के बारे में सीखेंगे।
I. एमीन
एमीनों को अमोनिया के व्युत्पन्न माना जा सकता है, जिन्हें एक, दो या तीनों हाइड्रोजन परमाणुओं को एल्किल और/या एरिल समूहों से प्रतिस्थापित करके प्राप्त किया जाता है। उदाहरण के लिए:
$$ \mathrm{CH_3-NH_2, C_6H_5-NH_2, CH_3-NH-CH_3, CH_3-}\mathrm{N \langle \substack{{CH_3} \\ {CH_3}}} $$
13.1 एमीन की संरचना
अमोनिया की तरह, एमीनों का नाइट्रोजन परमाणु त्रिसंयोजी होता है और इसमें एक अनभाजित इलेक्ट्रॉन युग्म होता है। इसलिए, एमीनों में नाइट्रोजन कक्षक $s p^{3}$ संकरित होते हैं और एमीनों की ज्यामिति पिरामिडाकार होती है। नाइट्रोजन के तीनों $s p^{3}$ संकरित कक्षक हाइड्रोजन या कार्बन के कक्षकों से अतिव्यापन करते हैं, जो एमीनों की संरचना पर निर्भर करता है। सभी एमीनों में नाइट्रोजन का चौथा कक्षक एक अनभाजित इलेक्ट्रॉन युग्म रखता है। अनभाजित इलेक्ट्रॉन युग्म की उपस्थिति के कारण, कोण $\mathrm{C}-\mathrm{N}-\mathrm{E}$, (जहाँ $\mathrm{E}$
$\mathrm{C}$ या $\mathrm{H}$ है) $109.5^{\circ}$ से कम होता है; उदाहरण के लिए, यह ट्राइमेथिलएमीन में $108^{\circ}$ है, जैसा कि चित्र 13.1 में दिखाया गया है।

चित्र 13.1 ट्राइमेथिलएमीन की पिरामिडाकार आकृति
13.2 वर्गीकरण
एमीनों को प्राथमिक $\left(1^{\circ}\right)$, द्वितीयक $\left(2^{\circ}\right)$ और तृतीयक $\left(3^{\circ}\right)$ इस आधार पर वर्गीकृत किया जाता है कि अमोनिया अणु में कितने हाइड्रोजन परमाणुओं को एल्किल या एरिल समूहों द्वारा प्रतिस्थापित किया गया है। यदि अमोनिया का एक हाइड्रोजन परमाणु $\mathrm{R}$ या $\mathrm{Ar}$ द्वारा प्रतिस्थापित होता है, तो हमें $\mathrm{RNH_2}$ या $\mathrm{ArNH_2}$ प्राप्त होता है, जो एक प्राथमिक एमीन (10) है। यदि अमोनिया के दो हाइड्रोजन परमाणु या $\mathrm{R}-\mathrm{NH_2}$ का एक हाइड्रोजन परमाणु किसी अन्य एल्किल/एरिल (R’) समूह द्वारा प्रतिस्थापित होता है, तो आपको क्या मिलेगा? आपको R-NHR’, द्वितीयक एमीन मिलता है। दूसरा एल्किल/एरिल समूह समान या भिन्न हो सकता है। एक और हाइड्रोजन परमाणु का एल्किल/एरिल समूह द्वारा प्रतिस्थापन तृतीयक एमीन के निर्माण की ओर ले जाता है। एमीनों को ‘सरल’ कहा जाता है जब सभी एल्किल या एरिल समूह समान होते हैं, और ‘मिश्रित’ जब वे भिन्न होते हैं।

13.3 नामकरण
सामान्य पद्धति में, एक ऐलिफैटिक ऐमीन का नाम ऐमीन से पहले एल्किल समूह लगाकर रखा जाता है, अर्थात् एल्किलऐमीन एक शब्द के रूप में (जैसे मेथिलऐमीन)। द्वितीयक और तृतीयक ऐमीनों में, जब दो या अधिक समूह समान हों, तो एल्किल समूह के नाम से पहले उपसर्ग डाई या ट्राई लगाया जाता है। IUPAC पद्धति में, प्राथमिक ऐमीनों को अल्केनऐमीन के रूप में नामित किया जाता है। नाम इस प्रकार प्राप्त किया जाता है कि अल्केन के ’e’ को शब्द ऐमीन से प्रतिस्थापित किया जाता है। उदाहरण के लिए, $\mathrm{CH_3} \mathrm{NH_2}$ को मेथेनऐमीन कहा जाता है। यदि मूल श्रृंखला में एक से अधिक अमीनो समूह विभिन्न स्थानों पर उपस्थित हों, तो उनके स्थानों को उन कार्बन परमाणुओं को संख्याएँ देकर निर्दिष्ट किया जाता है जो $-\mathrm{NH_2}$ समूह धारण करते हैं और उपयुक्त उपसर्ग जैसे डाई, ट्राई आदि ऐमीन से जोड़ा जाता है। हाइड्रोकार्बन भाग के प्रत्यय का अक्षर ’e’ बरकरार रखा जाता है। उदाहरण के लिए, $\mathrm{H_2} \mathrm{~N}-\mathrm{CH_2}-\mathrm{CH_2}-\mathrm{NH_2}$ को एथेन-1,2-डायअमीन कहा जाता है।
द्वितीयक और तृतीयक ऐमीनों को नाम देने के लिए, हम लोकैंट $\mathrm{N}$ का उपयोग करते हैं ताकि नाइट्रोजन परमाणु से जुड़े प्रतिस्थापक को निर्दिष्ट किया जा सके। उदाहरण के लिए, $\mathrm{CH_3} \mathrm{NHCH_2} \mathrm{CH_3}$ को $\mathrm{N}$-मेथिलेथेनऐमीन और $\left(\mathrm{CH_3} \mathrm{CH_2}\right)_{3} \mathrm{~N}$ को $\mathrm{N}, \mathrm{N}$-डाइथिलेथेनऐमीन कहा जाता है। अधिक उदाहरण टेबल 13.1 में दिए गए हैं।
आरिलएमीनों में, $-\mathrm{NH_2}$ समूह सीधे बेंजीन वलय से संबद्ध होता है। $\mathrm{C_6} \mathrm{H_5} \mathrm{NH_2}$ आरिलएमीन का सबसे सरल उदाहरण है। सामान्य पद्धति में इसे ऐनिलीन कहा जाता है। यह IUPAC द्वारा स्वीकृत नाम भी है। IUPAC पद्धति के अनुसार आरिलएमीनों का नामकरण करते समय ऐरीन के ’ $\mathrm{e}$ ’ प्रत्यय को ‘एमीन’ से प्रतिस्थापित किया जाता है। इस प्रकार IUPAC पद्धति में $\mathrm{C_6} \mathrm{H_5}-\mathrm{NH_2}$ को बेन्ज़ेनऐमीन कहा जाता है। कुछ एल्किलएमीनों और आरिलएमीनों के सामान्य तथा IUPAC नाम तालिका 13.1 में दिए गए हैं।
तालिका 13.1: कुछ एल्किलएमीनों और आरिलएमीनों की नामकरण

13.4 एमीनों की तैयारी
एमीनों को निम्नलिखित विधियों द्वारा तैयार किया जाता है:
1. नाइट्रो यौगिकों का अपचयन
नाइट्रो यौगिकों को अपचयित कर एमीन बनाई जाती है, हाइड्रोजन गैस को बारीक विभाजित निकल, पैलेडियम या प्लेटिनम की उपस्थिति में प्रवाहित करके तथा अम्लीय माध्यम में धातुओं द्वारा अपचयन करके भी। नाइट्रोएल्केनों को भी इसी प्रकार संगत एल्केनऐमीनों में अपचयित किया जा सकता है।

लोहे की कतरन और हाइड्रोक्लोरिक अम्ल द्वारा अपचयन को प्राथमिकता दी जाती है क्योंकि बनने वाला $\mathrm{FeCl_2}$ जलअपघटित होकर अभिक्रिया के दौरान हाइड्रोक्लोरिक अम्ल मुक्त करता है। इस प्रकार अभिक्रिया प्रारंभ करने के लिए केवल थोड़ी मात्रा में हाइड्रोक्लोरिक अम्ल की आवश्यकता होती है।
2. एल्किल हैलाइडों का अमोनोलिसिस
आपने पढ़ा है (इकाई 6, कक्षा XII) कि एल्किल या बेंज़िल हैलाइड में कार्बन-हैलोजन बंध एक न्यूक्लियोफाइल द्वारा आसानी से विदलित हो सकता है। इसलिए, एल्किल या बेंज़िल हैलाइड अमोनिया के एथेनॉलिक विलयन के साथ अभिक्रिया करते समय न्यूक्लियोफिल प्रतिस्थापन अभिक्रिया करता है जिसमें हैलोजन परमाणु एक अमीनो $\left(-\mathrm{NH_2}\right)$ समूह से प्रतिस्थापित हो जाता है। अमोनिया अणु द्वारा $\mathrm{C}-\mathrm{X}$ बंध के इस विदलन की प्रक्रिया को अमोनोलिसिस कहा जाता है। यह अभिक्रिया 373 K पर एक सीलबंद नली में की जाती है। इस प्रकार प्राप्त प्राथमिक अमीन एक न्यूक्लियोफाइल के रूप में व्यवहार करता है और आगे चलकर एल्किल हैलाइड के साथ अभिक्रिया करके द्वितीयक और तृतीयक अमीनों का निर्माण कर सकता है, और अंततः चतुष्क अमोनियम लवण बनाता है।

मुक्त अमीन को अमोनियम लवण से एक प्रबल क्षार के साथ उपचार द्वारा प्राप्त किया जा सकता है: अमीनों के साथ हैलाइडों की अभिक्रियाशीलता का क्रम RI > RBr > RCl है।
$$\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3} \stackrel{-}{\mathrm{X}}+\mathrm{NaOH} \rightarrow \mathrm{R}-\mathrm{NH_2}+\mathrm{H_2} \mathrm{O}+\stackrel{+}{\mathrm{Na}} \stackrel{-}{\mathrm{X}}$$
अमोनोलिसिस का दोष यह है कि इससे प्राथमिक, द्वितीयक और तृतीयक अमीनों का मिश्रण प्राप्त होता है और साथ ही एक चतुष्क अमोनियम लवण भी। हालांकि, अमोनिया की बड़ी अधिकता लेने पर प्राथमिक अमीन मुख्य उत्पाद के रूप में प्राप्त होता है।
उदाहरण 13.1 निम्नलिखित अभिक्रियाओं के लिए रासायनिक समीकरण लिखिए:
(i) एथेनॉलिक (\mathrm{NH_3}) का (\mathrm{C_2} \mathrm{H_5} \mathrm{Cl}) के साथ अभिक्रिया।
(ii) बेंज़िल क्लोराइड का अमोनोलिसिस और इससे बनने वाले ऐमीन की दो मोल (\mathrm{CH_3} \mathrm{Cl}) के साथ अभिक्रिया।
हल

3. नाइट्राइल्स का अपचयन
नाइट्राइल्स लिथियम ऐल्यूमिनियम हाइड्राइड (\left(\mathrm{LiAlH_4}\right)) या उत्प्रेरकीय हाइड्रोजनेशन से अपचयित होकर प्राथमिक ऐमीन देते हैं। यह अभिक्रिया ऐमीन श्रेणी के आरोहण के लिए प्रयोग की जाती है, अर्थात् प्रारंभिक ऐमीन से एक कार्बन परमाणु अधिक वाले ऐमीन की तैयारी के लिए।
$$ \mathrm{R}-\mathrm{C} \equiv \mathrm{N} \xrightarrow[\mathrm{Na}(\mathrm{Hg}) / \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH}]{\mathrm{H} _{2} / \mathrm{Ni}} \mathrm{R}-\mathrm{CH} _{2}-\mathrm{NH} _{2}$$
4. ऐमाइड्स का अपचयन
ऐमाइड्स लिथियम ऐल्यूमिनियम हाइड्राइड से अपचयित होकर ऐमीन देते हैं।

5. गेब्रियल फ़थैलिमाइड संश्लेषण
गैब्रियल संश्लेषण का उपयोग प्राथमिक ऐमीनों की तैयारी के लिए किया जाता है। फ़्थैलिमाइड को एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ उपचारित करने पर फ़्थैलिमाइड का पोटैशियम लवण बनता है, जिसे अल्किल हैलाइड के साथ गर्म करने के बाद क्षारीय जल-अपघटन कराने पर संगत प्राथमिक ऐमीन प्राप्त होती है। ऐरोमैटिक प्राथमिक ऐमीनों को इस विधि द्वारा तैयार नहीं किया जा सकता क्योंकि ऐरिल हैलाइड फ़्थैलिमाइड द्वारा बने ऐनियन के साथ नाभिकस्नेही प्रतिस्थापन नहीं करते।

6. हॉफ़मान ब्रोमऐमाइड अपघटन अभिक्रिया
हॉफ़मान ने एक ऐमाइड को ब्रोमीन के साथ सोडियम हाइड्रॉक्साइड के जलीय या एथेनॉलिक विलयन में उपचारित कर प्राथमिक ऐमीन तैयार करने की एक विधि विकसित की। इस अपघटन अभिक्रिया में, ऐमाइड के कार्बोनिल कार्बन से एक अल्किल या ऐरिल समूह नाइट्रोजन परमाणु की ओर विस्थापित होता है। इस प्रकार बनी ऐमीन में कार्बन की संख्या ऐमाइड में मौजूद कार्बन से एक कम होती है।
$$ \mathrm{R}-\stackrel{\mathrm{O}}{\stackrel{\text{||}}{\mathrm{C}}}-\mathrm{NH_2}+\mathrm{Br_2}+4 \mathrm{NaOH} \longrightarrow \mathrm{R}-\mathrm{NH_2}+\mathrm{Na_2} \mathrm{CO_3}+2 \mathrm{NaBr}+2 \mathrm{H_2} \mathrm{O} $$
उदाहरण 9.2 निम्न रूपांतरणों के लिए रासायनिक समीकरण लिखिए:
(i) $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{Cl}$ से $\mathrm{CH} _{3}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{NH} _{2}$
(ii) (\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{CH} _{2}-\mathrm{Cl}) से (\mathrm{C} _{6} \mathrm{H} _{5}-\mathrm{CH} _{2}-\mathrm{CH} _{2}-\mathrm{NH} _{2})
हल

उदाहरण 9.3 संरचनाएँ और IUPAC नाम लिखिए
(i) उस एमाइड का जो हॉफमान ब्रोमामाइड अभिक्रिया द्वारा प्रोपेनामाइन देता है।
(ii) वह ऐमीन जो बेंज़ैमाइड के हॉफमान अपघटन से बनती है।
हल
(i) प्रोपेनामाइन में तीन कार्बन होते हैं। इसलिए, एमाइड अणु में चार कार्बन परमाणु होने चाहिए। चार कार्बन परमाणुओं वाले प्रारंभिक एमाइड की संरचना और IUPAC नाम नीचे दिए गए हैं:

(ii) बेंज़ैमाइड एक सात कार्बन परमाणुओं वाला एरोमैटिक एमाइड है। इसलिए, बेंज़ैमाइड से बनने वाली ऐमीन छह कार्बन परमाणुओं वाली एरोमैटिक प्राथमिक ऐमीन होती है।

13.5 भौतिक गुण
निचले ऐलिफैटिक ऐमीन मछली जैसी गंध वाली गैसें होती हैं। तीन या अधिक कार्बन परमाणुओं वाले प्राथमिक ऐमीन द्रव होते हैं और अभी भी अधिक कार्बन वाले ठोस होते हैं। ऐनिलीन और अन्य एरिलऐमीन सामान्यतः रंगहीन होते हैं लेकिन वायुमंडलीय ऑक्सीकरण के कारण संग्रहण पर रंगीन हो जाते हैं।
निम्न एलिफैटिक ऐमीन जल में घुलनशील होते हैं क्योंकि वे जल अणुओं के साथ हाइड्रोजन बंध बना सकते हैं। हालांकि, ऐमीन के मोलर द्रव्यमान में वृद्धि के साथ घुलनशीलता घटती है क्योंकि हाइड्रोफोबिक एल्किल भाग का आकार बढ़ता है। उच्च ऐमीन मूल रूप से जल में अघुलनशील होते हैं। ऐमीन के नाइट्रोजन और एल्कोहल के ऑक्सीजन की विद्युतऋणता को क्रमशः 3.0 और 3.5 मानते हुए, आप ऐमीन और एल्कोहल की जल में घुलनशीलता की प्रवृत्ति की भविष्यवाणी कर सकते हैं। ब्यूटेन-1-ऑल और ब्यूटेन-1-ऐमीन में से कौन जल में अधिक घुलनशील होगा और क्यों? ऐमीन एल्कोहल, ईथर और बेंजीन जैसे कार्बनिक विलायकों में घुलनशील होते हैं। आपको याद होगा कि एल्कोहल ऐमीन की तुलना में अधिक ध्रुवीय होते हैं और ऐमीन की तुलना में मजबूत अंतरअणुक हाइड्रोजन बंध बनाते हैं।
प्राथमिक और द्वितीयक ऐमीन अंतरअणुक संघनन में लगे होते हैं क्योंकि एक के नाइट्रोजन और दूसरे अणु के हाइड्रोजन के बीच हाइड्रोजन बंध बनता है। यह अंतरअणुक संघनन प्राथमिक ऐमीन में द्वितीयक ऐमीन की तुलना में अधिक होता है क्योंकि इसमें हाइड्रोजन बंध निर्माण के लिए दो हाइड्रोजन परमाणु उपलब्ध होते हैं। तृतीयक ऐमीन में हाइड्रोजन बंध निर्माण के लिए उपलब्ध हाइड्रोजन परमाणु की अनुपस्थिति के कारण अंतरअणुक संघनन नहीं होता है। इसलिए समावयवी ऐमीन के क्वथनांक का क्रम इस प्रकार है:
प्राथमिक > द्वितीयक > तृतीयक प्राथमिक ऐमीन में अंतरअणुक हाइड्रोजन बंधन को चित्र 13.2 में दिखाया गया है।
तालिका 13.2: समान अणुभार वाले ऐमीन, एल्कोहल और एल्केन के क्वथनांक की तुलना
| क्र. सं. | यौगिक | मोलर द्रव्यमान | क्वथनांक/के |
|---|---|---|---|
| 1. | $\mathrm{n}-\mathrm{C}_4 \mathrm{H}_9 \mathrm{NH}_2$ | 73 | 350.8 |
| 2. | $\left(\mathrm{C}_2 \mathrm{H}_5\right)_2 \mathrm{NH}$ | 73 | 329.3 |
| 3. | $\mathrm{C}_2 \mathrm{H}_5 \mathrm{~N}^{-}\left(\mathrm{CH}_3\right)_2$ | 73 | 310.5 |
| 4. | $\mathrm{C}_2 \mathrm{H}_5 \mathrm{CH}\left(\mathrm{CH}_3\right)_2$ | 72 | 300.8 |
| 5. | $\mathrm{n}-\mathrm{C}_4 \mathrm{H}_9 \mathrm{OH}$ | 74 | 390.3 |
13.6 रासायनिक अभिक्रियाएँ
नाइट्रोजन और हाइड्रोजन परमाणुओं के बीच विद्युतऋणता में अंतर और नाइट्रोजन परमाणु पर अयुग्मित इलेक्ट्रॉन युग्म की उपस्थिति एमीनों को क्रियाशील बनाती है। नाइट्रोजन परमाणु से जुड़े हाइड्रोजन परमाणुओं की संख्या भी एमीनों की अभिक्रिया की दिशा तय करती है; इसीलिए प्राथमिक $\left(-\mathrm{NH_2}\right)$, द्वितीयक $(\ \mathrm{~N}-\mathrm{H})$ और तृतीयक एमीन $(-\mathrm{N}-)$ कई अभिक्रियाओं में भिन्न व्यवहार करती हैं। इसके अतिरिक्त, अयुग्मित इलेक्ट्रॉन युग्म की उपस्थिति के कारण एमीन न्यूक्लियोफाइल के रूप में व्यवहार करती हैं। एमीनों की कुछ अभिक्रियाएँ नीचे वर्णित हैं:
1. एमीनों की क्षारीय प्रकृति
एमीनें, प्रकृति में क्षारीय होने के कारण, अम्लों के साथ अभिक्रिया कर लवण बनाती हैं।

एमीन लवणों को $\mathrm{NaOH}$ जैसे क्षार के साथ उपचारित करने पर मूल एमीन पुनः प्राप्त होती है।
$$ \stackrel{+}{\mathrm{RN_3}} \stackrel{-}{\mathrm{X}}+\stackrel{-}{\mathrm{O}} \mathrm{H} \longrightarrow \mathrm{R \ddot{N}H_2}+\mathrm{H_2} \mathrm{O}+\overline{\mathrm{X}} $$.
एमीन लवण जल में विलेय होते हैं परन्तु ईथर जैसे कार्बनिक विलायकों में अविलेय होते हैं। यह अभिक्रिया जल में अविलेय अ-क्षारीय कार्बनिक यौगिकों से एमीनों के पृथक्करण का आधार है।
खनिज अम्लों के साथ एमीनों की अभिक्रिया अमोनियम लवण बनाती है, जिससे यह दिखता है कि ये क्षारीय प्रकृति के होते हैं। एमीनों में नाइट्रोजन पर एक अयुग्मित इलेक्ट्रॉन युग्म होता है जिसके कारण ये लुइस क्षार के समान व्यवहार करते हैं। एमीनों की क्षारीय प्रकृति को उनके $K_{b}$ और $\mathrm{p} K_{b}$ मानों के संदर्भ में बेहतर समझा जा सकता है जैसा नीचे समझाया गया है:
$$ \begin{aligned} & \mathrm{R}-\mathrm{NH_2}+\mathrm{H_2} \mathrm{O} \rightleftarrows \stackrel{+}{\rightleftarrows} \mathrm{R}-\stackrel{-}{\mathrm{N}} \mathrm{H_3} \\ & K=\frac{\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3}\right][\stackrel{\mathrm{O}}{\mathrm{H}}]}{\left[\mathrm{R}-\mathrm{NH_2}\right]\left[\mathrm{H_2} \mathrm{O}\right]} \\ & \text { या } K\left[\mathrm{H_2} \mathrm{O}\right]=\frac{\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3}\right][\stackrel{-}{\mathrm{O}}]}{\left[\mathrm{R}-\mathrm{NH_2}\right]} \\ & \text { या } \quad K_{b}=\frac{\left[\mathrm{R}-\stackrel{+}{\mathrm{N}} \mathrm{H_3}\right][\stackrel{-}{\mathrm{O}} \mathrm{H}]}{\left[\mathrm{R}-\mathrm{NH_2}\right]} \\ & \mathrm{pK_b}=-\log \mathrm{K_b} \end{aligned} $$
$K_{b}$ का मान जितना बड़ा होगा या $\mathrm{p} K_{b}$ का मान जितना छोटा होगा, आधार उतना ही मजबूत होगा। कुछ ऐमीनों के $\mathrm{p} K_{b}$ मान तालिका 13.3 में दिए गए हैं।
अमोनिया का $\mathrm{p} K_{b}$ मान 4.75 है। ऐलिफैटिक ऐमीनें अमोनिया की तुलना में मजबूत आधार होती हैं क्योंकि एल्किल समूहों का $+\mathrm{I}$ प्रभाव नाइट्रोजन परमाणु पर उच्च इलेक्ट्रॉन घनत्व को बढ़ाता है। इनका $\mathrm{p} K_{b}$ मान 3 से 4.22 की सीमा में होता है। दूसरी ओर, एरोमैटिक ऐमीनें अमोनिया की तुलना में कमजोर आधार होती हैं क्योंकि एरिल समूह इलेक्ट्रॉन खींचने वाला होता है।
तालिका 13.3: जलीय चरण में ऐमीनों के pKb मान
| ऐमीन का नाम | pK |
|---|---|
| मेथेनऐमीन | 3.38 |
| $N$-मेथिलमेथेनऐमीन | 3.27 |
| $N, N$-डाइमेथिलमेथेनऐमीन | 4.22 |
| एथेनऐमीन | 3.29 |
| $N$-एथिलएथेनऐमीन | 3.00 |
| $N, N$-डाइएथिलएथेनऐमीन | 3.25 |
| बेन्ज़ेनऐमीन | 9.38 |
| फ़ेनिलमेथेनऐमीन | 4.70 |
| $N$-मेथिलऐनिलीन | 9.30 |
| $N, N$-डाइमेथिलऐनिलीन | 8.92 |
आप ऐमीनों में मौजूद प्रतिस्थापकों के $+\mathrm{I}$ या $-\mathrm{I}$ प्रभाव के आधार पर $K_{b}$ मानों की व्याख्या करने की कोशिश करते समय कुछ विसंगतियाँ पा सकते हैं। प्रेरण प्रभाव के अलावा, अन्य प्रभाव जैसे विलयन प्रभाव, स्थानिक अवरोध आदि भी ऐमीनों की आधारिक शक्ति को प्रभावित करते हैं। बस विचार कीजिए। आपको उत्तर निम्नलिखित अनुच्छेदों में मिल सकता है।
ऐमीनों की संरचना-आधारिकता संबंध
एमीनों की क्षारकता उनकी संरचना से संबंधित होती है। किसी एमीन का क्षारक स्वभाव इस बात पर निर्भर करता है कि अम्ल से प्रोटॉन ग्रहण करके धनायन बनाने में कितनी आसानी होती है। जितना अधिक स्थिर धनायन एमीन की तुलना में होता है, एमीन उतनी ही अधिक क्षारक होती है।
(a) एल्केनामीन बनाम अमोनिया
आइए उनकी क्षारकता की तुलना करने के लिए किसी एल्केनामीन और अमोनिया की प्रोटॉन के साथ अभिक्रिया पर विचार करें।

अल्किल समूह की इलेक्ट्रॉन-रिलीज़ प्रकृति के कारण वह $(R)$ नाइट्रोजन की ओर इलेक्ट्रॉन धकेलता है और इस प्रकार अनियत इलेक्ट्रॉन युग्म को अम्ल के प्रोटॉन के साथ साझा करने के लिए अधिक उपलब्ध बना देता है। इसके अतिरिक्त, ऐमीन से बना प्रतिस्थापित अमोनियम आयन, अल्किल समूह के $+I$ प्रभाव द्वारा धनात्मक आवेश के फैलाव के कारण स्थिर हो जाता है। इसलिए, अल्किलऐमीन अमोनिया की तुलना में अधिक प्रबल क्षारक होते हैं। इस प्रकार, एलिफैटिक ऐमीनों की क्षारक प्रकृति अल्किल समूहों की संख्या में वृद्धि के साथ बढ़नी चाहिए। यह प्रवृत्ति गैसीय प्रावस्था में देखी जाती है। गैसीय प्रावस्था में ऐमीनों की क्षारकता का क्रम अपेक्षित क्रम का अनुसरण करता है: तृतीयक ऐमीन > द्वितीयक ऐमीन > प्राथमिक ऐमीन > $\mathrm{NH_3}$। जलीय प्रावस्था में यह प्रवृत्ति नियमित नहीं है जैसा कि तालिका 13.3 में दिए गए उनके $\mathrm{p} K_{b}$ मानों से स्पष्ट है। जलीय प्रावस्था में, प्रतिस्थापित अमोनियम धनायन न केवल अल्किल समूह के इलेक्ट्रॉन-रिलीज़ प्रभाव (+I) द्वारा स्थिर होते हैं, बल्कि जल अणुओं के साथ विलेयन द्वारा भी स्थिर होते हैं। आयन का आकार जितना अधिक होगा, विलेयन उतना ही कम होगा और आयन उतना ही कम स्थिर होगा। आयनों की स्थिरता का क्रम इस प्रकार है:

प्रतिस्थापित अमोनियम कैटायन की स्थिरता जितनी अधिक होगी, संबंधित ऐमीन एक आधार के रूप में उतनी ही मजबूत होनी चाहिए। इस प्रकार, एलिफैटिक ऐमीनों की क्षारकता का क्रम होना चाहिए: प्राथमिक > द्वितीयक > तृतीयक, जो प्रेरक प्रभाव (inductive effect) पर आधारित क्रम के विपरीत है। दूसरे, जब अल्किल समूह छोटा होता है, जैसे $-\mathrm{CH_3}$ समूह, तो $\mathrm{H}$-बंधन में कोई स्टेरिक अवरोध नहीं होता है। यदि अल्किल समूह $\mathrm{CH_3}$ समूह से बड़ा होता है, तो $\mathrm{H}$-बंधन में स्टेरिक अवरोध होगा। इसलिए, अल्किल समूह की प्रकृति में परिवर्तन, उदाहरण के लिए, $-\mathrm{CH_3}$ से $-\mathrm{C_2} \mathrm{H_5}$ में परिवर्तन, क्षारक शक्ति के क्रम में परिवर्तन का कारण बनता है। इस प्रकार, प्रेरक प्रभाव, विलयन प्रभाव और अल्किल समूह की स्टेरिक बाधा के बीच एक सूक्ष्म परस्पर क्रिया होती है जो जलीय अवस्था में अल्किल ऐमीनों की क्षारक शक्ति को निर्धारित करती है। मिथाइल-प्रतिस्थापित ऐमीनों और एथिल-प्रतिस्थापित ऐमीनों की जलीय विलयन में क्षारक शक्ति का क्रम इस प्रकार है:
$$ \begin{aligned} & \left(\mathrm{C_2} \mathrm{H_5}\right)_2 \mathrm{NH}>\left(\mathrm{C_2} \mathrm{H_5}\right)_3 \mathrm{~N}>\mathrm{C_2} \mathrm{H_5} \mathrm{NH_2}>\mathrm{NH_3} \\ & \left(\mathrm{CH_3}\right)_2 \mathrm{NH}>\mathrm{CH_3} \mathrm{NH_2}>\left(\mathrm{CH_3}\right)_3 \mathrm{~N}>\mathrm{NH_3} \end{aligned} $$
(b) एरिलऐमीन बनाम अमोनिया
एनिलीन का $\mathrm{p} K_{b}$ मान काफी अधिक होता है। ऐसा क्यों है? इसका कारण यह है कि एनिलीन या अन्य एरिलऐमिनों में, $-\mathrm{NH_2}$ समूह सीधे बेंजीन वलय से जुड़ा होता है। इससे नाइट्रोजन पर मौजूद अनयुग्मित इलेक्ट्रॉन युग्म बेंजीन वलय के साथ संयुग्मन में चला जाता है और इस प्रकार यह प्रोटोनेशन के लिए कम उपलब्ध होता है। यदि आप एनिलीन के विभिन्न अनुनादी संरचनाएँ लिखें, तो आप पाएँगे कि एनिलीन निम्नलिखित पाँच संरचनाओं का अनुनादी मिश्रण है।

दूसरी ओर, एक प्रोटॉन ग्रहण करके बना एनिलीनियम आयन के पास केवल दो अनुनादी संरचनाएँ (केकुले) हो सकती हैं।

हम जानते हैं कि अनुनादी संरचनाओं की संख्या जितनी अधिक होती है, स्थिरता उतनी ही अधिक होती है। इस प्रकार आप निष्कर्ष निकाल सकते हैं कि एनिलीन (पाँच अनुनादी संरचनाएँ) एनिलीनियम आयन की तुलना में अधिक स्थिर है। इसलिए, एनिलीन या अन्य एरोमैटिक ऐमिनों की प्रोटॉन ग्रहण करने की क्षमता या क्षारीय प्रकृति अमोनिया की तुलना में कम होगी। प्रतिस्थापित एनिलीन के मामले में यह देखा गया है कि इलेक्ट्रॉन देने वाले समूह जैसे $-\mathrm{OCH_3},-\mathrm{CH_3}$ क्षारीयता बढ़ाते हैं जबकि इलेक्ट्रॉन खींचने वाले समूह जैसे $-\mathrm{NO_2},-\mathrm{SO_3} \mathrm{H}$, $-\mathrm{COOH},-\mathrm{X}$ इसे घटाते हैं।
उदाहरण 13.2 निम्नलिखित को उनकी क्षारीयता के घटते क्रम में व्यवस्थित कीजिए:
$\mathrm{C_6} \mathrm{H_5} \mathrm{NH_2}, \mathrm{C_2} \mathrm{H_5} \mathrm{NH_2},\left(\mathrm{C_2} \mathrm{H_5}\right)_{2} \mathrm{NH}, \mathrm{NH_3}$
हल उपरोक्त ऐमीनों और अमोनिया की क्षारकीय शक्ति का घटता क्रम निम्नलिखित क्रम का अनुसरण करता है:
$\left(\mathrm{C_2} \mathrm{H_5}\right)_{2} \mathrm{NH}>\mathrm{C_2} \mathrm{H_5} \mathrm{NH_2}>\mathrm{NH_3}>\mathrm{C_6} \mathrm{H_5} \mathrm{NH_2}$
2. ऐल्किलेशन
ऐमीनें, ऐल्किल हैलाइडों के साथ अभिक्रिया कर ऐल्किलेशन करती हैं (कक्षा XII, इकाई 10 देखें)।
3. ऐसिलेशन
ऐलिफैटिक और ऐरोमैटिक प्राथमिक और द्वितीयक ऐमीनें अम्ल क्लोराइडों, ऐनहाइड्राइडों और एस्टरों के साथ न्यूक्लियोफिलिक प्रतिस्थापन अभिक्रिया करती हैं। इस अभिक्रिया को ऐसिलेशन कहा जाता है। आप इस अभिक्रिया को $-\mathrm{NH_2}$ या $>\mathrm{N}-\mathrm{H}$ समूह के हाइड्रोजन परमाणु के ऐसिल समूह द्वारा प्रतिस्थापन के रूप में देख सकते हैं। ऐसिलेशन अभिक्रिया द्वारा प्राप्त उत्पादों को ऐमाइड कहा जाता है। यह अभिक्रिया एक ऐसे क्षारक की उपस्थिति में की जाती है जो ऐमीन से अधिक प्रबल होता है, जैसे पिरिडिन, जो बनने वाले $\mathrm{HCl}$ को हटाकर साम्य को दाहिनी ओर स्थानांतरित करता है।

ऐमीनें बेंज़ॉयल क्लोराइड $\left(\mathrm{C_6} \mathrm{H_5} \mathrm{COCl}\right)$ के साथ भी अभिक्रिया करती हैं। इस अभिक्रिया को बेंज़ॉयलेशन कहा जाता है।
$$\underset{\text{मेथेनामाइन}}{\mathrm{CH_3} \mathrm{NH_2}}+\underset{\text{बेंज़ॉयल क्लोराइड}}{\mathrm{C_6} \mathrm{H_5} \mathrm{COCl}} \longrightarrow \underset{\text{N-मेथिलबेंज़ामाइड}}{\mathrm{CH_3} \mathrm{NHCOC_6} \mathrm{H_5}}+\mathrm{HCl}$$
आपके विचार में एमीनों की कार्बोक्सिलिक अम्लों के साथ प्रतिक्रिया का उत्पाद क्या होता है? वे कमरे के तापमान पर एमीनों के साथ लवण बनाते हैं।
4. कार्बाइलामाइन अभिक्रिया
एलिफैटिक और एरोमैटिक प्राथमिक एमीनों को क्लोरोफॉर्म और एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ गरम करने पर आइसोसायनाइड या कार्बाइलामाइन बनते हैं जो बदबूदार पदार्थ होते हैं। द्वितीयक और तृतीयक एमीन यह अभिक्रिया नहीं दिखाते। इस अभिक्रिया को कार्बाइलामाइन अभिक्रिया या आइसोसायनाइड परीक्षण कहा जाता है और यह प्राथमिक एमीनों की जांच के लिए प्रयुक्त होता है।
$ \mathrm{R-NH_2 + CHCl_3+ 3KOH} \xrightarrow[]{Heat} \mathrm{R-NC} + \mathrm{KCL+3H_2O} $
5. नाइट्रस अम्ल के साथ अभिक्रिया
तीनों वर्गों की एमीनें नाइट्रस अम्ल के साथ भिन्न-भिन्न प्रकार से प्रतिक्रिया करती हैं, जिसे खनिज अम्ल और सोडियम नाइट्राइट से in situ तैयार किया जाता है।
(a) प्राथमिक एलिफैटिक एमीनें नाइट्रस अम्ल के साथ प्रतिक्रिया कर एलिफैटिक डाइऐज़ोनियम लवण बनाती हैं जो अस्थिर होते हैं, मात्रात्मक रूप से नाइट्रोजन गैस और एल्कोहल मुक्त करते हैं। नाइट्रोजन की मात्रात्मक निकासी का उपयोग अमीनो अम्लों और प्रोटीनों के आकलन में किया जाता है।
$$ \mathrm{R}-\mathrm{NH_2}+\mathrm{HNO_2} \xrightarrow{\mathrm{NaNO_2}+\mathrm{HCl}}\left[\mathrm{R}-\stackrel{+}{\mathrm{N_2}}-\overline{\mathrm{Cl}}\right] \xrightarrow{\mathrm{H_2} \mathrm{O}} \mathrm{ROH}+\mathrm{N_2}+\mathrm{HCl} $$
(b) सुगंधित ऐमीन निम्न तापमान (273-278 K) पर नाइट्रस अम्ल के साथ अभिक्रिया कर डाइजोनियम लवण बनाती हैं, जो एक अत्यंत महत्वपूर्ण वर्ग के यौगिक हैं जिनका उपयोग अनुच्छेद 13.7 में वर्णित विभिन्न सुगंधित यौगिकों के संश्लेषण के लिए किया जाता है।
$$ \underset{\text { ऐनिलिन }}{\mathrm{C_6} \mathrm{H_5}-\mathrm{NH_2}} \xrightarrow{\stackrel{\mathrm{NaNO_2}+2 \mathrm{HCl}}{273-278 \mathrm{~K}}} \underset{\begin{array}{c} \text { बेन्ज़ीनडाइजोनियम } \\ \text { क्लोराइड } \end{array}}{\mathrm{C_6} \mathrm{H_5}-\stackrel{+}{\mathrm{N}} \mathrm{C_2} \overline{\mathrm{Cl}}+\mathrm{NaCl}}+2 \mathrm{H_2} \mathrm{O} $$
6. एरिलसल्फोनिल क्लोराइड के साथ अभिक्रिया
बेन्ज़ीनसल्फोनिल क्लोराइड $\left(\mathrm{C_6} \mathrm{H_5} \mathrm{SO_2} \mathrm{Cl}\right)$, जिसे हिन्सबर्ग अभिकर्मक भी कहा जाता है, प्राथमिक और द्वितीयक ऐमीनों के साथ अभिक्रिया कर सल्फोनैमाइड बनाता है।
(a) बेन्ज़ीनसल्फोनिल क्लोराइड की प्राथमिक ऐमीन के साथ अभिक्रिया से $\mathrm{N}$-एथिलबेन्ज़ीनसल्फोनिल ऐमाइड प्राप्त होता है।
सल्फोनैमाइड में नाइट्रोजन से जुड़ा हाइड्रोजन शक्तिशाली इलेक्ट्रॉन आकर्षित करने वाले सल्फोनिल समूह की उपस्थिति के कारण अत्यधिक अम्लीय होता है। इसलिए, यह क्षार में विलेय होता है।
(b) द्वितीयक ऐमीन के साथ अभिक्रिया में, $\mathrm{N}, \mathrm{N}$-डाइएथिलबेन्ज़ीनसल्फोनैमाइड बनता है।

चूँकि N, N-डाइएथिलबेन्ज़ीन सल्फोनैमाइड में नाइट्रोजन पर कोई हाइड्रोजन परमाणु नहीं होता, यह अम्लीय नहीं होता और इसलिए क्षार में अविलेय होता है।
(c) तृतीयक एमीन बेंजीनसल्फोनिल क्लोराइड के साथ अभिक्रिया नहीं करती हैं। एमीनों की इस विशेषता, जिसमें वे बेंजीनसल्फोनिल क्लोराइड के साथ भिन्न-भिन्न तरीकों से अभिक्रिया करती हैं, का उपयोग प्राथमिक, द्वितीयक और तृतीयक एमीनों के भेद करने और एमीनों के मिश्रण को पृथक करने के लिए किया जाता है। हालाँकि, आजकल बेंजीनसल्फोनिल क्लोराइड के स्थान पर p-टॉलूईनसल्फोनिल क्लोराइड का प्रयोग किया जाता है।
7. इलेक्ट्रॉन-स्नेही प्रतिस्थापन
आपने पहले पढ़ा है कि ऐनिलिन पाँच संरचनाओं का अनुनादी मिश्रण है। इन संरचनाओं में अधिकतम इलेक्ट्रॉन घनत्व आपको कहाँ मिलता है? $-\mathrm{NH_2}$ समूह के ऑर्थो- और पैरा-स्थान उच्च इलेक्ट्रॉन घनत्व के केंद्र बन जाते हैं। इस प्रकार $-\mathrm{NH_2}$ समूह ऑर्थो और पैरा निर्देशक और एक शक्तिशाली सक्रियकारी समूह है।
(a) ब्रोमिनेशन: ऐनिलिन कमरे के तापमान पर ब्रोमीन जल के साथ अभिक्रिया कर 2,4,6-ट्राइब्रोमोऐनिलिन का सफेद अवक्षेप देती है।

एरोमैटिक एमीनों की इलेक्ट्रॉन-स्नेही प्रतिस्थापन अभिक्रियाओं के दौरान सामने आने वाली मुख्य समस्या उनकी अत्यधिक अभिक्रियाशीलता है। प्रतिस्थापन ऑर्थो- और पैरा-स्थानों पर होने की प्रवृत्ति रखता है। यदि हमें मोनोसब्स्टिट्यूटेड ऐनिलिन व्युत्पन्न तैयार करना हो, तो $-\mathrm{NH_2}$ समूह की सक्रियकारी प्रभाव को कैसे नियंत्रित किया जा सकता है? यह $-\mathrm{NH_2}$ समूह को एसीटिक एनहाइड्राइड के साथ एसीटिलन कर संरक्षित करके, फिर वांछित प्रतिस्थापन करके और अंत में प्रतिस्थापित एमाइड को जल अपघटन द्वारा प्रतिस्थापित एमीन में बदलकर किया जा सकता है।

एसिटैनिलाइड के नाइट्रोजन पर मौजूद एकाकी इलेक्ट्रॉन युग्म ऑक्सीजन परमाणु से अनुनाद के कारण निम्यानुसार संपर्क करता है:
इसलिए, नाइट्रोजन पर मौजूद एकाकी इलेक्ट्रॉन युग्म बेंजीन वलय को अनुनाद द्वारा दान करने के लिए कम उपलब्ध होता है। इसलिए $-\mathrm{NHCOCH_3}$ समूह की सक्रिय करने वाली प्रभावता अमीनो समूह से कम होती है।
(b) नाइट्रेशन: ऐनिलाइन का प्रत्यक्ष नाइट्रेशन नाइट्रो व्युत्पन्नों के अतिरिक्त काले ऑक्सीकरण उत्पाद भी देता है। इसके अतिरिक्त, अत्यधिक अम्लीय माध्यम में ऐनिलाइन प्रोटोनित होकर ऐनिलिनियम आयन बनाता है जो मेटा निर्देशक होता है। यही कारण है कि ऑर्थो और पेरा व्युत्पन्नों के अतिरिक्त महत्वपूर्ण मात्रा में मेटा व्युत्पन्न भी बनता है।

हालांकि, $-\mathrm{NH_2}$ समूह को एसेटिक ऐनहाइड्राइड के साथ एसिटिलेशन अभिक्रिया द्वारा सुरक्षित करके नाइट्रेशन अभिक्रिया को नियंत्रित किया जा सकता है और $p$-नाइट्रो व्युत्पन्न को मुख्य उत्पाद के रूप में प्राप्त किया जा सकता है।

(c) सल्फोनेशन: ऐनिलाइन सान्द्र सल्फ्यूरिक अम्ल के साथ अभिक्रिया कर ऐनिलिनियम हाइड्रोजनसल्फेट बनाता है जिसे सल्फ्यूरिक अम्ल के साथ $453-473 \mathrm{~K}$ पर गर्म करने पर $\mathrm{p}$-ऐमीनोबेंजीन सल्फोनिक अम्ल, जिसे सामान्यतः सल्फैनिलिक अम्ल कहा जाता है, मुख्य उत्पाद के रूप में प्राप्त होता है।

ऐनिलीन ऐल्युमिनियम क्लोराइड—जो कि लुइस अम्ल है और उत्प्रेरक के रूप में प्रयुक्त होता है—के साथ लवण बनाने के कारण फ्राइडल-क्राफ्ट्स अभिक्रिया (एल्किलेशन और एसिटिलेशन) नहीं देता है। इसके कारण ऐनिलीन का नाइट्रोजन धनात्मक आवेश प्राप्त कर लेता है और आगे की अभिक्रिया के लिए एक प्रबल निष्क्रियकारी समूह के रूप में कार्य करता है।
II. डाइऐज़ोनियम लवण
डाइऐज़ोनियम लवणों का सामान्य सूत्र $\mathrm{R}^{+}{ _2} \overline{\mathrm{X}}$ होता है, जहाँ $\mathrm{R}$ एक ऐरिल समूह को दर्शाता है और $\overline{\mathrm{X}}$ आयन $\mathrm{Cl}^{-} \mathrm{Br}^{-}, \mathrm{HSO_4}^{-}, \mathrm{BF_4}^{-}$ आदि हो सकता है। इनका नामकरण मूल हाइड्रोकार्बन के नाम के बाद ‘डाइऐज़ोनियम’ प्रत्यय लगाकर और तदुपरान्त ऋणायन जैसे क्लोराइड, हाइड्रोजनसल्फेट आदि के नाम से किया जाता है। $\stackrel{+}{\mathrm{N}} 2$ समूह को डाइऐज़ोनियम समूह कहा जाता है। उदाहरणस्वरूप, $\mathrm{C_6} \mathrm{H_5} \stackrel{+}{\mathrm{N_2}} \mathrm{C}$ को बेन्ज़ीनडाइऐज़ोनियम क्लोराइड और $\mathrm{C_6} \mathrm{H_5} \mathrm{~N_2}^{+} \mathrm{HSO_4}^{-}$ को बेन्ज़ीनडाइऐज़ोनियम हाइड्रोजनसल्फेट कहा जाता है।
प्राथमिक ऐलिफैटिक ऐमीन अत्यंत अस्थिर ऐल्किलडाइऐज़ोनियम लवण बनाते हैं (कृपया खण्ड 13.6 देखें)। प्राथमिक ऐरोमैटिक ऐमीन ऐरीनडाइऐज़ोनियम लवण बनाते हैं जो निम्न तापमान (273-278 K) पर विलयन में थोड़े समय के लिए स्थिर रहते हैं। ऐरीनडाइऐज़ोनियम आयन की स्थिरता का व्याख्यान अनुनाद के आधार पर किया गया है।

13.7 डाइज़ोनियम लवणों की तैयारी की विधि
बेंज़ीनडाइज़ोनियम क्लोराइड को ऐनिलीन की नाइट्रस अम्ल के साथ $273-278 \mathrm{~K}$ पर अभिक्रिया करके तैयार किया जाता है। नाइट्रस अम्ल अभिक्रिया मिश्रण में सोडियम नाइट्राइट और हाइड्रोक्लोरिक अम्ल की अभिक्रिया से उत्पन्न होता है। प्राथमिक एरोमैटिक ऐमीनों को डाइज़ोनियम लवणों में बदलने की प्रक्रिया को डाइज़ोटाइज़ेशन कहा जाता है। इसकी अस्थिरता के कारण, डाइज़ोनियम लवण को आमतौर पर संग्रहीत नहीं किया जाता है और इसे तैयार करने के तुरंत बाद उपयोग में लाया जाता है।
$$ \mathrm{C_6} \mathrm{H_5} \mathrm{NH_2}+\mathrm{NaNO_2}+2 \mathrm{HCl} \xrightarrow{273-278 \mathrm{~K}} \mathrm{C_6} \mathrm{H_5} \stackrel{+}{\mathrm{N}}{ _2}^{-} \overline{\mathrm{Cl}}+\mathrm{NaCl}+2 \mathrm{H_2} \mathrm{O} $$
13.8 भौतिक गुण
बेंज़ीनडाइज़ोनियम क्लोराइड एक रंगहीन क्रिस्टलीय ठोस है। यह पानी में आसानी से घुलनशील है और ठंडे में स्थिर रहता है लेकिन गरम करने पर पानी के साथ अभिक्रिया करता है। यह शुष्क अवस्था में आसानी से विघटित हो जाता है। बेंज़ीनडाइज़ोनियम फ्लोरोबोरेट पानी में अघुलनशील होता है और कमरे के तापमान पर स्थिर रहता है।
13.9 रासायनिक अभिक्रियाएँ
डाइज़ोनियम लवणों की अभिक्रियाओं को मोटे तौर पर दो श्रेणियों में बाँटा जा सकता है, अर्थात् (A) नाइट्रोजन के विस्थापन से संबंधित अभिक्रियाएँ और (B) डाइज़ो समूह के संरक्षण से संबंधित अभिक्रियाएँ।
A. नाइट्रोजन के विस्थापन से सम्बन्धित अभिक्रियाएँ
डाइज़ोनियम समूह, एक अत्यंत उत्तम निर्गम समूह होने के कारण, अन्य समूहों जैसे $\mathrm{Cl}^{-}$, $\mathrm{Br}^{-}$, $\mathrm{I}^{-}$, $\mathrm{CN}^{-}$ और $\mathrm{OH}^{-}$ द्वारा प्रतिस्थापित हो जाता है, जो एरोमैटिक वलय से नाइट्रोजन को विस्थापित करते हैं। बनने वाली नाइट्रोजन गैस के रूप में अभिक्रिया मिश्रण से बाहर निकल जाती है।
1. हैलाइड या सायनाइड आयन द्वारा प्रतिस्थापन: $\mathrm{Cl}^{-}$, $\mathrm{Br}^{-}$ और $\mathrm{CN}^{-}$ न्यूक्लोफाइल्स $\mathrm{Cu}(\mathrm{I})$ आयन की उपस्थिति में बेंजीन वलय में सरलता से प्रवेश कर सकते हैं। इस अभिक्रिया को सैंडमेयर अभिक्रिया कहा जाता है।
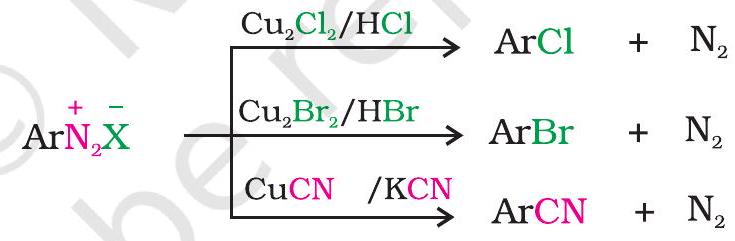
वैकल्पिक रूप से, क्लोरीन या ब्रोमीन को कॉपर पाउडर की उपस्थिति में संगत हैलोजन अम्ल के साथ डाइज़ोनियम लवण विलयन के उपचार से भी बेंजीन वलय में प्रवेश कराया जा सकता है। इसे गैटरमैन अभिक्रिया कहा जाता है।

सैंडमेयर अभिक्रिया में प्राप्त उत्पाद की मात्रा गैटरमैन अभिक्रिया की तुलना में बेहतर पाई जाती है।
2. आयोडाइड आयन द्वारा प्रतिस्थापन: आयोडीन को सीधे बेंजीन वलय में प्रवेश कराना सरल नहीं होता, परंतु जब डाइज़ोनियम लवण विलयन को पोटैशियम आयोडाइड के साथ उपचारित किया जाता है, तो आयोडोबेंजीन बनता है।
$\stackrel{+}{\mathrm{ArN}} \overline{\mathrm{Cl}}+\mathrm{HBF}_4 \rightarrow \mathrm{Ar}-\stackrel{+}{\mathrm{N}} \mathrm{BF}_4 \xrightarrow{\Delta} \mathrm{Ar}-\mathrm{F}+\mathrm{BF}_3+\mathrm{N}_2$
3. फ्लोराइड आयन द्वारा प्रतिस्थापन: जब एरीनडाइज़ोनियम क्लोराइड को फ्लोरोबोरिक अम्ल के साथ उपचारित किया जाता है, तो एरीन डाइज़ोनियम फ्लोरोबोरेट अवक्षेपित होता है जो कि गर्म करने पर विघटित होकर एरील फ्लोराइड देता है।
$$ \mathrm{Ar} _{2}^{+} \overline{\mathrm{Cl}}+\mathrm{HBF} _{4} \longrightarrow \mathrm{Ar}-\stackrel{+}{\mathrm{N}} _{2} \mathrm{BF} _{4} \xrightarrow{\Delta} \mathrm{Ar}-\mathrm{F}+\mathrm{BF} _{3}+\mathrm{N} _{2} $$
4. H द्वारा प्रतिस्थापन: कुछ हल्के अपचायक अभिकर्मक जैसे हाइपोफॉस्फोरस अम्ल (फॉस्फिनिक अम्ल) या एथेनॉल डाइज़ोनियम लवणों को एरीनों में अपचयित करते हैं और स्वयं क्रमशः फॉस्फोरस अम्ल और एथेनल में ऑक्सीकृत हो जाते हैं।
$\mathrm{Ar}_2^{+} \stackrel{+}{\mathrm{Cl}}+\mathrm{H}_3 \mathrm{PO}_2+\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{ArH}+\mathrm{N}_2+\mathrm{H}_3 \mathrm{PO}_3+\mathrm{HCl}$
$$ \begin{aligned} & \mathrm{ArN} _{2} \stackrel{+}{\mathrm{Cl}}+\mathrm{CH} _{3} \mathrm{CH} _{2} \mathrm{OH} \longrightarrow \mathrm{ArH}+\mathrm{N} _{2}+\mathrm{CH} _{3} \mathrm{CHO}+\mathrm{HCl} \end{aligned} $$
5. हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापन: यदि डाइज़ोनियम लवण विलयन के तापमान को 283 K तक बढ़ने दिया जाता है, तो लवण जल अपघटित होकर फ़ीनॉल बनाता है।
$$ \mathrm{Ar} _{2}^{+} \stackrel{-}{\mathrm{Cl}}+\mathrm{H} _{2} \mathrm{O} \longrightarrow \mathrm{ArOH}+\mathrm{N} _{2}+\mathrm{HCl} $$
6. $-\mathrm{NO} _{2}$ समूह द्वारा प्रतिस्थापन: जब डाइज़ोनियम फ्लोरोबोरेट को कॉपर की उपस्थिति में जलीय सोडियम नाइट्राइट विलयन के साथ गरम किया जाता है, तो डाइज़ोनियम समूह $-\mathrm{NO} _{2}$ समूह द्वारा प्रतिस्थापित हो जाता है।
बी. डाइज़ो समूह को बनाए रखने वाली अभिक्रियाएँ – युग्मन अभिक्रियाएँ
प्राप्त एज़ो उत्पादों में एक विस्तारित संयुग्मी तंत्र होता है जिसमें दोनों एरोमैटिक वलय $-\mathrm{N}=\mathrm{N}-$ बंध के माध्यम से जुड़े होते हैं। ये यौगिक प्रायः रंगीन होते हैं और रंगों के रूप में उपयोग किए जाते हैं। बेंजीन डाइज़ोनियम क्लोराइड फ़ीनॉल के साथ अभिक्रिया करता है जिसमें फ़ीनॉल अणु अपने पैरा स्थान पर डाइज़ोनियम लवण से युग्मित होकर $p$-हाइड्रॉक्सीएज़ोबेंजीन बनाता है। इस प्रकार की अभिक्रिया को युग्मन अभिक्रिया कहा जाता है। इसी प्रकार, डाइज़ोनियम लवण की एनिलीन के साथ अभिक्रिया $p$-एमिनोएज़ोबेंजीन देती है। यह एक इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया का उदाहरण है।

13.10 एरोमैटिक यौगिकों के संश्लेषण में डाइज़ोनियम लवणों का महत्व
उपरोक्त अभिक्रियाओं से यह स्पष्ट है कि डाइज़ोनियम लवण एरोमैटिक वलय में $-\mathrm{F},-\mathrm{Cl},-\mathrm{Br},-\mathrm{I},-\mathrm{CN},-\mathrm{OH}$, $-\mathrm{NO_2}$ समूहों को प्रस्तुत करने के लिए बहुत अच्छे मध्यवर्ती हैं।
एरिल फ्लुओराइड्स और आयोडाइड्स को प्रत्यक्ष हैलोजनीकरण द्वारा तैयार नहीं किया जा सकता। क्लोरोबेंजीन में क्लोरीन के न्यूक्लियोफिलिक प्रतिस्थापन द्वारा सायनो समूह को प्रस्तुत नहीं किया जा सकता, लेकिन सायनोबेंजीन को डायजोनियम लवण से आसानी से प्राप्त किया जा सकता है।
इस प्रकार, डायजो समूह को अन्य समूहों द्वारा प्रतिस्थापन उन प्रतिस्थापित एरोमैटिक यौगिकों को तैयार करने में सहायक होता है जिन्हें बेंजीन या प्रतिस्थापित बेंजीन में प्रत्यक्ष प्रतिस्थापन द्वारा तैयार नहीं किया जा सकता।
उदाहरण 13.3 आप 4-नाइट्रोटॉलूईन को 2-ब्रोमोबेंज़ोइक एसिड में कैसे परिवर्तित करेंगे?
हल

इनटेक्स्ट प्रश्न
9.9 रूपांतरण कीजिए
(i) 3-मेथिलएनिलीन को 3-नाइट्रोटॉलूईन में।
(ii) एनिलीन को 1,3,5-ट्राइब्रोमोबेंजीन में।
सारांश
एमाइनों को अमोनिया के ऐसे व्युत्पन्न माना जा सकता है जिनमें हाइड्रोजन परमाणुओं को एल्किल या ऐरिल समूहों से प्रतिस्थापित किया गया हो। अमोनिया के एक हाइड्रोजन परमाणु के प्रतिस्थापन से $\mathbf{R}-\mathbf{N H_2}$ प्रकार की संरचना उत्पन्न होती है, जिसे प्राथमिक एमाइन कहा जाता है। द्वितीयक एमाइनों की विशेषता $\mathbf{R_2} \mathbf{N H}$ या $\mathbf{R}-\mathbf{N H R}$ संरचना होती है और तृतीयक एमाइनों की $\mathbf{R_3} \mathbf{N}, \mathbf{R} \mathbf{R}^{\prime} \mathbf{R}^{\prime \prime}$ या $\mathbf{R_2} \mathbf{N} \mathbf{R}^{\prime}$ संरचना होती है। यदि एल्किल या ऐरिल समूह समान हों तो द्वितीयक और तृतीयक एमाइनों को सरल एमाइन कहा जाता है और यदि समूह भिन्न हों तो मिश्रित एमाइन कहा जाता है। अमोनिया की तरह, तीनों प्रकार के एमाइनों में नाइट्रोजन परमाणु पर एक अयुग्मित इलेक्ट्रॉन युग्म होता है जिसके कारण वे लुइस क्षारक के रूप में व्यवहार करते हैं।
एमिन्स आमतौर पर नाइट्रो यौगिकों, हैलाइडों, एमाइडों, इमाइडों आदि से बनते हैं। वे हाइड्रोजन बॉन्डिंग प्रदर्शित करते हैं जो उनके भौतिक गुणों को प्रभावित करती है। एल्किलएमिन्स में, इलेक्ट्रॉन रिलीज़ करने वाले, स्टेरिक और $\mathrm{H}$-बॉन्डिंग कारकों का संयोजन प्रोटिक ध्रुवीय विलायकों में प्रतिस्थापित अमोनियम कैटायन की स्थिरता को प्रभावित करता है और इस प्रकार एमिन्स की क्षारक प्रकृति को प्रभावित करता है। एल्किल एमिन्स अमोनिया की तुलना में मजबूत क्षारक पाए जाते हैं। एरोमैटिक एमिन्स में, इलेक्ट्रॉन रिलीज़ करने वाले और हटाने वाले समूह क्रमशः उनके क्षारक स्वभाव को बढ़ाते और घटाते हैं। ऐनिलीन अमोनिया की तुलना में एक कमजोर क्षारक है। एमिन्स की अभिक्रियाएं नाइट्रोजन पर उपलब्ध अनछुए इलेक्ट्रॉन युग्म की उपलब्धता द्वारा नियंत्रित होती हैं। नाइट्रोजन परमाणु पर हाइड्रोजन परमाणुओं की संख्या का अभिक्रिया के प्रकार और उत्पादों की प्रकृति पर प्रभाव प्राथमिक, द्वितीयक और तृतीयक एमिन्स की पहचान और भेद के लिए उत्तरदायी है। $p$-टॉलूईनसल्फोनिल क्लोराइड प्राथमिक, द्वितीयक और तृतीयक एमिन्स की पहचान के लिए प्रयोग किया जाता है। एरोमैटिक रिंग में एमिनो समूह की उपस्थिति एरोमैटिक एमिन्स की सक्रियता को बढ़ाती है। एरोमैटिक एमिन्स की सक्रियता को एसिलेशन प्रक्रिया द्वारा नियंत्रित किया जा सकता है, अर्थात् एसिटिल क्लोराइड या एसिटिक एनहाइड्राइड के साथ उपचारित करके। तृतीयक एमिन्स जैसे ट्राइमिथिलएमिन कीट आकर्षक के रूप में प्रयोग किए जाते हैं।
आरिलडाइज़ोनियम लवण, जो आमतौर पर आरिलएमीनों से प्राप्त किए जाते हैं, डाइज़ोनियम समूह की विभिन्न न्यूक्लियोफाइलों से प्रतिस्थापन से गुजरते हैं ताकि आरिल हैलाइड, सायनाइड, फ़ीनॉल और ऐरीन डाइज़ो समूह को अपचयनात्मक विलोपन द्वारा उत्पन्न करने के लिए लाभप्रद विधियाँ प्रदान की जा सकें। आरिलडाइज़ोनियम लवणों का फ़ीनॉल या आरिलएमीनों के साथ युग्मन अभिक्रिया एज़ो रंजकों के निर्माण को जन्म देती है।



