अध्याय 12 उपकरण और प्रौद्योगिकी
12.1 सूक्ष्मदर्शन (Microscopy)
जैविक अध्ययन और अन्वेषण सूक्ष्मदर्शी के बिना कल्पना भी नहीं किए जा सकते, क्योंकि यह हमें ऐसी वस्तुओं को देखने में सक्षम बनाता है जो हमारी आँखों की पहुँच से परे हैं। आज सूक्ष्मदर्शन तकनीक इतनी उन्नत हो गई है कि एक शोधकर्ता न केवल किसी अत्यंत सूक्ष्म संरचना का अत्यधिक आवर्धित (magnified) चित्र देख सकता है, बल्कि ऐसी वस्तुओं की त्रि-आयामी संरचना को भी देख सकता है। शक्तिशाली इलेक्ट्रॉन सूक्ष्मदर्शी तकनीकों का उपयोग करते हुए, जीवाणुओं और वायरसों के डीएनए अणुओं को भी देखा गया है।
पहले सूक्ष्मदर्शी का प्रयोग 1665 में हुआ था, जब ब्रिटिश भौतिकविद् रॉबर्ट हुक ने आवर्धक लेंसों के संयोजन का उपयोग करके एक सरल सूक्ष्मदर्शी बनाया (चित्र 12.1) और कॉर्क (cork) के टुकड़ों का अवलोकन किया, तथा उस छत्ते जैसी संरचना को ‘सेल्युलाए’ या ‘कोशिका’ (cell) नाम दिया। आप जानते हैं कि मैथियास जैकब श्लाइडन और थियोडोर श्वान ने 1838 में पौधों और जंतुओं में कोशिकाओं के अवलोकन के आधार पर कोशिका सिद्धांत (cell theory) प्रस्तुत किया था।
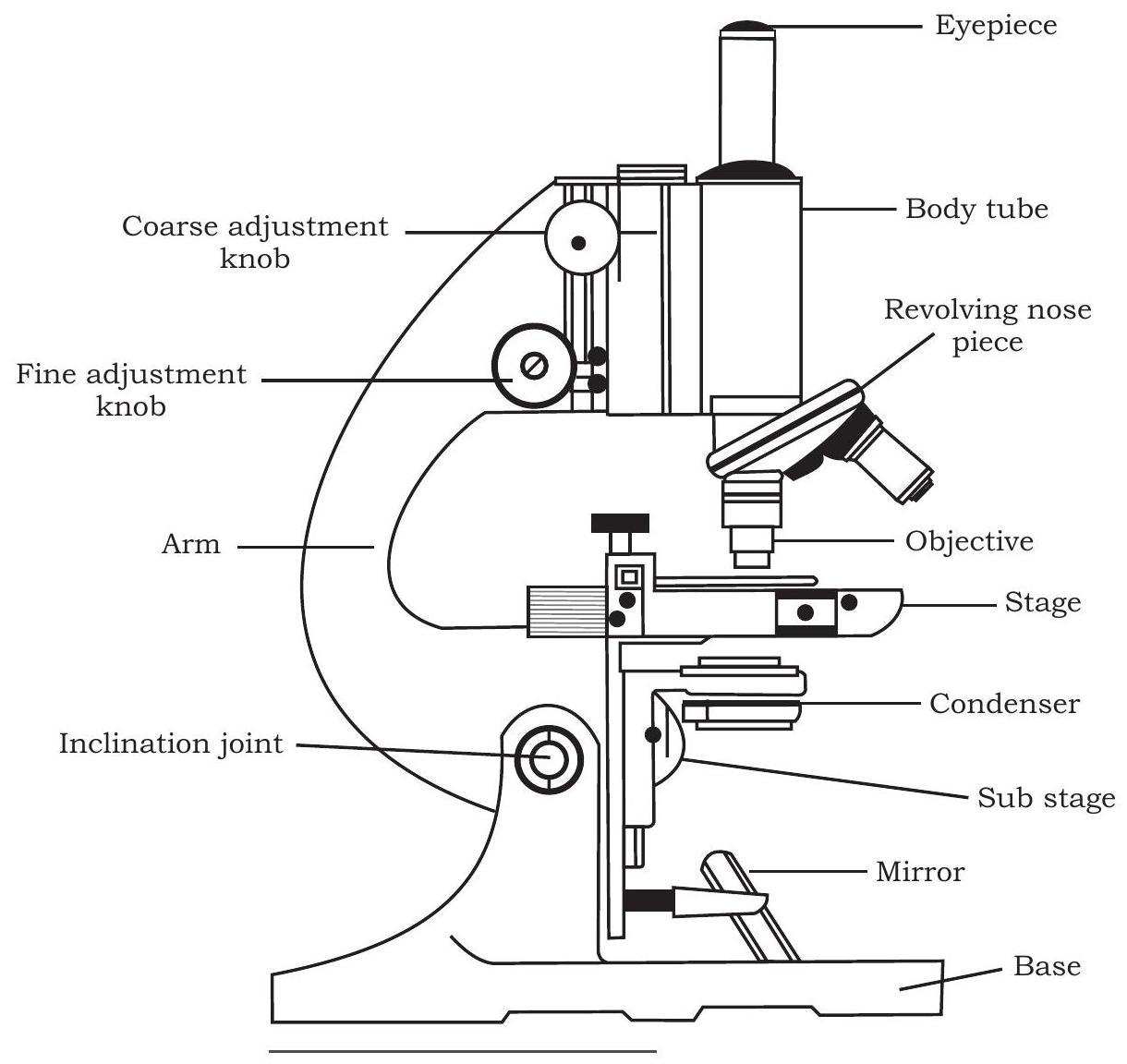
चित्र 12.1: सूक्ष्मदर्शी
12.1.1 आवर्धन (Magnification) और विभेदन (Resolution)
अब आइए सूक्ष्मदर्शन तकनीक पर आधारित सिद्धांत पर ध्यान केंद्रित करें। किसी प्रकाशिक यंत्र जैसे सूक्ष्मदर्शी के लिए दो प्रकाशिक गुण अत्यंत महत्वपूर्ण होते हैं। एक आवर्धन की क्षमता और दूसरा विभेदन की क्षमता।
सूक्ष्मदर्शी की आवर्धन या आवर्धन शक्ति वह क्षमता है जिससे रेटिना पर बनने वाली छवि का आकार बढ़ाया जा सकता है। इस प्रकार सरल शब्दों में आवर्धन है -
सूक्ष्मदर्शी की सहायता से रेटिना पर बनने वाली छवि का आकार सूक्ष्मदर्शी का उपयोग किए बिना रेटिना पर बनने वाली छवि का आकार
आपने भौतिकी में पढ़ा होगा कि किसी लेंस का आवर्धन (M) निम्नलिखित सूत्रों के अनुसार मापा जाता है (जिसमें $f$ लेंस की फोकस दूरी है और $d$ लेंस से वस्तु की दूरी है)।
$$ M=\frac{f}{f-d} $$
सामान्यतः, प्रयोगशाला में प्रयुक्त होने वाला सूक्ष्मदर्शी एक संयुक्त सूक्ष्मदर्शी होता है जिसमें दो सेट लेंस होते हैं। एक को उद्देश्य लेंस कहा जाता है, जो देखी जाने वाली वस्तु के निकट रहता है, और दूसरा आईपीस होता है जिससे प्रेक्षक देखता है। यह उल्लेख करना अनावश्यक है कि वस्तु, उद्देश्य लेंस, आईपीस और प्रेक्षक की आंख प्रकाश के पथ के लिए एक ही रेखा में होने चाहिए ताकि वस्तु की आवर्धित छवि देखी जा सके। सरल शब्दों में, सूक्ष्मदर्शी का आवर्धन उद्देश्य लेंस की आवर्धन शक्ति और आईपीस की आवर्धन शक्ति का गुणनफल होता है $\left(\mathrm{M} _{\mathrm{o}} \times \mathrm{M} _{\mathrm{e}}\right)$।
विवर्धन शक्ति सूक्ष्मदर्शी की एक अन्य महत्वपूर्ण संपत्ति है, जो एक-दूसरे के बहुत निकट स्थित दो वस्तुओं की पृथक छवियां बनाने की क्षमता है। इसे दो बिंदुओं के बीच की न्यूनतम दूरी से मापा जा सकता है।
12.1.2 प्रकाश सूक्ष्मदर्शी का कार्य
आपने पिछली कक्षा में यौगिक सूक्ष्मदर्शी की संरचना के बारे में पढ़ा है, फिर भी संक्षेप में दोहराने के लिए, जैसा कि आप चित्र 12.1 में देख सकते हैं, एक यौगिक सूक्ष्मदर्शी एक आधार पर होता है जिस पर एक स्टेज लगा होता है जिसके बीच में एक छिद्र होता है। आधार से एक भुजा जुड़ी होती है जिस पर एक बॉडी ट्यूब इस प्रकार लगी होती है कि वह स्टेज के छिद्र के साथ संरेखित होती है। बॉडी ट्यूब के निचले सिरे पर एक नोज पीस लगा होता है जिस पर दो से चार उद्देश्य लेंस हो सकते हैं। नोज पीस को घुमाकर, उद्देश्य लेंसों में से एक को स्टेज पर मौजूद छिद्र के ऊपर रखा जा सकता है जहाँ देखने वाली वस्तु को एक ग्लास स्लाइड पर रखा जाता है। बॉडी ट्यूब के ऊपरी सिरे पर एक आईपीस लगा होता है जिसके माध्यम से प्रेक्षक सूक्ष्मदर्शी के नीचे देख सकता है। भुजा पर समायोजन पेंच (मोटे और सूक्ष्म) होते हैं जो स्टेज पर मौजूद वस्तु से उद्देश्य लेंस की दूरी को समायोजित करने में सहायता करते हैं। स्टेज के नीचे, प्रकाश का एक स्रोत होता है (जो एक परावर्तक दर्पण या एक बल्ब हो सकता है जिससे वस्तु को रोशन किया जाता है और उद्देश्य लेंस और आईपीस के माध्यम से छवि के निर्माण में सहायता मिलती है)। इसके अतिरिक्त, प्रकाश स्रोत और स्टेज के बीच एक कंडेनसर होता है, जो वस्तु पर प्रकाश को केंद्रित करने के लिए महत्वपूर्ण है। चित्र 12.2 एक यौगिक सूक्ष्मदर्शी में प्रकाश के पथ को भी दर्शाता है। आपने देखा होगा कि उद्देश्य लेंस और आईपीस दोनों की आवर्धन शक्ति अलग-अलग होती है। एक छात्र सूक्ष्मदर्शी में आईपीस की आवर्धन शक्ति $10 \times$ या $15 x$ होती है और नोज पीस पर लगे विभिन्न उद्देश्य लेंसों की आवर्धन शक्ति $4 \times$, $10 x, 40 / 45 x$ और $100 x$ होती है। अभी-अभी चर्चा की गई सूक्ष्मदर्शी तकनीक को उज्ज्वल क्षेत्र सूक्ष्मदर्शी भी कहा जाता है क्योंकि देखने वाली वस्तु को रोशन करने के लिए प्रकाश का उपयोग किया जाता है। इसलिए, वस्तु के विभिन्न क्षेत्रों को पहचानने के लिए, उसे विशिष्ट रंजक या रंग से रंगा जाता है। कार्मिन, इओसिन, सेफ्रानिन, मेथिलीन ब्लू, जीम्सा, आदि, प्रकाश सूक्ष्मदर्शी के लिए प्रयुक्त कुछ ऐसे सामान्य रंजक हैं।
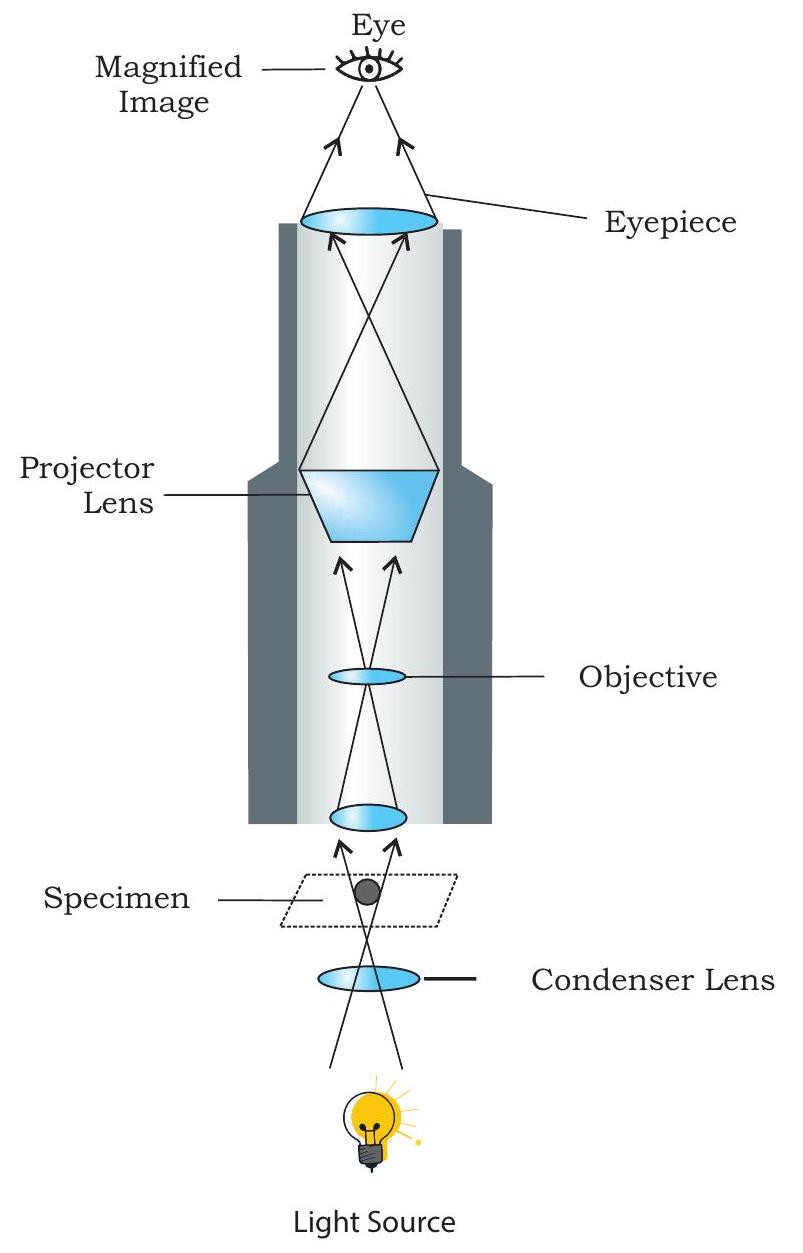
चित्र 12.2: लाइट माइक्रोस्कोप
12.1.3 सूक्ष्मदर्शन के विभिन्न रूप
ऊतकों / कोशिकाओं की आंतरिक संरचना के सूक्ष्म विवरणों का अध्ययन इतना विविध होता है कि इसे केवल प्रकाश सूक्ष्मदर्शी (light microscopy) से प्राप्त नहीं किया जा सकता। इसलिए, एक या अन्य प्रकार की चालाकी करके, काफी विविध प्रकार की सूक्ष्मदर्शी तकनीकों का उपयोग किया जाता है। एक ऐसी चालाकी में, केंद्रीय कंडेनसर से वस्तु पर पड़ने वाली प्रकाश को एक डिस्क द्वारा अवरुद्ध कर दिया जाता है और वस्तु का प्रकाशन एक तिरछी प्रकाश किरण द्वारा किया जाता है, जो स्लाइड से परावर्तित होती है और छवि को गहरे पृष्ठभूमि के विरुद्ध प्रकाशित किया जाता है। इसलिए, ऐसी सूक्ष्मदर्शी को डार्क फील्ड सूक्ष्मदर्शी (Dark Field Microscopy) कहा जाता है। माइटोकॉन्ड्रिया, केंद्रक, रिक्तिकाएँ आदि को इसका उपयोग करके आसानी से देखा जा सकता है। इसी प्रकार, एक अन्य प्रकार जिसे फेज कॉन्ट्रास्ट सूक्ष्मदर्शी (Phase Contrast Microscopy) कहा जाता है, में पारदर्शी वस्तु से गुजरने वाले प्रकाश की तरंग आयाम और चरण को बदला जाता है। यह परिवर्तन वस्तु या नमूने के किसी भाग के घनत्व पर निर्भर करता है। ऐसा परिवर्तन उस क्षेत्र में अधिक होता है जहाँ घनत्व तुलनात्मक रूप से अधिक होता है और इसके परिणामस्वरूप, वस्तु के विभिन्न क्षेत्रों में विविध कॉन्ट्रास्ट देखा जा सकता है। यह विशेष रूप से कोशिका अंगों और गुणसूत्रों के अध्ययन में सहायक होता है। वस्तु या नमूने को किसी विशिष्ट रंजक से रंगना नियमित रूप से किया जाता है। कुछ विशेष प्रकार के रंजक होते हैं, जैसे कि एक्रिडिन ऑरेंज, बिसबेंज़िमाइड, मेरोसायनिन (जिन्हें फ्लोरोफोर भी कहा जाता है)। ये रंजक प्रकाशित होने के बाद लंबी तरंगदैर्ध्य की प्रकाश उत्सर्जित करने में सक्षम होते हैं, जिस गुण को फ्लोरेसेंस कहा जाता है। इसके परिणामस्वरूप, फ्लोरोफोर से रंगी हुई वस्तु अधिक प्रकाशित और उपयोग किए गए रंजक के अनुसार भिन्न रंग की प्रतीत होती है। फ्लोरेसेंस सूक्ष्मदर्शी (fluorescence microscopy) में भी यही सिद्धांत लागू किया जाता है। देखी जाने वाली वस्तु को फ्लोरोफोर से रंगा जाता है ताकि किसी विशिष्ट अंगिका या अणु के भाग का अध्ययन किया जा सके। वस्तु को फ्लोरेसेंस सूक्ष्मदर्शी के अंतर्गत प्रकाशित करने के बाद, विशिष्ट रूप से रंगा गया क्षेत्र आसानी से देखा या अवलोकित किया जा सकता है। यह संक्रमण के कारण को जानने के लिए जीवाणुओं या वायरस की पहचान करने और प्रतिरक्षा निदान (immunodiagnosis) में सहायक होता है।
इलेक्ट्रॉन सूक्ष्मदर्शन एक अत्यंत परिष्कृत तकनीक है जिसमें अध्ययन किए जाने वाले वस्तु को इलेक्ट्रॉन किरण से बमबारी की जाती है जिसकी तरंगदैर्ध्य दृश्य प्रकाश की तुलना में लगभग $1,00,000$ गुना छोटी होती है। इलेक्ट्रॉन सूक्ष्मदर्शन में इलेक्ट्रॉन किरण विद्युतचुंबकीय लेंसों की सहायता से छवि को आवर्धित करती है। इलेक्ट्रॉन का संपूर्ण पथ निर्वात में होता है और उत्पन्न छवि को फ्लोरोसेंट स्क्रीन पर देखा जाता है, न कि आईपीस के माध्यम से। इलेक्ट्रॉन की अत्यंत छोटी तरंगदैर्ध्य के कारण, इलेक्ट्रॉन सूक्ष्मदर्शन द्वारा उत्पन्न छवि अत्यधिक उच्च संकल्प की होती है। दो प्रकार के इलेक्ट्रॉन सूक्ष्मदर्शन का उपयोग किया जाता है; संचरण इलेक्ट्रॉन सूक्ष्मदर्शन और स्कैनिंग इलेक्ट्रॉन सूक्ष्मदर्शन। संचरण इलेक्ट्रॉन सूक्ष्मदर्शन में, वस्तु या नमूने का अल्ट्रा-पतला भारी धातु लवण (सीसा, टंगस्टन आदि) लेपित खंड इस प्रकार रखा जाता है कि इलेक्ट्रॉन किरण उससे गुजरकर छवि बनाती है। इलेक्ट्रॉन सूक्ष्मदर्शन की दूसरी तकनीक में, वस्तु के सोने या प्लैटिनम लेपित सतह से परावर्तित इलेक्ट्रॉन किरण छवि बनाती है। इस तकनीक में, वस्तु की सतह की अत्यधिक आवर्धित और संकल्पित छवि उत्पन्न होती है, इसलिए इसे स्कैनिंग इलेक्ट्रॉन सूक्ष्मदर्शन कहा जाता है।
पिछले दो-तीन दशकों में, एक और अधिक परिष्कृत सूक्ष्म इमेजिंग तकनीक विकसित की गई है और उपयोग में लाई गई है जिसे कॉन्फोकल माइक्रोस्कोपी कहा जाता है। कॉन्फोकल माइक्रोस्कोपी स्थिर कोशिकाओं/ऊतकों के भीतर विस्तृत संरचनाओं को हल करने और वस्तुओं के तेज़ चित्र प्राप्त करने में उपयोगी है। कॉन्फोकल माइक्रोस्कोपी का उपयोग करके किसी वस्तु की जांच करने के लिए, पहले उसे फ्लोरोसेंटली लेबल किया जाता है और फिर उच्च रिज़ॉल्यूशन में कॉन्फोकल माइक्रोस्कोप के तहत विश्लेषण किया जाता है।
12.2 सेंट्रीफ्यूगेशन
आपने सभी जीवित जीवों की कोशिकाओं में मौजूद विभिन्न जैवअणुओं जैसे प्रोटीन, न्यूक्लिक अम्ल आदि के बारे में पढ़ा है। इन जैवअणुओं का अध्ययन करने के लिए, आपको इन्हें किसी न किसी पृथक्करण तकनीक का उपयोग करके अलग करना होता है। सेंट्रीफ्यूगेशन एक ऐसी ही तकनीक है जिसमें कणों या अणुओं को उनके घनत्व के आधार पर पृथक किया जाता है, गुरुत्वाकर्षण बल (g) के प्रभाव के तहत, उन्हें एक घोल में अक्ष के चारों ओर उच्च गति से घुमाकर अपकेन्द्र बल का उपयोग करके। उपयोग में आने वाले उपकरण को सेंट्रीफ्यूज (चित्र 12.3) कहा जाता है, जो इसके उपयोग के आधार पर विभिन्न प्रकार का होता है। इसमें एक आधार, एक घूर्णन कंटेनर (घूर्णन पात्र/रोटर) और एक ढक्कन होता है।
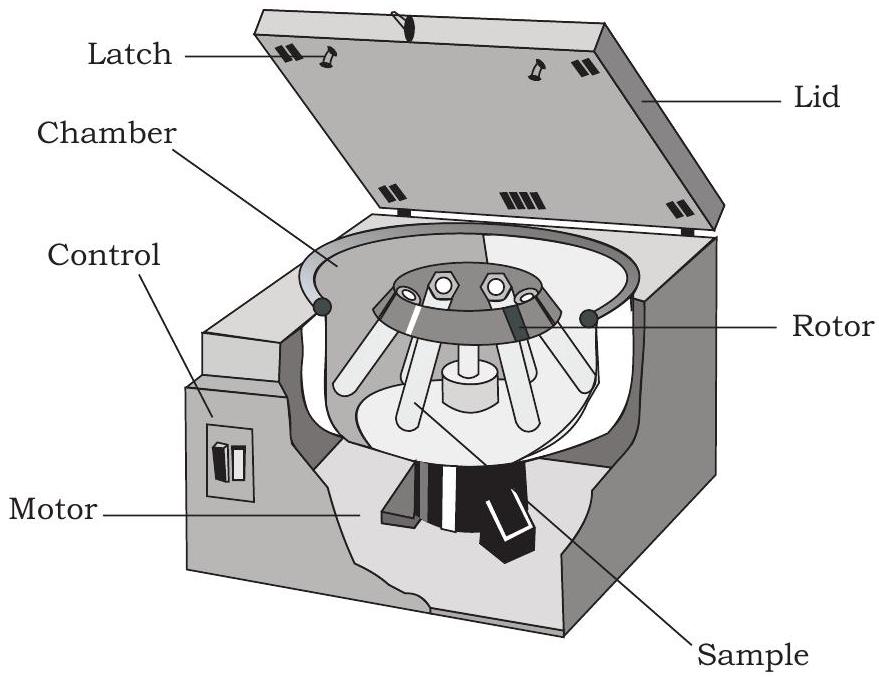
चित्र 12.3: सेंट्रीफ्यूज की मूलभूत संरचना
घूर्णन पात्र में कई सेंट्रीफ्यूज ट्यूब होते हैं। कोशिका अर्क या मिश्रण को सेंट्रीफ्यूज ट्यूबों में लिया जाता है और एक वांछित गति (प्रति मिनट चक्कर; rpm) पर एक निश्चित समय तक घूमने दिया जाता है जिससे कणीय पदार्थ सेंट्रीफ्यूज ट्यूबों के तल में बस जाता है।
12.2.1 अवसादन के मूलभूत सिद्धांत
अवसादन निलंबित कणों की उस प्रवृत्ति को कहते हैं जिससे वे जिस द्रव में फंसे हुए हैं उससे बाहर निकलकर किसी अवरोध के खिलाफ स्थिर हो जाते हैं। यह द्रव के माध्यम से उनकी गति के कारण होता है, जो उन पर काररत बलों के प्रतिसाद में होती है। ये बल गुरुत्वाकर्षण और केन्द्रापसारक बलों के कारण हो सकते हैं।
12.2.2 सेंट्रीफ्यूज के प्रकार
व्यावसायिक रूप से विभिन्न प्रकार के सेंट्रीफ्यूज उपलब्ध हैं। अनुसंधान उद्देश्यों के लिए सामान्यतः प्रयुक्त सेंट्रीफ्यूज हैं:
- टेबल टॉप/क्लिनिकल सेंट्रीफ्यूज या माइक्रोफ्यूज
- उच्च-गति सेंट्रीफ्यूज
- अल्ट्रासेंट्रीफ्यूज
- विभेदी सेंट्रीफ्यूज
बड़ी क्षमता वाले तैयारी सेंट्रीफ्यूज, उच्च गति वाले रेफ्रिजरेटेड सेंट्रीफ्यूज और अल्ट्रासेंट्रीफ्यूज मुख्य प्रकार के सेंट्रीफ्यूज हैं।
सिद्धांत और अनुप्रयोग के आधार पर, निम्नलिखित प्रकार की सेंट्रीफ्यूजेशन की जाती है-
विभेदी सेंट्रीफ्यूजेशन-यह विभिन्न आकार और घनत्व के कणों की अवसादन दर (केन्द्रापसारक बल) में अंतर पर आधारित है। इसका उपयोग बड़ी कोशिकीय संरचनाओं, केंद्रक अंश, माइटोकॉन्ड्रिया, क्लोरोप्लास्ट या बड़े प्रोटीन को पृथक करने के लिए किया जाता है।
घनता-प्रवण बलगुण केन्द्रापसारण—समान आकार परन्तु भिन्न घनता वाले जैविक कणों को पृथक् करने के लिए घनता-प्रवण बलगुण केन्द्रापसारण का उपयोग किया जा सकता है। इस प्रकार के केन्द्रापसारण में, केन्द्रापसारण नलिकाओं में एक घनता प्रवण बनाया जाता है। उनकी घनता के अनुसार, विभिन्न अणु विभिन्न स्तरों पर अवसादित होते हैं। भारी अणु बाहर की ओर चले जाते हैं और हल्के अणु नलिकाओं के भीतरी भाग में रहते हैं। घनता में जितना अधिक अंतर होगा, वे उतनी ही तेजी से चलते हैं।
अल्ट्रासेंट्रीफ्यूगेशन—जब केन्द्रापसारण बहुत उच्च चाल पर, अर्थात् $100,000 \mathrm{x} / \mathrm{g}$ या अधिक पर किया जाता है ताकि अणुओं को पृथक् किया जा सके, इसे अल्ट्रासेंट्रीफ्यूगेशन कहा जाता है। अल्ट्रासेंट्रीफ्यूज में, कोशिका को जैविक कणों के माध्यम से प्रकाश के पारगमन की अनुमति देनी होती है ताकि सांद्रता वितरण का उचित मापन किया जा सके।
12.3 वैद्युत्क्षोभ
वैद्युत्क्षोभ एक विधि है जिसमें विद्युत क्षेत्र के प्रभाव में बड़े अणुओं के आवेश-द्रव्यमान अनुपात के आधार पर पृथक्करण होता है। वैद्युत्क्षोभ एक ग्रीक शब्द है जिसका अर्थ है ‘इलेक्ट्रॉनों को वहन करना’। उपसर्ग इलेक्ट्रो विद्युत से सम्बन्धित है जो अणुओं को स्थानांतरित करने के लिए आवश्यक है और प्रत्यय फोरेसिस का अर्थ है ‘स्थानांतरण’ या ‘गति’। इसे सर्वप्रथम 1807 में रूसी प्राध्यापकों पीटर इवानोविच स्ट्राखोव और फर्डिनेंड फ्रेडरिक रॉयस ने देखा था। उन्होंने निरन्तर विद्युत क्षेत्र की उपस्थिति में पानी में विसरित मिट्टी के कणों के स्थानांतरण को देखा।
सिद्धांत
कई महत्वपूर्ण जैविक अणु जैसे न्यूक्लियोटाइड, डीएनए, आरएनए, पेप्टाइड और प्रोटीन आयनizable समूहों को धारण करते हैं, और इसलिए किसी दिए गए $\mathrm{pH}$ पर विलयन में विद्युत रूप से आवेशित प्रजातियों के रूप में मौजूद होते हैं, या तो कैटायन या एनायन के रूप में। एक विद्युत क्षेत्र के प्रभाव में, ये कण या तो कैथोड या एनोड की ओर अपनी शुद्ध आवेश के आधार पर प्रवास करेंगे।
किसी अणु की गतिशीलता इसके आकार के व्युत्क्रमानुपाती और इसके आवेश के अनुक्रमानुपाती होती है, जिससे उन्हें एक-दूसरे से अलग किया जा सकता है।
12.3.1 एगारोज जेल इलेक्ट्रोफोरेसिस
इस प्रकार की इलेक्ट्रोफोरेसिस में, जेल एगारोज अणुओं का एक आव्यूह होता है जो हाइड्रोजन बंधों द्वारा एक साथ बंधे होते हैं और छोटे छिद्र बनाते हैं। डीएनए पृथक्करण के लिए जेल अक्सर एक पॉलीसैकेराइड से बनाए जाते हैं जिसे एगारोज कहा जाता है, जो सूखे, पाउडर के रूप में आता है। जब एगारोज को बफर में गरम किया जाता है और ठंडा होने दिया जाता है, तो यह एक ठोस, थोड़ा नरम जेल बनाता है।
जेल एक जेली जैसी सामग्री की पट्टी होती है, जिसे एक जेल बॉक्स में रखा जाता है। बॉक्स के एक सिरे को सकारात्मक इलेक्ट्रोड से जोड़ा जाता है, जबकि दूसरे सिरे को नकारात्मक इलेक्ट्रोड से जोड़ा जाता है। जेल बॉक्स को एक नमक युक्त बफर विलयन से भरा जाता है जो धारा संचालित कर सकता है। जेल का वह सिरा जिसमें कुएं होते हैं, नकारात्मक इलेक्ट्रोड की ओर रखा जाता है। जेल का दूसरा सिरा सकारात्मक इलेक्ट्रोड की ओर रखा जाता है जिसकी ओर डीएनए खंड प्रवास करेंगे (चित्र 12.4)।
डीएनए अणु ऋणात्मक आवेशित होते। डीएनए खंडों की जेल इलेक्ट्रोफोरेसिस उन्हें केवल आकार के आधार पर अलग करती है। इलेक्ट्रोफोरेसिस का उपयोग करके, हम किसी नमूने में मौजूद विभिन्न डीएनए खंडों की जांच कर सकते हैं और उनका निरपेक्ष आकार निर्धारित कर सकते हैं।

चित्र 12.4: ज्ञात आकारों के डीएनए खंडों से बने डीएनए लैडर की सहायता से न्यूक्लिक अम्ल को अलग करने के लिए एगारोस जेल इलेक्ट्रोफोरेसिस यूनिट।
जब बिजली चालू की जाती है, तो धारा जेल के माध्यम से बहना शुरू हो जाती है। डीएनए अणुओं में उनकी शर्करा-फॉस्फेट बैकबोन में फॉस्फेट समूहों की उपस्थिति के कारण ऋणात्मक आवेश होता है; इसलिए, वे जेल के आधात्रि के माध्यम से धनात्मक इलेक्ट्रोड (ऐनोड) की ओर बढ़ते हैं।
एगारोस डीएनए जेल चलाने के लिए वोल्टेज $80-120 \mathrm{~V}$ की सीमा में होता है। जैसे ही विद्युत धारा लगाई जाती है, डीएनए के छोटे टुकड़े जेल आधात्रि के छिद्रों से बड़े टुकड़ों की तुलना में तेजी से गुजरते हैं। इस प्रकार डीएनए के सबसे लंबे टुकड़े कुओं के पास रहते हैं जबकि डीएनए के सबसे छोटे टुकड़े जेल के धनात्मक सिरे के पास होते हैं।
12.3.2 डीएनए खंडों का दृश्यीकरण
लक्ष्य DNA के दृश्यीकरण के लिए उपयोग किया जाने वाला उपकरण पराबैंगनी (UV) ट्रांस-इलूमिनेटर है। एथिडियम ब्रोमाइड (EtBr) संभवतः DNA के दृश्यीकरण के लिए उपयोग किया जाने वाला सबसे प्रसिद्ध रंजक है। इस रंजक को जेल मिश्रण में, इलेक्ट्रोफोरेसिस बफर में मिलाया जा सकता है या जेल चलाने के बाद उसे रंगा जा सकता है। EtBr के अणु DNA के आधारों के बीच इंटरकैलेट करते हैं और UV प्रकाश के तहत फ्लोरेस करते हैं। अपने लाभों के बावजूद, एथिडियम ब्रोमाइड एक संभावित कार्सिनोजन है, इसलिए इसे सावधानीपूर्वक संभालना चाहिए
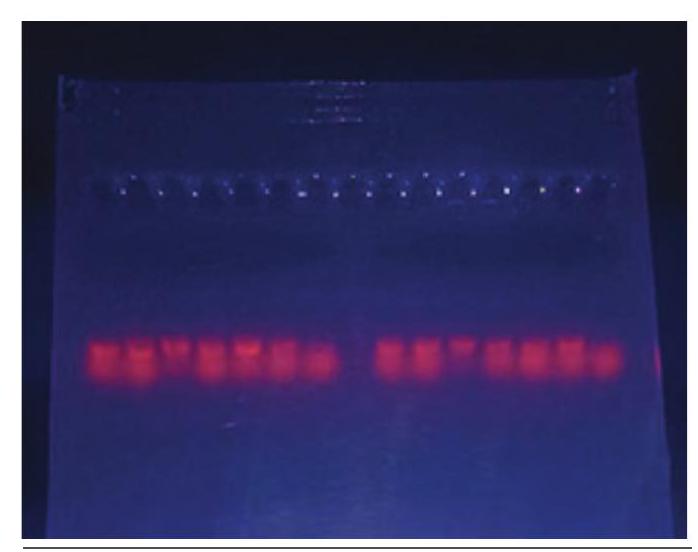
चित्र 12.5: UV प्रकाश के तहत DNA बैंडों का दृश्यीकरण बहुत सावधानी के साथ (चित्र 12.5).
12.3.3 पॉलिएक्रिलएमाइड जेल इलेक्ट्रोफोरेसिस (PAGE)
PAGE एक विश्लेषणात्मक विधि है जिसे प्रोटीन मिश्रण के घटकों को उनके आकार के आधार पर अलग करने के लिए उपयोग किया जाता है। प्रोटीन अणुओं को एकसमान आवेश प्रदान करने के लिए, एक ऋणात्मक डिटर्जेंट जिसे सोडियम डोडेसिल सल्फेट (SDS) कहा जाता है, का उपयोग प्रोटीनों को बांधने और उन्हें ऋणात्मक आवेश देने के लिए किया जाता है। फिर प्रोटीनों को एक विद्युत क्षेत्र में पॉलिएक्रिलएमाइड से बने जेल मैट्रिक्स का उपयोग करके उनके आकार के अनुसार इलेक्ट्रोफोरेटिक रूप से अलग किया जाता है।
पॉलिएक्रिलामाइड एक उत्प्रेरक का उपयोग करके एक्रिलामाइड और $\mathrm{N}, \mathrm{N}^{\prime}-$ मेथिलीन-बिस-एक्रिलामाइड (BIS) के बीच बहुलकीकरण अभिक्रिया के परिणामस्वरूप उत्पन्न होता है। बहुलकीकरण या क्रॉस-लिंकिंग की डिग्री को एक्रिलामाइड और BIS की सांद्रता को समायोजित करके नियंत्रित किया जा सकता है। जितनी अधिक क्रॉस-लिंकिंग होगी, जेल उतना ही कठोर होगा। जेल की कठोरता, बदले में, PAGE के दौरान जेल के माध्यम से यात्रा करते समय बड़े अणुओं द्वारा अनुभव किए गए घर्षण को नियंत्रित करती है, इस प्रकार पृथक्करण के विभेद को प्रभावित करती है। ढीले जेल (4-8% एक्रिलामाइड) उच्च आणविक भार वाले अणुओं को जेल के माध्यम से तेजी से प्रवास करने की अनुमति देते हैं जबकि कठोर जेल $(12-20 %$ एक्रिलामाइड) बड़े अणुओं के प्रवास को प्रतिबंधित करते हैं और चयनात्मक रूप से छोटे अणुओं को जेल के माध्यम से गति करने की अनुमति देते हैं।
12.3.4 ट्रैकिंग डाई
चूँकि DNA, RNA और प्रोटीन अधिकांशतः रंगहीन होते हैं, इलेक्ट्रोफोरेसिस के दौरान जेल में उनकी प्रगति को आसानी से नहीं देखा जा सकता। इसलिए नमूना बफ़र में आमतौर पर एक ज्ञात इलेक्ट्रोफोरेटिक गतिशीलता वाले ऋणायनिक रंग शामिल किए जाते हैं। एक बहुत ही सामान्य ट्रैकिंग रंग ब्रोमोफेनॉल ब्लू है। यह रंग क्षारीय और तटस्थ $\mathrm{pH}$ पर रंगीन होता है, और यह एक छोटा ऋणावेशित अणु है जो ऐनोड की ओर बढ़ता है और यह क्षारीय और तटस्थ $\mathrm{pH}$ पर रंगीन होता है। अत्यधिक गतिशील अणु होने के कारण यह अधिकांश प्रोटीन और न्यूक्लिक अम्लों से आगे बढ़ता है। जब यह इलेक्ट्रोफोरेसिस माध्यम के ऐनोडिक सिरे तक पहुँचता है, तो इलेक्ट्रोफोरेसिस रोक दी जाती है। अन्य सामान्य ट्रैकिंग रंग ज़ायलीन सायनॉल, जिसकी गतिशीलता कम होती है, और ऑरेंज G, जिसकी गतिशीलता अधिक होती है, हैं। जेल पर प्रोटीन का दृश्यीकरण—कूमासी ब्रिलियंट ब्लू $\mathrm{R}-250$ सबसे लोकप्रिय प्रोटीन रंग है। यह एक ऋणायनिक रंग है, जो प्रोटीन से अस्पेसिफिक रूप से बंधता है। जेल में प्रोटीन एसिटिक एसिड द्वारा स्थिर किए जाते हैं और साथ ही रंगे भी जाते हैं। जेल में शामिल अतिरिक्त रंग को रंगहीन उसी विलयन से डेस्टेनिंग द्वारा हटाया जा सकता है। प्रोटीन स्पष्ट पृष्ठभूमि पर नीले बैंड के रूप में दिखाई देते हैं। किसी रंगने (प्रोटीन-विशिष्ट) तकनीक द्वारा दृश्यीकरण के बाद, किसी प्रोटीन का आकार उसकी माइग्रेशन दूरी की एक ज्ञात आण्विक भार सीढ़ी से तुलना करके परिकलित किया जा सकता है।
बॉक्स 1
जेली गुणधर्म का आश्चर्यजनक खोज
एक जापानी सम्राट और उसकी शाही टोली तूफ़ानी बर्फ़ में पहाड़ों में खो गई और एक छोटे सराय पर पहुँची; सरायवाले ने उन्हें रात के खाने के साथ समुद्री शैवाल की जेली परोसी। शायद सरायवाले ने ज़्यादा जेली बना दी थी या स्वाद इतना अच्छा नहीं था, पर कुछ जेली फेंक दी गई, रात भर जम गई और फिर पिघल-पिघल कर टूट गई, पानी निकल गया, और कम घनत्व वाली दरारदार चीज़ बच गई। सरायवाले ने वह बचा हुआ माल उठाया और आश्चर्य से देखा कि उसे फिर पानी में उबालने पर जेली फिर से बन जाती है।
एगर
कोच नामक एक वैज्ञानिक बैक्टीरिया को काटे हुए, उबले हुए आलू के बेस्वर सतहों पर उगाया करता था। यह तरीका असंतोषजनक था क्योंकि बैक्टीरिया हमेशा आलू पर अच्छी तरह नहीं उगते थे। फिर उसने सामान्य द्रव माध्यम को जिलेटिन मिलाकर ठोस बनाने की कोशिश की, पर कई बैक्टीरिया उसे पचा देते थे और तापमान $28^{\circ} \mathrm{C}$ से ऊपर जाने पर वह पिघल जाता था। एक बेहतर विकल्प फैनी एल्शेमियस हेसे ने दिया, जो वॉल्टर हेसे की पत्नी थीं और कोच के एक सहायक थे। उसने ठोस बनाने के एजेंट के रूप में एगर इस्तेमाल करने की सलाह दी—वह कुछ समय से जेली बनाने में इसे सफलतापूर्वक इस्तेमाल कर रही थीं। अधिकांश बैक्टीरिया एगर को नष्ट नहीं करते थे और यह $42^{\circ} \mathrm{C}$ से अधिक तापमान पर ही पिघलता था। एगरोस एगर के दो मुख्य घटकों में से एक है, और इसे एगर से एगरोपेक्टिन निकाल कर शुद्ध किया जाता है।
12.4 एंज़ाइम-लिंक्ड इम्यूनोसॉर्बेंट एसे (ELISA)
एंज़ाइम-लिंक्ड इम्यूनोसॉर्बेंट ऐसे (ELISA) का आविष्कार दो स्वीडिश वैज्ञानिकों, एवा एंगवाल और पीटर पर्लमैन ने 1971 में किया था। ELISA एक मात्रात्मक विधि है जिसका उपयोग किसी दिए गए नमूने में एंटीजन और एंटीबॉडी की सांद्रता को मापने के लिए किया जाता है। यह एक एंज़ाइम-कैटालyzed अभिक्रिया की सहायता से एंटीजन-एंटीबॉडी इंटरैक्शन की निगरानी करके किया जाता है। यह डिटेक्शन सिस्टम (एंज़ाइम-कॉन्जुगेट) एक विशिष्ट एंटीबॉडी से कोवैलेंटली जुड़ा होता है जो एक लक्ष्य एंटीजन को पहचानता है। उत्पन्न रंग की तीव्रता को ELISA रीडर या स्पेक्ट्रोफोटोमीटर द्वारा मापा जाता है। ELISA अन्य कई इम्यूनोलॉजिकल ऐसे की तुलना में अधिक सुरक्षित और कम खर्चीला ऐसे है।
ELISA के कई संशोधन विकसित किए गए हैं, जो या तो एंटीजन या एंटीबॉडी की गुणात्मक पहचान या मात्रात्मक माप की अनुमति देते हैं। ELISA के इन विभिन्न प्रकारों का उपयोग गुणात्मक रूप से एंटीबॉडी या एंटीजन की उपस्थिति का पता लगाने के लिए किया जा सकता है। ज्ञात सांद्रता वाले एंटीबॉडी या एंटीजन का उपयोग करके एक मानक वक्र तैयार की जाती है ताकि किसी नमूने की अज्ञात सांद्रता को निर्धारित किया जा सके।
“
चित्र 12.6. अप्रत्यक्ष ELISA

चित्र 12.7 सैंडविच ELISA

चित्र 12.8: प्रतिस्पर्धात्मक ELISA
प्रत्यक्ष ELISA - प्रत्यक्ष ELISA में, एंटीजन या नमूने को माइक्रोटाइटर प्लेट के कुओं पर लेपित किया जाता है और एंजाइम-संयुक्त एंटीबॉडी ‘सीधे’ एंटीजन से बंधता है। एंटीबॉडी से जुड़ा एंजाइम अपने सब्सट्रेट के साथ प्रतिक्रिया करता है और एक रंगीन उत्पाद बनाता है जिसे स्पेक्ट्रोफोटोमीटर/ELISA रीडर का उपयोग करके मापा जा सकता है। प्रत्यक्ष ELISA तेज और कम त्रुटि-प्रवण होता है और इसके लिए द्वितीयक एंटीबॉडी की आवश्यकता नहीं होती है। प्रत्यक्ष ELISA की कमी एंटीबॉडी का क्रॉस-रिएक्टिविटी के कारण अस्पेसिफिक बंधन है।
अप्रत्यक्ष ELISA - अप्रत्यक्ष ELISA दो चरणों में नमूने में एंटीबॉडी की उपस्थिति का पता लगाता है (चित्र 12.6)। सबसे पहले, एक अनलेबल प्राथमिक एंटीबॉडी (Ab1) को एंटीजन-लेपित माइक्रोटाइटर कुओं पर लगाया जाता है। बंधे हुए अतिरिक्त प्राथमिक एंटीबॉडी (Ab1) को फिर धोया जाता है। इसके बाद, एक एंजाइम-संयुक्त द्वितीयक एंटीबॉडी (Ab2) जो प्राथमिक एंटीबॉडी (Ab1) के लिए विशिष्ट है, जोड़ा जाता है। कोई भी अनबाउंड द्वितीयक एंटीबॉडी (Ab2) धोया जाता है और सब्सट्रेट जोड़ा जाता है। बने हुए रंगीन उत्पाद की मात्रा को स्पेक्ट्रोफोटोमीटर/ELISA रीडर का उपयोग करके मापा जा सकता है। अप्रत्यक्ष ELISA में संवेदनशीलता बढ़ी होती है क्योंकि प्रति प्राथमिक एंटीबॉडी से अधिक से अधिक एक लेबल वाला एंटीबॉडी बंधता है।
सैंडविच ELISA – सैंडविच ELISA में, एंटीबॉडी को माइक्रोटाइटर प्लेट पर कोट किया जाता है और इसे कैप्चर्ड एंटीबॉडी कहा जाता है। सैंडविच ELISA तकनीक का उपयोग करके, एंटीजन का पता लगाया या मापा जा सकता है (चित्र 12.7)। कैप्चर्ड एंटीबॉडी को प्लेट पर कोट करने के बाद, एंटीजन को जोड़ा जाता है और इसे कैप्चर्ड एंटीबॉडी के साथ प्रतिक्रिया करने दिया जाता है। अतिरिक्त एंटीजन को धोकर हटा दिया जाता है और फिर एक दूसरी एंजाइम-कनज्यूगेटेड एंटीबॉडी, जो एंटीजन पर एक भिन्न एपिटोप (एंटीजन अणु का वह भाग जिससे एंटीबॉडी जुड़ती है) के लिए विशिष्ट होती है, लोड की जाती है। अतिरिक्त अनबाउंड एंजाइम-कनज्यूगेटेड एंटीबॉडी को धोकर हटा दिया जाता है और फिर सब्सट्रेट जोड़ा जाता है और बना रंगीन उत्पाद स्पेक्ट्रोफोटोमीटर/ELISA रीडर का उपयोग करके मापा जाता है। उच्च विशिष्टता और एंटीजन शुद्धीकरण या सीमित एंटीजन की आवश्यकता न होना सैंडविच ELISA के मुख्य लाभ हैं।
प्रतिस्पर्धात्मक ELISA-प्रतिस्पर्धात्मक ELISA एंटीजन की मात्रा को मापने में मदद करता है (चित्र 12.8)। इस विधि में, एंटीबॉडी और एंटीजन को पहले विलयन में इनक्यूबेट किया जाता है। इस चरण में, एंटीजन की तुलना में एंटीबॉडी अधिक मात्रा में होती है; यह एकाग्रता-निर्भर तरीके से अपने एंटीजन से बाइंड करेगी, जिससे अनबाउंड एंटीबॉडी बचेगी। इस एंटीजन-एंटीबॉडी कॉम्प्लेक्स को फिर एक एंटीजन-कोटेड माइक्रोटाइटर वेल में डाला जाता है। इस प्रकार, यदि नमूने में अधिक एंटीजन मौजूद है, तो एंटीजन-कोटेड वेल से बाइंड करने के लिए कम मुक्त एंटीबॉडी उपलब्ध होगी और इसके विपरीत। अंत में, एंजाइम-कनजुगेटेड सेकेंडरी एंटीबॉडी (Ab2), जो प्राइमरी एंटीबॉडी के लिए विशिष्ट होता है, प्लेट में डाला जाता है, और ये प्लेट पर एंटीजन से बाउंड प्राइमरी एंटीबॉडी से बाइंड करता है। जैसा कि अप्रत्यक्ष ELISA के मामले में होता है, प्राइमरी एंटीबॉडी के लिए विशिष्ट एंजाइम-कनजुगेटेड सेकेंडरी एंटीबॉडी (Ab2) को जोड़ने से वेल से बाउंड प्राइमरी एंटीबॉडी की मात्रा का निर्धारण करने में मदद मिलती है। इस प्रकार, प्रतिस्पर्धात्मक ELISA में, नमूने में एंटीजन की उच्चतर सांद्रता होने पर मुक्त एंटीबॉडी की मात्रा कम होगी और तदनुसार, विकसित रंग की तीव्रता कम होगी।
ELISA के अनुप्रयोग
1. किसी नमूने में एंटीजन या एंटीबॉडी की उपस्थिति का आकलन किया जा सकता है।
2. वायरस परीक्षण में सीरम एंटीबॉडी की सांद्रता का निर्धारण किया जा सकता है।
3. खाद्य उद्योग में संभावित खाद्य एलर्जी का पता लगाया जा सकता है।
4. रोग प्रकोपों को ट्रैक किया जा सकता है जैसे HIV, बर्ड फ्लू, हैजा, आदि।
12.5 क्रोमैटोग्राफी
सिद्धांत
क्रोमैटोग्राफी एक पृथक्करण प्रक्रिया है जिसका उपयोग किसी मिश्रण के विभिन्न घटकों को पृथक करने के लिए किया जाता है। पूरी प्रक्रिया समय-निर्भर होती है और इसमें एक गतिशील चरण (mobile phase) तथा एक स्थिर चरण (stationary phase) शामिल होता है। गतिशील चरण वह विलयन हो सकता है जिसमें पृथक किए जाने वाले विलेय (solutes) और वह विलायक (eluent) होता है जो विलयन को स्थिर चरण से होकर ले जाता है। स्थिर चरण अधिशोषक, आयन-विनिमय रेजिन, छिद्रयुक्त ठोस या जेल हो सकता है। क्रोमैटोग्राफी का आधार स्थिर चरण से गुजरने के दौरान विलेय अणुओं की भिन्न प्रवासन (migration) विशेषताएँ होती हैं। मूल विलयन में मौजूद प्रत्येक विलेय उसकी स्थिर चरण के प्रति सापेक्ष आसक्ति के अनुपात में गति करता है। स्थिर चरण सामान्यतः एक बेलनाकार स्तंभ में भरा होता है। चित्र 12.9 किसी मिश्रण से तीन विलेयों के पृथक्करण का एक रूपरेखा विवरण प्रस्तुत करता है।
किसी मिश्रण के विभिन्न घटक, अर्थात् विलेय अणु, विलायक अणुओं के साथ भिन्न-भिन्न गतियों से यात्रा करते हैं।
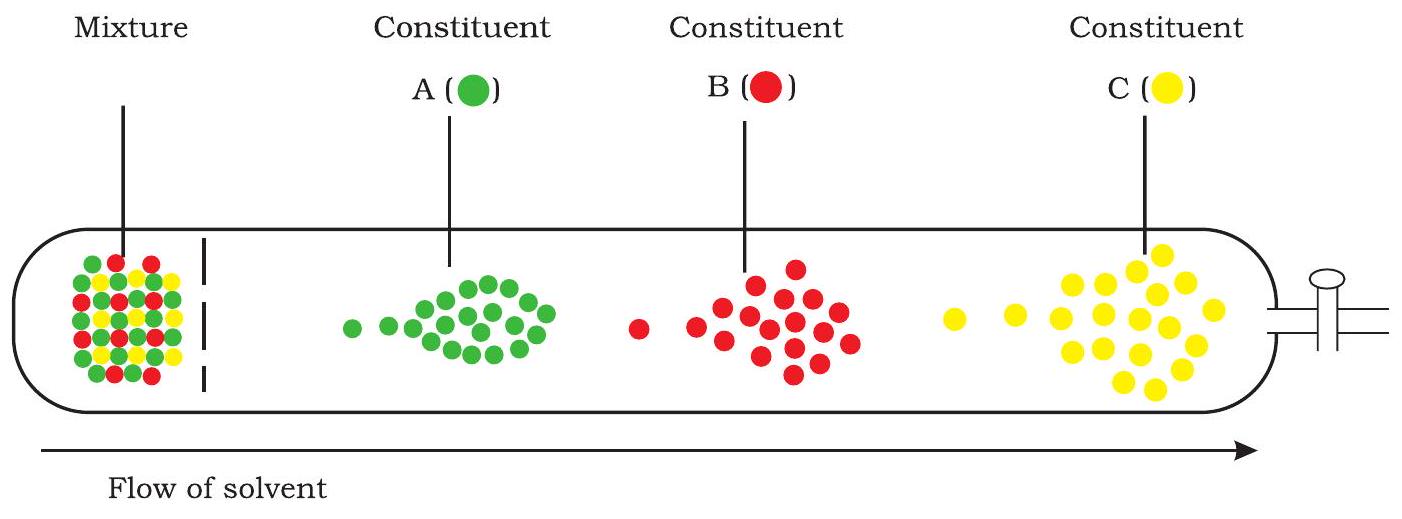
चित्र 12.9: क्रोमैटोग्राफी - एक आरेखीय विवरण
रेजिन कणों के प्रति उनकी सापेक्ष आकर्षण शक्ति के आधार पर। परिणामस्वरूप, वे अलग हो जाते हैं और स्तंभ के दूसरे सिरे पर विभिन्न समय अंतरालों पर संग्रह के लिए प्रकट होते हैं। क्रोमैटोग्राफी स्तंभ से निकलने वाले सॉल्यूट चोटियों की पैटर्न को क्रोमैटोग्राम कहा जाता है। एक विशिष्ट HPLC क्रोमैटोग्राम चित्र 12.10 में दिखाया गया है।
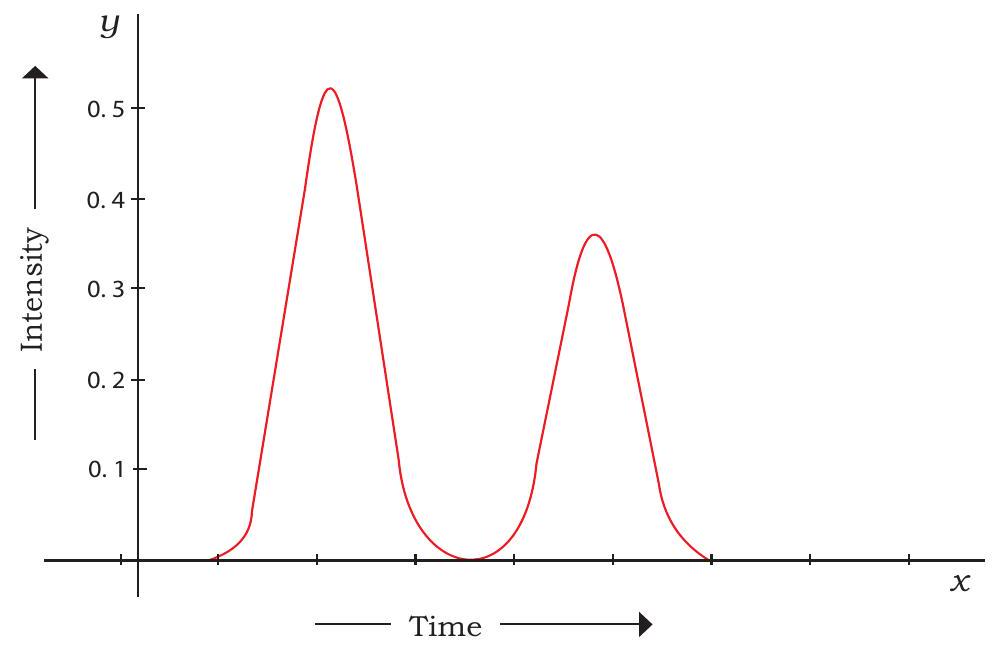
चित्र 12.10: HPLC क्रोमैटोग्राम
द्रव क्रोमैटोग्राफी का उपयोग नमूने के विश्लेषण के लिए प्रयोगशाला विधि के रूप में और जैव-अणुओं के बड़े पैमाने पर शुद्धीकरण के लिए तैयारी तकनीक के रूप में दोनों किया जाता है। हाल के वर्षों में आनुवंशिक रूप से इंजीनियर्ड जीवों से पुनर्संयोजी उत्पादों के पृथक्करण के उद्देश्य से द्रव क्रोमैटोग्राफी की तकनीक में तेजी से विकास हुआ है। क्रोमैटोग्राफी एक उच्च संकल्प तकनीक है और इसलिए उच्च शुद्धता वाले थेरेप्यूटिक्स और फार्मास्यूटिकल्स की वसूली के लिए उपयुक्त है। प्रोटीन, पेप्टाइड्स, अमीनो अम्ल, न्यूक्लिक अम्ल, क्षार, विटामिन, स्टेरॉयड और कई अन्य जैविक पदार्थों की शुद्धीकरण के लिए क्रोमैटोग्राफी विधियां उपलब्ध हैं। ये विधियां क्रोमैटोग्राफी स्तंभ में अणुओं को अलग करने के सिद्धांतों में भिन्न होती हैं।
एड्सॉर्प्शन क्रोमैटोग्राफी (ADC): यह क्रोमैटोग्राफी सॉल्यूट अणुओं के ध्रुवीय एड्सॉर्बेंट्स जैसे सिलिका जेल, एल्युमिना, डायटोमेसियस अर्थ और चारकोल पर एड्सॉर्प्शन पर आधारित है। चूँकि मोबाइल फेज सॉल्यूट के साथ एड्सॉर्प्शन साइट्स के लिए प्रतिस्पर्धा करती है, इसलिए सॉल्वेंट गुण भी महत्वपूर्ण हैं। मोबाइल-फेज चयन में सहायता के लिए सॉल्वेंट्स के लिए ध्रुवता स्केल उपलब्ध हैं।
द्रव-द्रव विभाजन क्रोमैटोग्राफी (LLC)- विभाजन क्रोमैटोग्राफी दो अपरस्पर द्रवों के बीच सॉल्यूट अणुओं के विभिन्न विभाजन गुणांक (घुलनशीलता) पर निर्भर करती है। इसे एक द्रव को स्थिर फेज के रूप में स्थिर करके और दूसरे द्रव को सॉल्यूट युक्त मोबाइल फेज के रूप में प्रवाहित करके प्राप्त किया जाता है। द्रव आपस में घनिष्ठ संपर्क करते हैं, जिससे सॉल्यूट की कई बार निष्कर्षण प्रक्रिया होती है।
आयन-विनिमय क्रोमैटोग्राफी (IEC)- इस प्रक्रिया में पृथक्करण का आधार स्तंभ पैकिंग पर आयन-विनिमय रेजिन कणों पर सॉल्यूट आयनों का वैद्युत स्थैतिक बलों द्वारा एड्सॉर्प्शन है। आयन-विनिमय क्रोमैटोग्राफी बड़े अणुओं की उच्च विभेदन क्षमता प्रदान कर सकती है। व्यावसायिक रूप से इसका उपयोग एंटीबायोटिक्स और प्रोटीनों के अंशन के लिए किया जाता है। स्तंभ पैकिंग में सिलिका, ग्लास और पॉलिस्टाइरीन शामिल हैं; सेल्यूलोज, एगारोज या डेक्सट्रान से जुड़े कार्बोक्सीमेथिल और डाइथिलएमिनोएथिल समूह प्रोटीन क्रोमैटोग्राफी के लिए उपयुक्त रेजिन प्रदान करते हैं। सॉल्यूट को द्रव फेज के $\mathrm{pH}$ या आयनिक सामर्थ्य को बदलकर निकाला जाता है।
जेल फिल्ट्रेशन क्रोमैटोग्राफी- इस तकनीक को अणु छलनी क्रोमैटोग्राफी, आकार अपवर्जन क्रोमैटोग्राफी और जेल-पारगमन क्रोमैटोग्राफी भी कहा जाता है। यह पृथक किए जाने वाले अणुओं के आकार पर आधारित है। विलयन में उपस्थित विलेय अणुओं को विशिष्ट छिद्रता वाले जेल कणों से भरे स्तंभ में पृथक किया जाता है। अधिकांशतः, स्तंभ पैकिंग के लिए क्रॉस-लिंक्ड डेक्सट्रांट, एगारोस और पॉलिएक्रिलामाइड जेल का उपयोग किया जाता है। स्तंभ के माध्यम से विलेय अणुओं की पैठ विलेय अणुओं के आकार और उनके प्रभावी आण्विक आकार पर निर्भर करती है। जेल फिल्ट्रेशन का उपयोग प्रोटीन और लिपोफिलिक यौगिकों के पृथक्करण के लिए किया जा सकता है। बड़े पैमाने पर जेल फिल्ट्रेशन स्तंभों को ऊपर की ओर प्रवाह एल्यूशन के साथ संचालित किया जाता है।
एफिनिटी क्रोमैटोग्राफी (AFC): यह पृथक्करण तकनीक जैवअणुओं की बंधन विशिष्टता का लाभ उठाती है। एंजाइम, हार्मोन, रिसेप्टर, एंटीबॉडी, एंटीजन, बाइंडिंग प्रोटीन, लेक्टिन, न्यूक्लिक एसिड, विटामिन, पूर्ण कोशिकाएं और अन्य घटक जो विशिष्ट और उलटने योग्य बंधन में सक्षम हैं, अत्यधिक चयनात्मक एफिनिटी शुद्धिकरण के लिए उपयुक्त हैं। स्तंभ पैकिंग तैयार करने के लिए एक बंधन अणु को लिगेंड कहा जाता है, जिसे स्तंभ से जोड़ा जाता है, केवल वे विलेय जो लिगेंड के लिए पर्याप्त आकर्षण रखते हैं, वही आये हुए रहते हैं।
उच्च-दाब / प्रदर्शन द्रव क्रोमैटोग्राफी (HPLC): यह क्रोमैटोग्राफी के सामान्य सिद्धांतों पर आधारित है। HPLC के विकास के साथ, उपयोग किए जाने वाले स्थिर चरण के कणों का आकार लगातार छोटा होता गया है। इन कणों का छोटा आकार विलायक के प्रवाह में काफी प्रतिरोध उत्पन्न करता है। मोबाइल चरण को उच्च दाब के तहत कॉलम के माध्यम से पंप करना पड़ता है।
गैस क्रोमैटोग्राफी (GC): गैस क्रोमैटोग्राफी (GC) का उपयोग वाष्पशील घटकों जैसे एल्कोहल, कीटोन, एल्डिहाइड और कई अन्य कार्बनिक और अकार्बनिक यौगिकों के पृथक्करण और शुद्धिकरण के लिए व्यापक रूप से किया जाता है। गैस क्रोमैटोग्राफी में, मोबाइल चरण गैस होता है। गैस क्रोमैटोग्राफी का व्यापक रूप से उपयोग किया जाता है, हालांकि, जैव प्रक्रमन के लिए द्रव क्रोमैटोग्राफी अत्यधिक प्रासंगिक है।
12.6 स्पेक्ट्रोस्कोपी
स्पेक्ट्रोस्कोपी एक ऐसी तकनीक है जिसका उपयोग वैद्युत चुंबकीय विकिरण और पदार्थ के बीच पारस्परिक क्रिया के अध्ययन के लिए किया जाता है। इसका उपयोग पदार्थों की पहचान के लिए किया जाता है जो उनसे उत्सर्जित या अवशोषित स्पेक्ट्रम के माध्यम से होता है। इसका उपयोग रंगीन यौगिकों की सांद्रता के आकलन, अणुओं की रासायनिक संरचना के विश्लेषण, विभिन्न एंजाइमेटिक अभिक्रियाओं के दौरान होने वाले आणविक परिवर्तनों के प्रकारों; और अंतराअण्विक आबंधन के अध्ययन में किया जाता है। विभिन्न स्पेक्ट्रोस्कोपिक तकनीकों की सूची तालिका 12.1 में दी गई है। स्पेक्ट्रोफोटोमेट्रिक तकनीकें गुणात्मक और मात्रात्मक विश्लेषण के लिए एक बहुत ही तेज़ और सुविधाजनक साधन प्रदान करती हैं
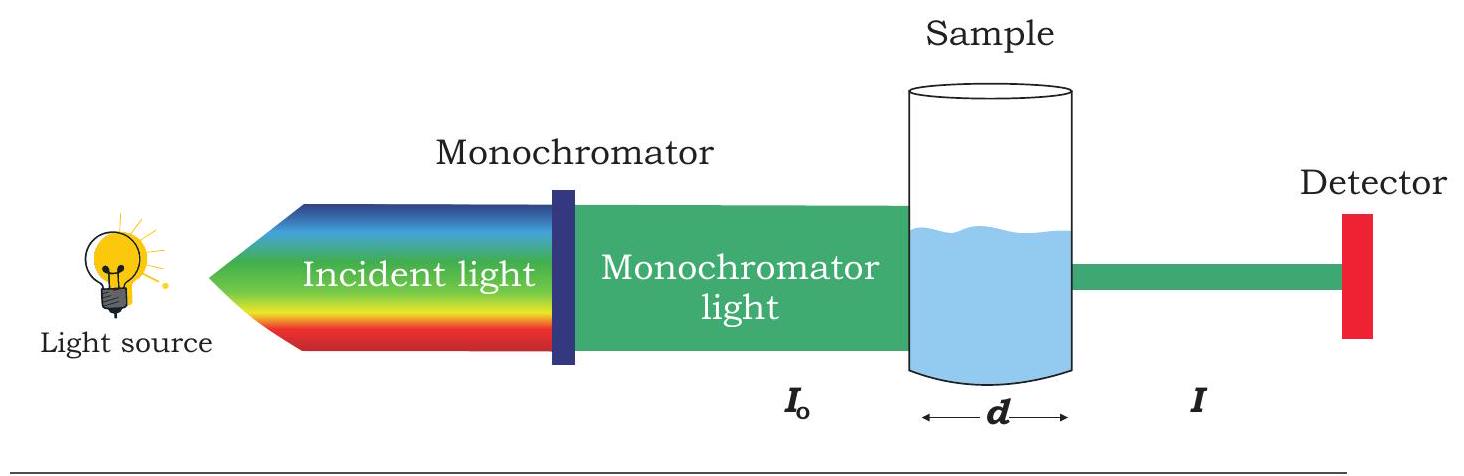
चित्र 12.11: स्पेक्ट्रोस्कोपी के उपकरणों का आरेखीय प्रतिनिधित्व
जैव अणुओं का आकलन। स्पेक्ट्रोफोटोमीटर में निम्नलिखित भाग होते हैं: प्रकाश स्रोत, जो वांछित तरंगदैर्ध्य का प्रकाश प्रदान करता है, कोलिमेटर, जो प्रकाश की सीधी किरण संचारित करता है, मोनोक्रोमेटर, जो प्रकाश को उसके घटक तरंगदैर्ध्य में विभाजित करता है, और तरंगदैर्ध्य चयनकर्ता, जो केवल वांछित तरंगदैर्ध्य को संचारित करता है (चित्र 12.11)।
बॉक्स 2
बीयर-लैम्बर्ट नियम
बीयर-लैम्बर्ट नियम कहता है कि किसी विलयन में अवशोषित पदार्थ की सांद्रता और पथ लंबाई के सीधे अनुपात में विलयन का अवशोषण होता है। इस कारण से, बीयर-लैम्बर्ट नियम केवल तभी लागू किया जा सकता है जब कोई रैखिक संबंध हो। बीयर का नियम इस प्रकार लिखा गया है:
$$ A=\varepsilon l c $$
जहाँ $A$ अवशोषण का माप है (कोई इकाई नहीं),
$\varepsilon$ मोलर विलोपन गुणांक या मोलर अवशोषकता (या अवशोषण गुणांक) है, $l$ पथ लंबाई है और $c$ सांद्रता है।
ट्रांसमिटेंस उस प्रकाश की मात्रा के बीच संबंध है जो नमूने से गुजरने के बाद डिटेक्टर तक पहुंचती है (I) और मूल प्रकाश की मात्रा $\left(\mathrm{I} _{0}\right)$। यह निम्नलिखित सूत्र में व्यक्त किया गया है।
$$ \mathrm{T}=\mathrm{I} / \mathrm{I} _{0} $$
जहाँ $\mathrm{T}$ पारगम्यता है,
I नमूने से बाहर आने वाली प्रकाश की तीव्रता है, और $\mathrm{I} _{0}$ आपतित प्रकाश पुंज की तीव्रता है।
अवशोषण पारगम्यता के ऋणात्मक लघुगुणक के बराबर होता है और पारगम्यता ($\mathrm{T}$) तथा अवशोषण (A) के बीच यह संबंध इस प्रकार व्यक्त किया जा सकता है:
इसलिए,
$$ \begin{aligned} & A=-\log (T) \ & A=-\log \left(I / I_{0}\right) \ & A=\log \left(I_{0} / I\right) \end{aligned} $$
$$ A=\varepsilon l c=\log \left(\mathrm{I} _{0} / \mathrm{I}\right) $$
यदि आप किसी दी गई तरंगदैर्ध्य के लिए अवशोषण गुणांक और विलयन से होकर गुजरने वाले प्रकाश के पथ की मोटाई जानते हैं, तो आप सांद्रता की गणना कर सकते हैं।
तालिका 12.1 विभिन्न स्पेक्ट्रोस्कोपी तकनीकों की सूची
| प्रकार ऊर्जा स्थानांतरण |
स्पेक्ट्रोस्कोपिक तकनीक |
विद्युतचुंबकीय स्पेक्ट्रम क्षेत्र |
अनुप्रयोग |
|---|---|---|---|
| अवशोषण | UV/दृश्य स्पेक्ट्रोस्कोपी |
UV/दृश्य | कार्यात्मक समूहों का पता लगाना, संयुग्मन की सीमा और ज्यामितीय समावयवियों की विन्यास निर्धारित करना |
| परमाणु अवशोषण स्पेक्ट्रोस्कोपी |
UV/दृश्य | नमूनों के भीतर धातुओं और अन्य विद्युत अपघट्यों की विभिन्न मात्राओं की मात्रा निर्धारित करना |
|
| अवरक्त स्पेक्ट्रोस्कोपी |
अवरक्त | कार्यात्मक समूहों का निर्धारण | |
| रामन स्पेक्ट्रोस्कोपी |
अवरक्त | दूषक की पहचान, रत्न और खनिज की पहचान | |
| नाभिकीय चुंबकीय अनुनाद स्पेक्ट्रोस्कोपी |
रेडियो तरंग | परमाणुओं की संरचना और रासायनिक परिवेश के बारे में जानकारी प्रदान करता है |
|
| एक्स-रे अवशोषण स्पेक्ट्रोस्कोपी |
एक्स-रे | अणुओं की मूलभूत संरचना और रासायनिक बंधन का निर्धारण करता है |
|
| उत्सर्जन | परमाणु उत्सर्जन स्पेक्ट्रोस्कोपी |
UV/दृश्य | ट्रेस धातुओं, खनिजों, सोडियम, पोटैशियम और लिथियम का पता लगाना |
| द्रव्यमान स्पेक्ट्रोमीटर | प्रोटीन, पेप्टाइड्स का विश्लेषण, जल गुणवत्ता और खाद्य दूषण की जांच |
||
| प्रकाश उत्सर्जन | प्रतिदीप्ति स्पेक्ट्रोस्कोपी |
UV/दृश्य | कई कार्बनिक यौगिकों, दवा में अनेक सक्रिय सुगंधित पदार्थों का पता लगाना |
| स्फुरदीप्ति स्पेक्ट्रोस्कोपी |
UV/दृश्य | - |
12.6.1 रंगमिति
रंगमिति तकनीक रंगीन विलयनों के साथ प्रकाश ऊर्जा की अन्योन्यक्रिया का उपयोग करती है। यह उपकरण द्रव नमूने से गुजरने वाले प्रकाश के संचरण और अवशोषण को मापने के लिए प्रयुक्त होता है। यह उस रंग की तीव्रता मापता है जो विलयन में कोई विशिष्ट अभिकर्मक मिलाने पर विकसित होती है। रंग की तीव्रता मापे जा रहे यौगिक की सांद्रता के समक्षतः समानुपाती होती है। तरंगदैर्ध्य का चयन रंगीन फिल्टरों द्वारा किया जाता है जो किसी निश्चित सीमित तरंगदैर्ध्य परिसर को छोड़कर शेष सभी को अवशोषित कर लेते हैं। इस सीमित परिसर को फिल्टर की बैंडविड्थ कहा जाता है। रंगमापक के तीन मुख्य घटक हैं—प्रकाश स्रोत (टंगस्टन-तार लैम्प), फिल्टर, नमूना धारित करने वाली क्युवेट और प्रवाहित प्रकाश (विलयन से गुजरा प्रकाश) का पता लगाने के लिए फोटोसेल (चित्र 12.12)। रंगमापक का सिद्धांत बीयर-लैम्बर्ट नियम (बॉक्स 2) पर आधारित है, जो दो नियमों का संयोजन है—प्रत्येक अवशोषक की सांद्रता और अवशोषित माध्यम की मोटाई या पथ लंबाई से संबंधित प्रकाश के अवशोषण को अलग-अलग संभालता है। रंगमापक सस्ता, आसानी से परिवहनीय और रंगीन यौगिकों की मात्रात्मक विश्लेषण के लिए प्रयुक्त होता है।
चित्र 12.12: रंगमापक के घटक
12.6.2 यूवी-दृश्य स्पेक्ट्रोफोटोमेट्री
यह उपकरण विकिरण स्पेक्ट्रम के पराबैंगनी और दृश्य क्षेत्रों की प्रत्येक तरंगदैर्ध्य पर अवशोषित प्रकाश की मात्रा को मापने के लिए प्रयुक्त होता है। स्पेक्ट्रोफोटोमीटर एक रंगमापक (कलोरीमीटर) का एक उन्नत प्रकार है जिसमें एक प्रिज़्म के ग्रेटिंग द्वारा एकवर्णी प्रकाश प्रदान किया जाता है। एक रंगमापक में फिल्टरों का उपयोग किया जाता है जो तरंगदैर्ध्यों के एक विस्तृत परास को पारित होने देते हैं, जबकि स्पेक्ट्रोफोटोमीटर में आपतित किरण को विभिन्न तरंगदैर्ध्यों में विभाजित करने के लिए एक प्रिज़्म (या) ग्रेटिंग का उपयोग किया जाता है। एक ‘फोटोमीटर’ प्रकाश को मापने के लिए एक युक्ति है,
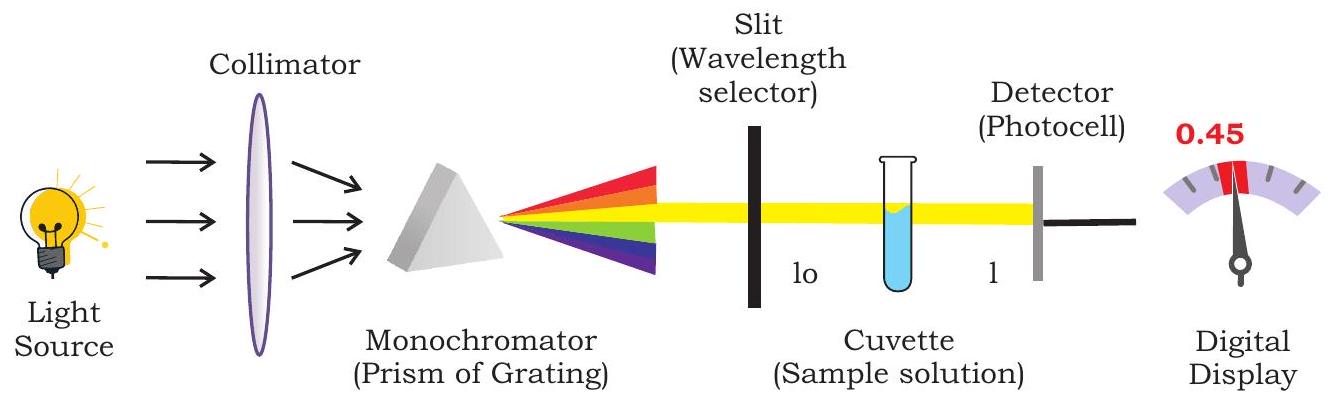
चित्र 12.13: पराबैंगनी-दृश्य स्पेक्ट्रोफोटोमीटर
और ‘स्पेक्ट्रो’ का अर्थ है वह संपूर्ण निरंतर तरंगदैर्ध्य सीमा जो प्रकाश स्रोत उत्पन्न करने में सक्षम है। स्पेक्ट्रोफोटोमीटर विभिन्न घटकों से बना होता है, जैसे प्रकाश स्रोत (पराबैंगनी और दृश्य), तरंगदैर्ध्य चयनकर्ता (मोनोक्रोमेटर), नमूना पात्र (क्युवेट), संवेदक, संकेत प्रक्रमक आदि (चित्र 12.13)।
12.7 द्रव्यमान स्पेक्ट्रोमिति
द्रव्यमान स्पेक्ट्रोमेट्री का उपयोग अज्ञात यौगिकों की पहचान करने, अज्ञात पदार्थों की मात्रा निर्धारित करने और अणुओं की संरचना और रासायनिक गुणों को स्पष्ट करने के लिए किया जाता है। संपूर्ण प्रक्रिया में नमूने को इलेक्ट्रॉन आयनन द्वारा गैसीय आयनों में रूपांतरित करना शामिल है, जिसमें विखंडन के साथ या बिना हो सकता है, फिर इन आयनों को उनके द्रव्यमान-से-आवेश अनुपात $(\mathrm{m} / \mathrm{z})$ और सापेक्ष बहुलता के अनुसार वर्णित किया जाता है। द्रव्यमान की माप की इकाई डाल्टन है (संक्षेप में Da)। एक डाल्टन कार्बन-12 समस्थानिक के एकल परमाणु के द्रव्यमान का $1 / 12$ वां भाग होता है। द्रव्यमान स्पेक्ट्रोमेट्री के तीन प्रमुख घटक हैं: आयन स्रोत जो अध्ययन किए जा रहे पदार्थ से गैसीय आयन उत्पन्न करता है, विश्लेषक जो आयनों को उनके द्रव्यमान-से-आवेश अनुपात के अनुसार उनके विशिष्ट द्रव्यमान घटकों में विभाजित करता है, और संवेदक प्रणाली जो आयनों का पता लगाती है और प्रत्येक विभाजित आयनिक प्रजाति की सापेक्ष बहुलता को रिकॉर्ड करती है (चित्र 12.14)।

चित्र 12.14: द्रव्यमान स्पेक्ट्रोमीटर
12.8 फ्लोरेसेंस इन सिटू हाइब्रिडाइजेशन (FISH)
फ्लोरेसेंस इन सीटू हाइब्रिडाइज़ेशन (FISH) एक साइटोजेनेटिक (गुणसूत्रों की संख्या और संरचना का अध्ययन) तकनीक है जो फ्लोरेसेंट अणु का उपयोग करती है जो गुणसूत्र के अत्यधिक पूरक क्षेत्र से बंधता है। FISH यह पहचानने में उपयोगी है कि कोई विशेष जीन व्यक्ति के गुणसूत्रों में कहाँ स्थित है। गुणसूत्र में फ्लोरेसेंट अणु के स्थान को खोजने के लिए फ्लोरेसेंस सूक्ष्मदर्शी का उपयोग किया जाता है। यह गुणसूत्रीय असामान्यताओं को समझने के लिए एक महत्वपूर्ण उपकरण है।

चित्र 12.15: FISH के मूल चरण
FISH के मुख्य घटक हैं:
(i) एक फ्लोरेसेंट DNA अणु (प्रोब), और
(ii) गुणसूत्र (लक्ष्य अनुक्रम)
यहाँ बताया गया है कि FISH कैसे काम करता है
1. एक अणु (प्रोब) को ज्ञात अनुक्रम के पूरक के रूप में डिज़ाइन करें। प्रोब को एक फ्लोरेसेंट अणु, उदाहरण के लिए फ्लोरेसcein, से लेबल किया जाता है, जिसमें ऐसे न्यूक्लियोटाइड शामिल किए जाते हैं जिनसे फ्लोरेसेंट मार्कर जुड़ा होता है (चित्र 12.15)।
2. गुणसूत्रों को सूक्ष्मदर्शी स्लाइड पर रखें और उन्हें डिनेचर करें।
3. प्रोब को डिनेचर करें और इसे सूक्ष्मदर्शी स्लाइड में डालें।
4. प्रोब अपने पूरक स्थान से हाइब्रिडाइज़ होता है।
5. अतिरिक्त प्रोब को धोया जाता है और गुणसूत्र को फ्लोरेसेंट सूक्ष्मदर्शी के तहत देखा जाता है। प्रोब सूक्ष्मदर्शी में एक या अधिक फ्लोरेसेंट संकेतों के रूप में दिखाई देगा, यह इस बात पर निर्भर करता है कि यह कितने स्थानों से हाइब्रिडाइज़ कर सकता है।
FISH के अनुप्रयोग
गुणसूत्र पेंटिंग
मल्टीफ्लुअर FISH प्रोब का उपयोग करके एक कैरियोटाइप तैयार किया जा सकता है जिसमें प्रत्येक गुणसूत्र एक अलग रंग से रंगा प्रतीत होता है (चित्र 12.16)।
सबसे पहले, प्रत्येक गुणसूत्र के लिए प्रोब के रूप में उपयोग होने वाले DNA अनुक्रमों का एक संग्रह तैयार किया जाता है। फिर इन DNA अनुक्रमों को फ्लोरोक्रोमों के संयोजनों के साथ लेबल किया जाता है जो एक अद्वितीय रंग उत्पन्न करते हैं। फ्लोरेसेंट DNA प्रोब और मेटाफेज गुणसूत्रों को एक साथ मिलाया जाता है; फिर हाइब्रिड्स को फ्लोरेसेंट माइक्रोस्कोप के नीचे देखा जाता है।
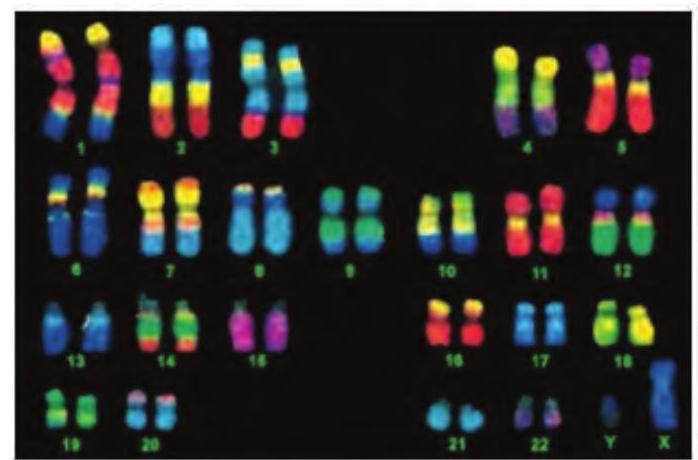
चित्र 12.16: गुणसूत्र पेंटिंग
बॉक्स 3
1. ओसामु शिमोमुरा एक जापानी कार्बनिक रसायनज्ञ और समुद्री जीवविज्ञानी हैं, जो नागासाकी के बमबारी में जीवित बचे। एक युवा व्यक्ति के रूप में, उन्होंने गलती से जेलीफ़िश से ग्रीन फ्लोरेसेंट प्रोटीन (GFP) की खोज की।
2. 1962 में, जेलीफ़िश पर अपने पीएचडी कार्य के दौरान, उन्होंने निराशा में शुद्ध प्रोटीन नमूने को सिंक में फेंक दिया, और बाद में उन्होंने देखा कि पानी में मौजूद कैल्शियम ने एक्वोरिन से नीली रोशनी को हरे रंग में बदल दिया। एक्वोरिन GFP का एक आवश्यक अग्रद्रव्य है। बाद में यह पाया गया कि GFP एक्वोरिन के कुछ नीले उत्सर्जन को अवशोषित करता है, और अधिक हरे रंग का उत्सर्जन करता है।
3. 2008 में ओसामु शिमोमुरा ने कोलंबिया विश्वविद्यालय के मार्टिन चाल्फी और कैलिफोर्निया विश्वविद्यालय, सैन डिएगो के रोजर त्सिएन सहित अन्य दो अमेरिकी वैज्ञानिकों के साथ GFP की खोज और विकास के लिए रसायन विज्ञान में नोबेल पुरस्कार प्राप्त किया।
12.9 डीएनए अनुक्रमण
जैसा कि आप जानते हैं, डीएनए चार अक्षरों (A, T, G, C) से बना होता है जिन्हें न्यूक्लियोटाइड्स (नाइट्रोजनीय क्षार) कहा जाता है, जो फॉस्फोडाइएस्टर बंधनों के माध्यम से एक साथ जुड़े होते हैं, और यह आनुवंशिक सूचना का वाहक होता है। डीएनए अनुक्रमण का अर्थ है डीएनए के एक टुकड़े पर न्यूक्लियोटाइड्स (ATGC) के क्रम को खोजना। इन चार क्षारों का क्रम किसी दिए गए डीएनए (जैसे कि एक जीन) की कार्यात्मक इकाई की अनूठी विशेषता के लिए कुंजी होता है। दूसरे शब्दों में, डीएनए की अनुक्रमण सभी जीवित जीवों के विकासात्मक कार्यक्रमों के आधार के रूप में गठित होने वाली वंशानुगत आनुवंशिक सूचना को समाहित करता है। डीएनए अनुक्रमण की उपस्थिति ने जैविक अनुसंधान और खोज को महत्वपूर्ण रूप से तेज कर दिया है।
इन आधारों की अनूठी क्रम व्यवस्था स्वास्थ्य पर गहरा प्रभाव डालती है, उदाहरण के लिए, किसी व्यक्ति को किस रोग की प्रवृत्ति है और वह विभिन्न दवाओं पर कैसी प्रतिक्रिया देगा। किसी विशेष डीएनए अनुक्रम को समझने से जेनेटिक स्थिति (जैसे कोई रोग) के बारे में जानकारी मिल सकती है और अंततः उपचार विकसित करने की आशा जगती है। इस प्रकार, डीएनए अनुक्रम में बदलाव से प्रोटीन बदला हुआ या अकार्यशील बन सकता है और इससे हानिकारक प्रभाव पड़ सकता है। इसके अतिरिक्त, किसी क्लोन किए गए डीएनए की संरचना, कार्य और विकासवादी इतिहास को समझने के लिए उसकी प्राथमिक संरचना, अर्थात् न्यूक्लियोटाइड अनुक्रम की आवश्यकता होती है। डीएनए अनुक्रमन तकनीक का विस्तार पर्यावरणीय, कृषि और फॉरेंसिक अनुप्रयोगों में भी होता है। इस प्रकार, डीएनए अनुक्रम निर्धारित करना मूलभूत जैविक प्रक्रियाओं का अध्ययन करने वाले आधारभूत अनुसंधान के साथ-साथ नैदानिक या फॉरेंसिक अनुसंधान जैसे अनुप्रयुक्त क्षेत्रों में भी उपयोगी है। आधुनिक डीएनए अनुक्रमन तकनीक द्वारा प्राप्त तीव्र गति कई पशु, पौधे और सूक्ष्मजीव जीनोमों—जिनमें मानव का भी समावेश है—के सम्पूर्ण डीएनए अनुक्रमों के अनुक्रमण में सहायक रही है।
12.9.1 डीएनए अनुक्रमन विधियाँ
ऐतिहासिक रूप से डीएनए अनुक्रमन की दो प्रमुख विधियाँ हैं, अर्थात् (1) एंजाइमेटिक विधि (सैंजर की विधि, डाइडिऑक्सीन्यूक्लियोटाइड श्रृंखला विराम विधि) और (2) रासायनिक विघटन विधि (मैक्सम और गिल्बर्ट विधि)।
इन दोनों विधियों का विस्तृत वर्णन निम्नलिखित खंडों में किया गया है:
(ए) सैंगर विधि- सैंगर विधि इस सिद्धांत पर कार्य करती है कि डाइडीऑक्सीन्यूक्लियोटाइड्स (डाइडीऑक्सीएडेनिन, डाइडीऑक्सीग्वानिन आदि, जो सामान्य न्यूक्लियोटाइड्स के समान होते हैं लेकिन 3’ स्थान पर सामान्य -OH समूह की अनुपस्थिति होती है) नवसंश्लेषित श्रृंखला (पुत्री श्रृंखला) में सामान्य डीऑक्सीन्यूक्लियोटाइड के स्थान पर समाविष्ट हो जाते हैं, जिससे उस बिंदु पर नए स्ट्रैंड के संश्लेषण का समापन हो जाता है (और इसीलिए इसे श्रृंखला समापन विधि कहा जाता है) (चित्र 12.17)। सैंगर विधि को डीएनए अनुक्रमण के लिए गोल्ड स्टैंडर्ड माना जाता है। इसका उपयोग आज भी नियमित अनुक्रमण अनुप्रयोगों के लिए किया जाता है और साथ ही नेक्स्ट जनरेशन सीक्वेंसिंग (इस अध्याय के निम्नलिखित खंडों में पढ़ें) डेटा की पुष्टि के लिए भी किया जाता है।

चित्र 12.17: सामान्य डीऑक्सीन्यूक्लियोटाइड (ऊपर) डाइडीऑक्सीन्यूक्लियोटाइड (नीचे) की संरचना
सैंगर की डीएनए अनुक्रमण विधि में, टेम्पलेट डीएनए (जिसका अनुक्रम निर्धारित करना है) को एक प्राइमर (एक छोटा रासायनिक रूप से संश्लेषित डीएनए जिसकी अनुक्रम परिभाषित होती है और जो टेम्पलेट डीएनए के साथ युग्मन कर डीएनए संश्लेषण के लिए प्रारंभिक बिंदु के रूप में कार्य करता है) के साथ मिलाया जाता है जो टेम्पलेट डीएनए के पूरक होता है और चार सामान्य dNTPs के साथ, जिनमें से एक रेडियोधर्मी या फ्लोरोसेंट लेबल से चिह्नित होता है। इस मिश्रण को फिर चार अलग-अलग नलिकाओं में विभाजित किया जाता है जिन्हें A, C, G और T चिह्नित किया जाता है। प्रत्येक नलिका को एक अलग ddNTP के साथ ‘स्पाइक’ किया जाता है (नलिका A के लिए ddATP, नलिका C के लिए ddCTP, नलिका G के लिए ddGTP, या नलिका T के लिए ddTTP)। इसके बाद, डीएनए पॉलिमरेज़ जोड़ा जाता है, और डीएनए टेम्पलेट और इसके पूरक प्राइमर का उपयोग करते हुए, टेम्पलेट के पूरक नए डीएनए स्ट्रैंड्स का संश्लेषण प्रारंभ होता है। कभी-कभी, एक सामान्य डीऑक्सीन्यूक्लियोटाइड के स्थान पर एक डाइडीऑक्सीन्यूक्लियोटाइड जुड़ जाता है और उस बिंदु पर उस स्ट्रैंड का संश्लेषण समाप्त हो जाता है। इस प्रकार, लेन A में सभी खंड A पर समाप्त होंगे, लेन C में खंड सभी C पर समाप्त होंगे, लेन G में खंड सभी G पर समाप्त होंगे, और लेन T में खंड सभी T पर समाप्त होंगे। एक निश्चित समय तक अभिक्रिया करने के बाद नव-संश्लेषित डीएनए स्ट्रैंड्स (खंडों) को उच्च संकल्प पॉलिएक्रिलामाइड जेल इलेक्ट्रोफोरेसिस (PAGE) द्वारा पृथक किया जाता है और डीएनए खंडों को रेडियोधर्मी रूप से लेबल किए गए न्यूक्लियोटाइड्स के लिए जेल को X-रे फिल्म के संपर्क में लाकर दृश्यमान बनाया जाता है। अंत में, डीएनए का अनुक्रम जेल से नीचे से प्रारंभ कर ऊपर की ओर पढ़कर X-रे फिल्म पर निर्धारित किया जाता है (चित्र 12.18)।
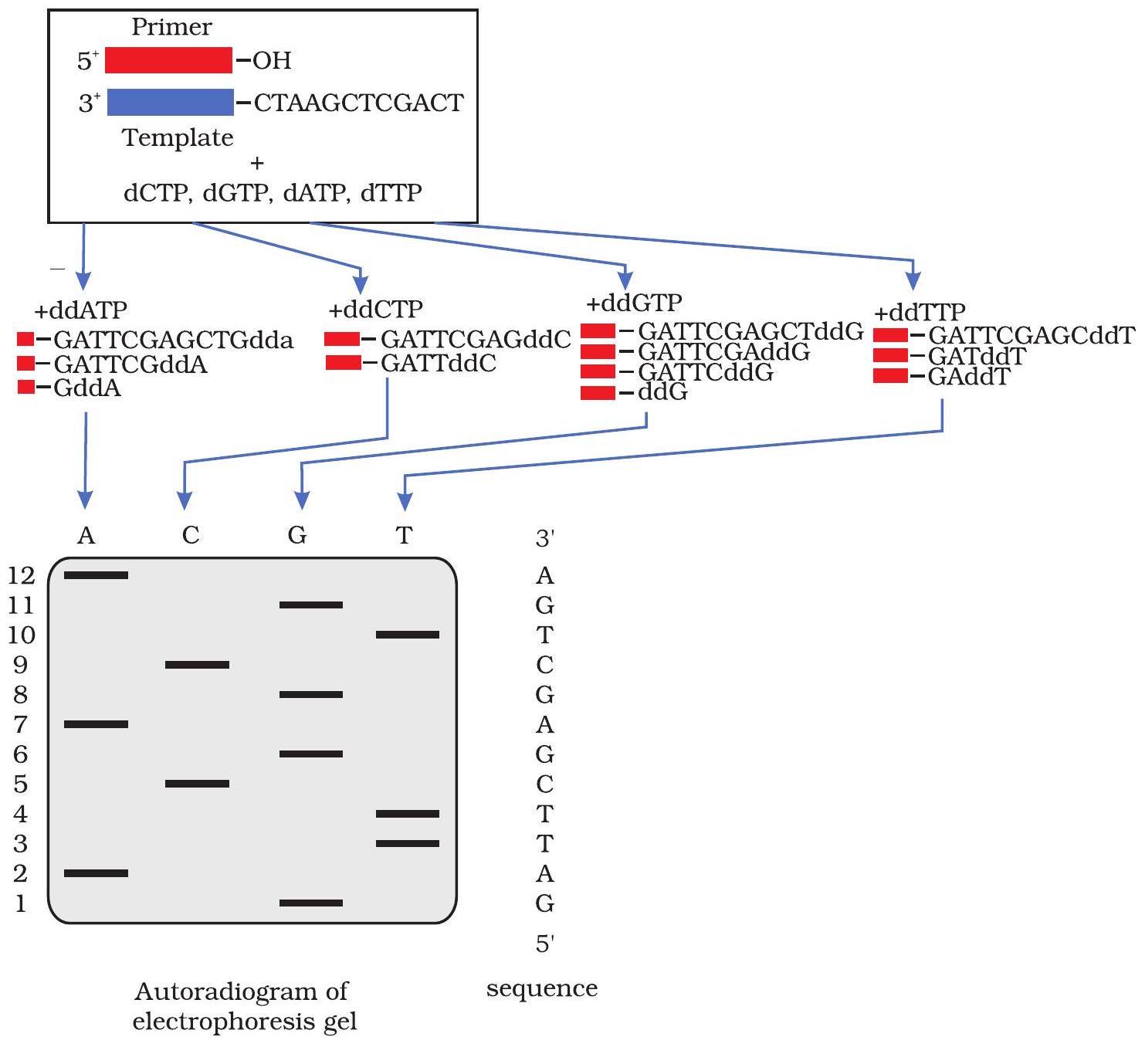
चित्र 12.18: डीएनए अनुक्रमण की सेंगर विधि
(b) रासायनिक विघटन विधि (मैक्सम और गिल्बर्ट विधि)- डीएनए अनुक्रमण की रासायनिक विघटन विधि में, जिस डीएनए खंड का अनुक्रम ज्ञात करना है, उसे आधार-विशिष्ट तरीके से रसायनों का उपयोग करके विघटित किया जाता है जैसा कि चित्र 12.19 में दिखाया गया है। रासायनिक माध्यम से डीएनए के विघटन से पहले, डीएनए को 5’ सिरे पर एंजाइम पॉलीन्यूक्लियोटाइडिल काइनेज और गामा-${}^{32}\mathrm{P}$ लेबल वाले न्यूक्लियोटाइड का उपयोग करके लेबल किया जाता है। उत्पन्न होने वाले खंडों को उच्च संकल्प पृष्ठगामी पॉलिएक्रिलामाइड जेल इलेक्ट्रोफोरेसिस (PAGE) का उपयोग करके अलग किया जाता है ताकि अनुक्रम क्रम को सुलझाया जा सके। इन जेलों को एक्स-रे फिल्म के नीचे रखा जाता है, जिससे काली पट्टियों की एक श्रृंखला प्राप्त होती है जो विकिरण-लेबल वाले डीएनए खंडों की स्थिति दिखाती हैं। खंडों को आकार के अनुसार क्रमबद्ध किया जाता है और इस प्रकार हम डीएनए अणु का अनुक्रम निकाल सकते हैं।

चित्र 12.19: मैक्सम और गिल्बर्ट विधि में प्रयुक्त आधार-विशिष्ट विघटन अभिक्रियाएँ
12.9.2 स्वचालित डीएनए अनुक्रमण
अधिकांश डीएनए अनुक्रमण अब स्वचालित विधि के माध्यम से किया जाता है। ये स्वचालित अनुक्रमक मुख्यतः सैंगर विधि पर आधारित होते हैं। स्वचालित अनुक्रमण में, फ्लोरोसेंट लेबल वाले डाइडीऑक्सीन्यूक्लियोटाइड्स का उपयोग किया जाता है, जिससे रेडियोधर्मी समस्थानिकों की आवश्यकता समाप्त हो गई है। स्वचालित उपकरणों में स्लैब जेल को पॉलिमर से भरी कैपिलरी ट्यूबों ने प्रतिस्थापित कर दिया है। डीएनए अनुक्रमण का स्वचालन इस विधि को कहीं अधिक तेज और विश्वसनीय बना देता है। उदाहरण के लिए, एक वर्ष में, मैनुअल अनुक्रमण का उपयोग करते हुए औसतन एक व्यक्ति 20,000 से 50,000 आधारभूत इकाइयों का अनुक्रमण कर सकता है, जबकि स्वचालित अनुक्रमक इतना लंबा अनुक्रमण कुछ ही घंटों में कर सकता है। इसके अतिरिक्त, स्वचालित विधि का उपयोग करते हुए एक जेल के लिए कुल सामग्री की लागत लगभग आधी होती है, मैनुअल विधि की तुलना में। स्वचालित डीएनए अनुक्रमण में, सभी चार डाइडीऑक्सी
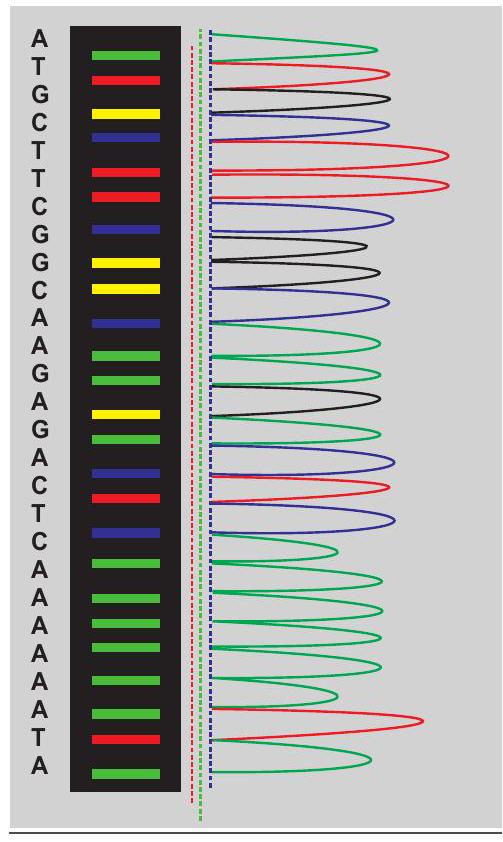
चित्र 12.20: स्वचालित अनुक्रमण का क्रोमैटोग्राम
प्रतिक्रियाएँ एकल ट्यूब में की जाती हैं, जो इसलिए संभव है क्योंकि प्रत्येक डाइडॉक्सीन्यूक्लियोटाइड को एक भिन्न फ्लोरेसेंट डाई से लेबल किया जाता है, जैसे कि रोडामिन 110 (RHO)-A (जो हरा फ्लोरेसेंस देता है), रोडामिन 6G (REG)-C (जो नीला फ्लोरेसेंस देता है), टेट्रामेथिल रोडामिन (TAMRA)-G (जो काला फ्लोरेसेंस देता है) और $\mathrm{X}$-रोडामिन (ROX)-$\mathrm{T}$ (जो लाल फ्लोरेसेंस देता है)। एकल ट्यूब प्रतिक्रिया की सामग्री को जेल की एक लेन पर लोड किया जाता है और इलेक्ट्रोफोरेसिस किया जाता है। अनुक्रम का निर्धारण जेल से बाहर आने वाले डाई के क्रम से किया जाता है। जेल से एक फ्लोरिमीटर और कंप्यूटर जुड़ा होता है जो जेल से बाहर आने वाले खंडों से जुड़े फ्लोरेसेंट डाई का पता लगाता है और रिकॉर्ड करता है। फ्लोरेसेंट डाइडॉक्सीन्यूक्लियोटाइड से लेबल सभी DNA खंडों को एक लेज़र द्वारा ‘पढ़ा’ जाता है और फ्लोरेसेंस तीव्रता को एक डेटा ‘पीक’ में अनुवादित किया जाता है (चित्र 12.20)।
बॉक्स 4
नेक्स्ट-जनरेशन सीक्वेंसिंग (NGS)
NGS विधियों ने बहुत बड़े DNA, जैसे कि संपूर्ण जीनोम का अनुक्रमन सरल बना दिया है, क्योंकि उपरोक्त विधियाँ कुछ Kb आकार तक की छोटी अनुक्रमण विश्लेषण के लिए ही सर्वोत्तम कार्य करती हैं और संपूर्ण जीनोम का विश्लेषण करना कठिन होता है क्योंकि इसमें बहुत अधिक समय और लागत लगेगी। DNA अनुक्रमण का विकास ऐतिहासिक Sanger (Sanger sequencing) और Maxam & Gilbert (Maxam-Gilbert sequencing) विधियों से आज की उच्च-थ्रूपुट तकनीकों तक एक सांस रोक देने वाली गति से हुआ है। पिछले लगभग 30 वर्षों में इन उच्च-थ्रूपुट तकनीकों ने अनुक्रमण डेटा उत्पादन में अत्यधिक घातीय वृद्धि दी है और परिणामस्वरूप प्राप्त डेटा ने आधारभूत जीवविज्ञान से लेकर आपराधिक जाँच और प्रसवपूर्व निदान तक क्रांतिकारी अनुप्रयोगों को जन्म दिया है।
NGS बड़े पैमाने पर समानांतर अनुक्रमण प्रतिक्रियाओं की अनुमति देता है और इसलिए ये एक साथ लाखों या अरबों अनुक्रमण प्रतिक्रियाओं का विश्लेषण करने में सक्षम हैं। व्यापक रूप से प्रयुक्त NGS प्लेटफ़ॉर्म हैं Roche/454 FLX sequencing, Solexa/Illumina और SOLiD प्लेटफ़ॉर्म।
12.10 DNA माइक्रोऐरे
डीएनए माइक्रोऐरे तकनीक एक उच्च-थ्रूपुट हाइब्रिडाइज़ेशन आधारित तकनीक है जिसका उपयोग बड़ी संख्या में डीएनए खंडों का समानांतर विश्लेषण करने के लिए किया जाता है ताकि बड़ी संख्या में जीनों की अभिव्यक्ति की मात्रा का आकलन किया जा सके। यह दो डीएनए स्ट्रैंड्स की उस संपत्ति का उपयोग करती है जिसमें वे एक-दूसरे के साथ पूरक न्यूक्लियोटाइड आधारों के बीच हाइड्रोजन बंध बनाकर जोड़ बनाते हैं। इसलिए, डीएनए माइक्रोऐरे तकनीक का सिद्धांत यह है कि पूरक डीएनए अनुक्रमों का उपयोग चिप पर स्थिर किए गए डीएनए खंडों से हाइब्रिडाइज़ करने के लिए किया जा सकता है और व्यक्तिगत हाइब्रिडाइज़ेशन घटनाओं को दर्ज किया जा सकता है।
हजारों एकल स्ट्रैंड DNA (ssDNA) खंड, जीन ट्रांसक्रिप्ट्स (mRNA) या अन्य जीनोमिक क्षेत्रों के अनुरूप होते हैं, एक छोटे ठोस सतह पर स्थिर किए जाते हैं और इन्हें माइक्रोएरे चिप्स कहा जाता है (चित्र 12.21)। ये चिप्स आमतौर पर कांच या नायलॉन से बनी होती हैं, और इन पर एक विशेष सतह कोटिंग होती है जो चिप पर DNA को स्पॉट करने या ओलिगोन्यूक्लियोटाइड्स के इन सिटू संश्लेषण की अनुमति देती है। चिप्स पर स्थिर किए गए ssDNA खंडों को प्रोब्स कहा जाता है और इन्हें चिप पर पंक्तियों और स्तंभों में व्यवस्थित किया जाता है। प्रोब्स की इस व्यवस्था से चिप पर किसी विशिष्ट खंड का स्थान खोजने में मदद मिलती है। आमतौर पर प्रोब्स या तो cDNAs, PCR एम्प्लिकॉन्स या ओलिगोन्यूक्लियोटाइड्स होते हैं जो mRNAs के अनुरूप होते हैं और इन्हें cDNA या ओलिगोन्यूक्लियोटाइड प्रोब्स कहा जाता है। ओलिगोन्यूक्लियोटाइड प्रोब आधारित एरे बहुत लोकप्रिय हैं। ये प्रोब्स छोटे अनुक्रम होते हैं जो किसी एक प्रजाति के ज्ञात/अनुमानित ट्रांसक्रिप्ट्स के पूरक होते हैं, और हजारों जीनों की अभिव्यक्ति को समानांतर में विश्लेषण करने की अनुमति देते हैं।
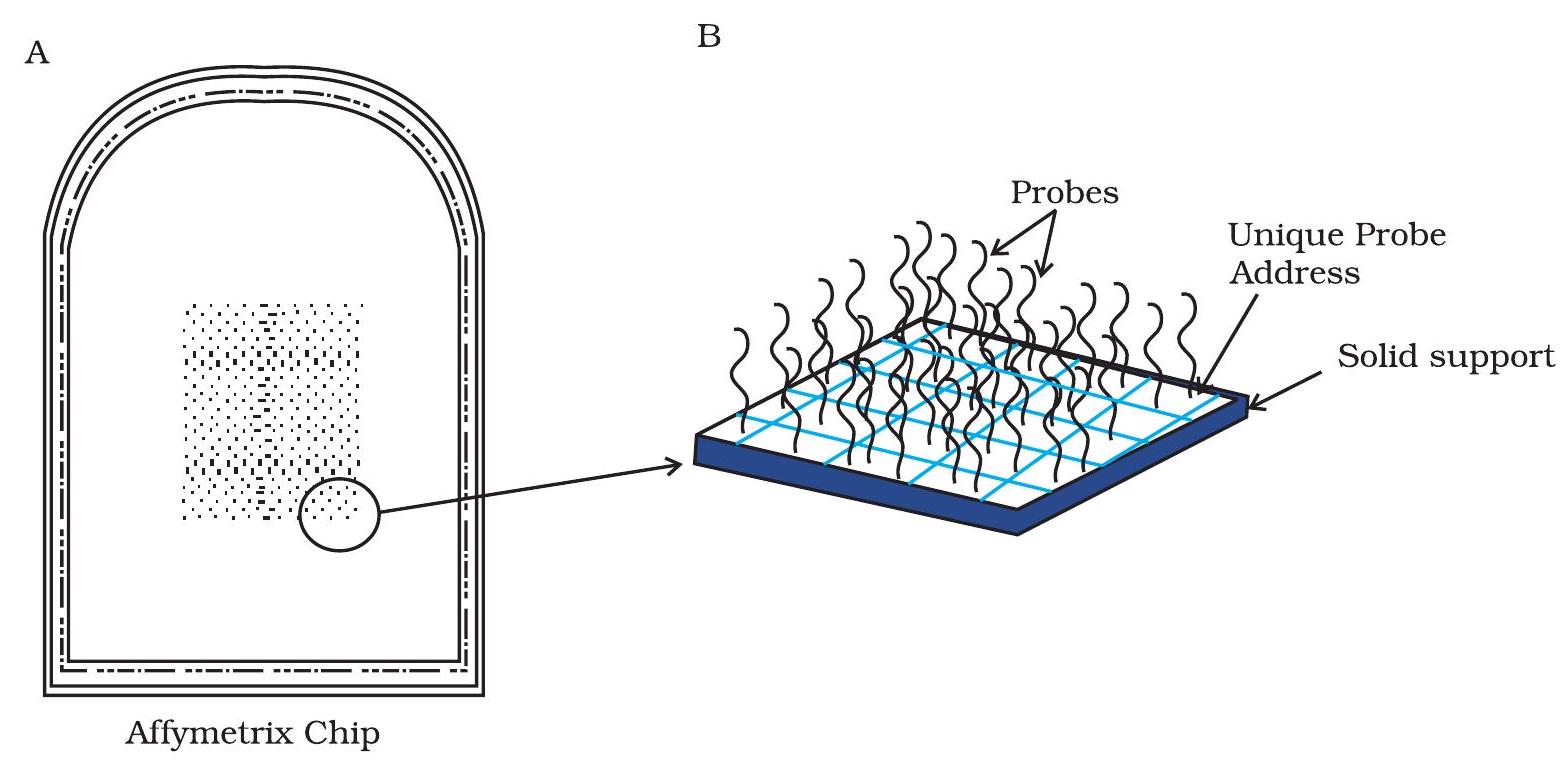
चित्र 12.21: DNA माइक्रोएरे चिप
एक विशिष्ट माइक्रोएरे प्रयोग में निम्नलिखित चरण शामिल होते हैं (चित्र 12.22)।
1. mRNA का निष्कर्षण
2. प्रोब लेबलिंग
3. हाइब्रिडाइजेशन और वॉशिंग
4. स्कैनिंग और डेटा विश्लेषण
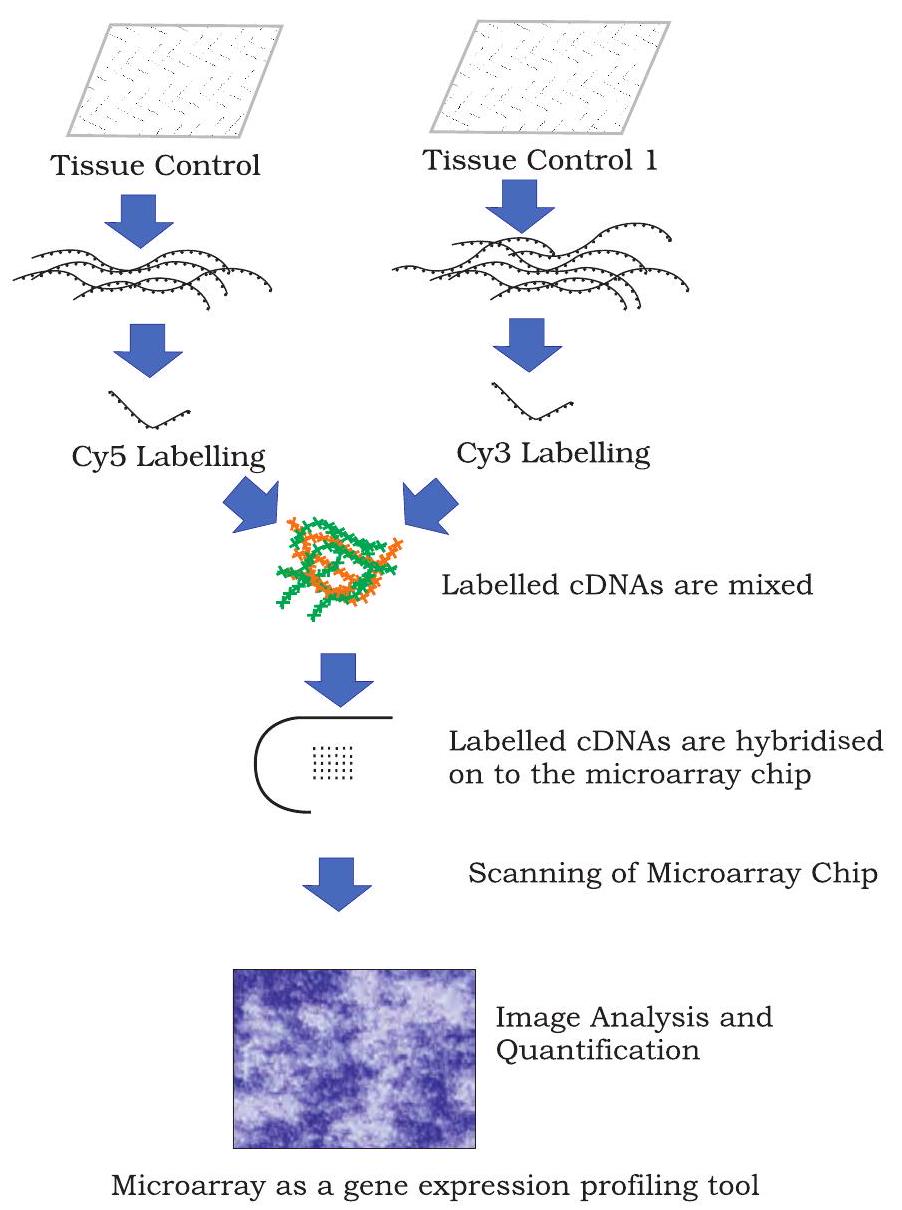
चित्र 12.22: एक cDNA माइक्रोऐरे प्रयोग का उदाहरण
mRNA का निष्कर्षण
एक कोशिका में, एक जीन से ट्रांसक्रिप्शन mRNA उत्पन्न करता है, जो अनुवाद द्वारा प्रोटीन बनाता है। आवश्यकता के अनुसार, एक ही जीन की कई RNA प्रतियाँ बनती हैं। इसलिए किसी विशेष जीन की सक्रियता को mRNA की मात्रा निर्धारित करके मापा जा सकता है। चूँकि mRNA बहुत आसानी से विघटित हो जाता है, इसे रिवर्स ट्रांसक्रिप्शन द्वारा सम्पूरक DNA (cDNA) में बदला जाता है, जो अधिक स्थिर होता है और कोशिका में सक्रिय रूप से ट्रांसक्राइब हो रहे जीनों को दर्शाता है।
प्रोब लेबलिंग
cDNA खंडों को प्रतिबंधक एंडोन्यूक्लिएसेज़ से काटा जाता है और परिणामी खंडों को फ्लोरोक्रोम रंगों से जोड़ा जाता है। Cy3 और Cy5 इस उद्देश्य के लिए सबसे अधिक प्रयुक्त होने वाले फ्लोरेसेंट रंग हैं। इस प्रकार, प्रोब हजारों लेबल किए गए न्यूक्लिक अम्ल खंडों से बने होते हैं।
हाइब्रिडाइज़ेशन और वॉशिंग
लेबल किए गए डीएनए खंडों को माइक्रोऐरे चिप के साथ हाइब्रिडाइज़ किया जाता है। हाइब्रिडाइज़ेशन के लिए, डीएनए चिप्स (जिनमें हजारों सिंगल स्ट्रैंडेड प्रोब होते हैं) को एक्सपोज़ किया जाता है और उन्हें सिंगल स्ट्रैंडेड फ्लोरोक्रोम लेबल वाले डीएनए खंडों के साथ रिएक्ट होने दिया जाता है। ये खंड चिप पर अपने कॉम्प्लिमेंटरी सिंगल स्ट्रैंडेड प्रोब से बाइंड करते हैं और डुप्लेक्स बनाते हैं। बने हुए डुप्लेक्स की संख्या उसके डीएनए सेगमेंट्स की संख्या का प्रतिबिंब होती है जो प्रोब के कॉम्प्लिमेंटरी होते हैं। अन्य डीएनए खंड, जो चिप पर अपने कॉम्प्लिमेंटरी प्रोब नहीं ढूंढ पाते, उन्हें वॉश कर दिया जाता है।
स्कैनिंग और डेटा विश्लेषण
अंत में, हाइब्रिडाइज़ किए गए लेबल वाले डीएनए खंडों वाले माइक्रोऐरे चिप को एक अत्याधुनिक स्कैनर का उपयोग करके स्कैन किया जाता है। इमेज विश्लेषण एक परिष्कृत सॉफ्टवेयर प्रोग्राम का उपयोग करके किया जाता है जो यह निर्धारित करने में मदद करता है कि चिप पर टारगेट प्रोब से कितना लेबल वाला सीडीएनए बाइंड हुआ है। इन टारगेट प्रोब के अद्वितीय पते और विशिष्ट जीनों के साथ उनके संबंध का उपयोग डेटा की व्याख्या और मात्रा निर्धारण के लिए किया जाता है। माइक्रोऐरे डेटा विश्लेषण सॉफ्टवेयर विभिन्न रंगों का उपयोग करता है ताकि एक स्थिति में जीनों की अभिव्यक्ति स्तर को दूसरी स्थिति के सापेक्ष दर्शाया जा सके। जीन जिनकी अभिव्यक्ति एक स्थिति में दूसरी स्थिति की तुलना में बढ़ जाती है, उन्हें अपर-रेग्युलेटेड जीन कहा जाता है, और जिनकी अभिव्यक्ति घट जाती है, उन्हें डाउन-रेग्युलेटेड जीन कहा जाता है। परंपरागत रूप से, अपर-रेग्युलेटेड जीन को दर्शाने के लिए हरा रंग और डाउन-रेग्युलेटेड जीन को दर्शाने के लिए लाल रंग का उपयोग किया जाता है।
12.11 प्रवाह कोशिका मापन (Flow Cytometry)
जीवों में कोशिकाओं की विविध किस्में होती हैं, जो कोई न कोई कार्य करती हैं। किसी विशिष्ट कोशिका की भौतिक या रासायनिक विशेषताओं को समझना विभिन्न दृष्टिकोणों से मूल्यवान सूचना प्रदान कर सकता है। पहले उल्लिखित किसी भी मापदंड पर आधारित कोशिकाओं की ऐसी समझ का उपयोग कोशिकाओं की गुणात्मक या मात्रात्मक माप के लिए किया जा सकता है। भौतिक या रासायनिक गुणों के आधार पर कोशिकाओं की मात्रा निर्धारित करने का इतास 1950 के दशक के अंत में प्रयुक्त Coulter काउंटर तक जाता है, जिसे निलंबन में कणों की मात्रा निर्धारित करने के लिए आविष्कारित किया गया था और यह सिद्धांत पर आधारित था कि कण के आयतन के अनुपात में प्रतिबाधा में परिवर्तन होता है। ऐसी प्रतिबाधा विद्युत क्षेत्र के अंतर्गत तब पता लगाई जा सकती है जब कण दो कक्षों के बीच विभाजित क्षेत्र से गुजरता है जिनमें विद्युत अपघट्य विलयन होता है (चित्र 12.23)।
आज के दिन का प्रवाह कोशिकामापन भी उसी प्रतिरोध के सिद्धांत पर आधारित है जो कण के बहते हुए द्रव चैनल से गुजरने के कारण उत्पन्न होता है। यह प्राप्त करने के लिए, कोशिकाओं (नमूने) को प्रवाह कोशिकामापक से इस प्रकार गुजारा जाता है कि कोशिकाएँ द्रव धारा में एक-एक करके बहती हैं। मार्ग में स्थिर लेज़र किरणें कोशिकाओं को उनके गुणों या उन पर लगाए गए रंग के आधार पर एक-एक करके पहचानती हैं। फिर विचलित प्रकाश को एक संवेदक द्वारा पकड़ा जाता है, जो प्रकाश स्रोत की तीव्रता और विचलित प्रकाश के आधार पर कण या कोशिका के बारे में जानकारी प्रदान करता है। ये संवेदक या तो प्रकाश किरण की रेखा में हो सकते हैं ताकि सतह के गुण या आयतन का पता लगाया जा सके, या ये लंबवत हो सकते हैं, जो आंतरिक गुणों का पता लगा सकते हैं। संकेत संवेदक द्वारा प्राप्त किए जाते हैं और अंततः वस्तु की एक व्यापक छवि उभरती है (चित्र 12.23)। इसी प्रकार, प्रतिरक्षा तंत्र में मौजूद कोशिकाओं की सतह पर हजारों प्रतिजन हो सकते हैं। किसी कोशिका में किसी प्रतिजन या प्रोटीन का पता लगाने के लिए, विशिष्ट प्रतिरक्षी अक्सर प्रयुक्त किए जाते हैं। सरल पहचान और स्थानीयकरण के उद्देश्य से प्रतिरक्षियों को लेबल करने के लिए प्रतिदीप्ति रंग आमतौर पर प्रयुक्त किया जाता है। विभिन्न प्रतिदीप्ति रंगों से सक्रिय किए गए मिश्रण की विभिन्न कोशिकाओं को इस तकनीक द्वारा यांत्रिक रूप से भी अलग किया जा सकता है जिसे प्रवाह कोशिकामापन कहा जाता है।
कभी-कभी, विभिन्न फ्लोरोसेंट डाई से लेबल किए गए कोशिकाओं के मिश्रण को उस पर मौजूद फ्लोरोसेंस के आधार पर पहचाना जाता है। कोशिकाओं के पृथक्करण के उद्देश्य से, पहले फ्लोरोसेंट लेबल वाली कोशिकाओं के मिश्रण को एक चार्जिंग इलेक्ट्रोड पर लोड किया जाता है और फिर इसे बूंद-बूंद करके छोड़ा जाता है। गिराई गई कोशिकाओं के मार्ग में मौजूद लेजर आधारित सेंसर इन कोशिकाओं को उनके फ्लोरोसेंट लेबल के आधार पर पहचानता है और यह जानकारी कंप्यूटर में दर्ज की जाती है, जिसे चित्र 12.23 में दिखाए गए प्लॉट के रूप में देखा जा सकता है।
आधुनिक, तेज और परिष्कृत जैविक उपकरणों और तकनीकों के विकास ने जैविक अध्ययनों को अधिक सटीक, तेज, मात्रात्मक और पुनरुत्पादनीय बना दिया है।
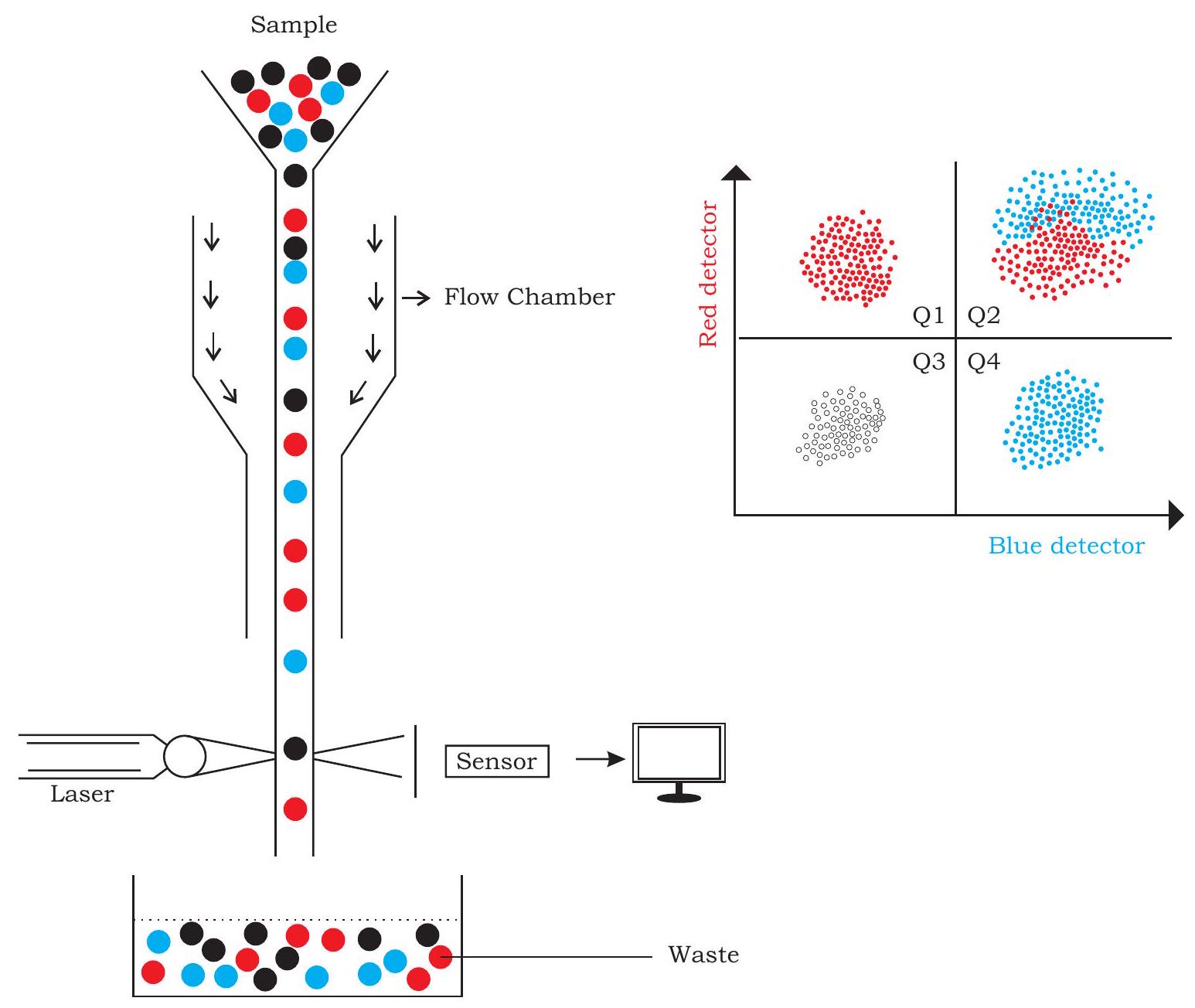
चित्र 12.23: प्रवाह कोशिका मापन का आरेखीय चित्रण
सारांश
- साधारण प्रकाश सूक्ष्मदर्शी हमें ऐसी वस्तुओं को देखने में सक्षम बनाता है जो अन्यथा हमारी नग्न आँखों से देखने के लिए बहुत छोटी होती हैं। कोशिकाओं की आंतरिक संरचना के सूक्ष्म विवरणों का अध्ययन इतना विविध है कि इसके लिए कंट्रास्ट सूक्ष्मदर्शी या इलेक्ट्रॉन सूक्ष्मदर्शी जैसे अधिक परिष्कृत सूक्ष्मदर्शी की आवश्यकता होती है।
- विभिन्न प्रकार के सेंट्रीफ्यूज जैसे विभेदक सेंट्रीफ्यूज, उच्च गति सेंट्रीफ्यूज, घनत्व प्रवाह सेंट्रीफ्यूज और अल्ट्रासेंट्रीफ्यूज, कोशिकाओं के भीतर उपस्थित विभिन्न जैवअणुओं को उनके घनत्व के आधार पर पृथक करने में मदद करते हैं, जो गुरुत्वाकर्षण बल के प्रभाव और अक्ष के चारों ओर उच्च गति से घूर्णन करते हुए अपकेंद्र बल का उपयोग करते हैं।
- विद्युत्कणिका विधि द्वारा, DNA, RNA और प्रोटीन जैसे कई महत्वपूर्ण जैविक अणुओं को विभाजित और अध्ययन किया जा सकता है, जो कि विद्युत क्षेत्र के प्रभाव में बड़े अणुओं के आवेश से द्रव्यमान अनुपात के आधार पर होता है।
- एंजाइम-लिंक्ड इम्यूनोसॉर्बेंट एसे (ELISA) एक अत्यधिक संवेदनशील और मात्रात्मक प्रतिरक्षात्मक परीक्षण है, जो दिए गए नमूने में एंटीजन और एंटीबॉडी सांद्रता को मापने के लिए उपयोग किया जाता है। विभिन्न प्रकार के ELISA जैसे प्रत्यक्ष, अप्रत्यक्ष, सैंडविच और प्रतिस्पर्धी, निदान और वैज्ञानिक अध्ययनों में उपयोग किए जाते हैं।
- विभिन्न प्रकार के क्रोमैटोग्राफी तरीके: अधिशोषण क्रोमैटोग्राफी, आयन-विनिमय क्रोमैटोग्राफी, सहचारी क्रोमैटोग्राफी और गैस क्रोमैटोग्राफी, प्रोटीन, पेप्टाइड, अमीनो अम्ल, शर्करा, न्यूक्लिक अम्ल, क्षार, विटामिन और स्टेरॉयड के शुद्धिकरण के लिए उपयोग किए जाते हैं।
- इसी प्रकार, अणुओं की रासायनिक संरचना को स्पष्ट करने के लिए स्पेक्ट्रोस्कोपी तकनीकों का उपयोग किया जाता है। रंगमिति तकनीक द्रव नमूने से गुजरने वाले प्रकाश के संचरण और अवशोषण को मापती है और नमूने की सांद्रता को मापती है।
- फ्लोरेसेंस इन सिटू हाइब्रिडाइजेशन (FISH) तकनीक फ्लोरेसेंट अणुओं का उपयोग करती है जो गुणसूत्र के अत्यधिक पूरक क्षेत्रों से बंधते हैं और किसी विशिष्ट जीन की पहचान व्यक्तिगत गुणसूत्र में करने में सहायता करते हैं और इस प्रकार गुणसूत्रीय असामान्यताओं को समझने में महत्वपूर्ण भूमिका निभाते हैं।
- DNA की अनुक्रमण क्रम वंशानुगत आनुवंशिक जानकारी को समाहित करता है जो सभी जीवित जीवों के विकासात्मक कार्यक्रमों का आधार बनाता है। DNA अनुक्रमण की उपलब्धता ने जैविक अनुसंधान और खोज को महत्वपूर्ण रूप से तेज कर दिया है। DNA अनुक्रमण की सैंगर विधि लगभग चार दशक पहले विकसित की गई थी और आज भी नियमित अनुक्रमन अनुप्रयोगों के लिए उपयोग की जाती है। इन दिनों अनेक अन्य अनुक्रमन तरीके उपलब्ध हैं जिन्हें नेक्स्ट जनरेशन सीक्वेंसिंग कहा जाता है जैसे; Roche/454, Solexa/Illumina और SOLiD प्लेटफॉर्म।
- DNA सूक्ष्मसरण विश्लेषण बड़ी संख्या में जीनों की अभिव्यक्ति स्तरों का विश्लेषण करने में सहायता करता है।
- प्रवाह कोशिकामिति में, कोशिकाएँ एक लेज़र किरण से गुजरती हैं, जिससे उनके भौतिक और रासायनिक गुणों का विश्लेषण किया जा सकता है।
अभ्यास
1. इलेक्ट्रोफोरेसिस में एथिडियम ब्रोमाइड का कार्य है
(a) इलेक्ट्रोफोरेसिस की प्रगति को ट्रैक करना
(b) डीएनए अणुओं को दृश्य बनाना
(c) डीएनए अणुओं को अलग करना
(d) डीएनए अणुओं को आवेश प्रदान करना
2. सुमेलित कीजिए
| कॉलम I | कॉलम II | |
|---|---|---|
| (a) | आयनिक सॉल्यूट्स का पृथक्करण |
एफिनिटी क्रोमैटोग्राफी (AFC) |
| (b) | विभिन्न बाइंडिंग विशिष्टताओं वाले जैव-अणुओं का पृथक्करण |
गैस क्रोमैटोग्राफी (GC) |
| (c) | वाष्पशील घटकों का पृथक्करण |
आयन-एक्सचेंज क्रोमैटोग्राफी (IEC) |
3. मास स्पेक्ट्रोमेट्री का उपयोग किया जाता है
(a) अज्ञात यौगिकों की पहचान करने के लिए
(b) अणुओं की संरचना को स्पष्ट करने के लिए
(c) यौगिकों की मात्रा निर्धारित करने के लिए
(d) उपरोक्त सभी
4. निम्नलिखित सारणी को एंटीजन के संदर्भ में सुमेलित कीजिए
| एंटीजन | एंटीबॉडी | प्रक्रिया | |
|---|---|---|---|
| (i) | मुक्त | सतह से बंधी | प्रत्यक्ष ELISA |
| (ii) | बंधी | केवल एक लेबल किए गए प्राइमरी एंटीबॉडी का उपयोग |
अप्रत्यक्ष ELISA |
| (iii) | बंधी | लेबल किए गए सेकेंडरी एंटीबॉडी का उपयोग |
सैंडविच ELISA |
5. डीएनए जेल इलेक्ट्रोफोरेसिस में,
I. लंबे डीएनए खंड वेल के पास रहते हैं।
II. लंबे डीएनए खंड जेल के धनात्मक सिरे की ओर बढ़ते हैं।
III. छोटे डीएनए खंड जेल के धनात्मक सिरे के पास बढ़ते हैं।
IV. छोटे डीएनए खंड वेल के पास रहते हैं।
उपरोक्त में से कौन-से विकल्प सही हैं
(a) I और III
(b) II और IV
(c) केवल II
(d) उपरोक्त में से कोई नहीं
6. किसी वस्तु की सतह का स्पष्ट प्रतिबिम्ब प्राप्त करने के लिए आप निम्नलिखित में से किस सूक्ष्मदर्शी को प्राथमिकता देंगे
(a) संचरण इलेक्ट्रॉन सूक्ष्मदर्शी
(b) स्कैनिंग इलेक्ट्रॉन सूक्ष्मदर्शी
(c) प्रावस्था-विरोध सूक्ष्मदर्शी
(d) प्रतिदीप्ति सूक्ष्मदर्शी
7. सुमेलित कीजिए:
| स्तंभ I | स्तंभ II | |
|---|---|---|
| (a) | एन्गवाल और पर्लमैन | सूक्ष्मदर्शन |
| (c) | रॉबर्ट हुक | डीएनए अनुक्रमण |
| (c) | सैंजर | एलाइज़ा |
8. निम्नलिखित में से कौन-सी तकनीक बड़ी संख्या में जीनों की अभिव्यक्ति की मात्रा निर्धारित करने के लिए उपयुक्त है
(a) द्रव्य-वर्ग स्पेक्ट्रोमेट्री
(b) सूक्ष्म-श्रेणी
(c) फिश
(d) ऐगरोज जेल वैद्युतकणसंचलन
9. निम्नलिखित सूक्ष्मदर्शी तकनीकों के बीच अंतर बताइए
(a) स्कैनिंग इलेक्ट्रॉन सूक्ष्मदर्शी (SEM) और संचरण इलेक्ट्रॉन सूक्ष्मदर्शी (TEM)
(b) अंध-क्षेत्र सूक्ष्मदर्शी और उज्ज्वल-क्षेत्र सूक्ष्मदर्शी
(c) प्रावस्था-विरोध सूक्ष्मदर्शी और संयुक्त-तल सूक्ष्मदर्शी
10. ऐगरोज जेल वैद्युतकणसंचलन का सिद्धांत चर्चा कीजिए। 11. एक ऐसा ट्रैकिंग रंजक नाम बताइए जो वैद्युतकणसंचलन के दौरान डीएनए के साथ-साथ प्रोटीन को भी ट्रैक करने के लिए प्रयुक्त होता है। यदि आप वैद्युतकणसंचलन के दौरान नमूने में ट्रैकिंग रंजक डालना भूल जाएँ तो क्या होगा? 12. दो पॉलिएक्रिलैमाइड जेल A और B तैयार किए गए। जेल A में $4 %$ ऐक्रिलैमाइड था जबकि जेल B में $12 %$ ऐक्रिलैमाइड था। दी गई सूचना के आधार पर निम्नलिखित प्रश्नों के उत्तर दीजिए
(a) कौन-सा जेल अधिक कठोर है: A या B?
(b) कौन-सा जेल प्रोटीनों को अधिक घर्षण प्रदान करता है: $\mathrm{A}$ या $\mathrm{B}$ ?
(c) किस जेल (A या B) का उपयोग कम आण्विक भार वाले प्रोटीनों के मिश्रण को पृथक करने के लिए किया जाएगा?
(d) किस जेल (A या B) का उपयोग कम और उच्च दोनों आण्विक भार वाले प्रोटीनों के मिश्रण को पृथक करने के लिए किया जाएगा?
13. क्रोमैटोग्राम क्या है? तीन भिन्न सॉल्यूट्स वाले मिश्रण के क्रोमैटोग्राम का एक सुपर लेबल किया गया चित्र बनाएं।
14. FISH का सिद्धांत समझाइए। FISH तकनीक को क्रोमोसोम पेंटिंग में कैसे लागू किया जाता है? क्रोमोसोम पेंटिंग के क्या लाभ हैं?
15. स्पेक्ट्रोस्कोपी तकनीकों के विभिन्न अनुप्रयोगों का उल्लेख कीजिए।
16. UV-दृश्य स्पेक्ट्रोफोटोमीटर के प्रमुख घटक क्या हैं? प्रत्येक को संक्षेप में समझाइए।
17. DNA अनुक्रमण की Sanger विधि और Maxam तथा Gilbert विधि के बीच प्रमुख अंतर लिखिए।
18. प्रवाह कोशिका मापन (flow cytometry) का सिद्धांत लिखिए।



