Chapter 04 Application of Recombinant DNA Technology
पुनर्संयोजी डीएनए (rDNA) प्रौद्योगिकी ने विभिन्न तरीकों से हमारे जीवन में क्रांति ला दी है। पिछले कुछ वर्षों में सफल खोजों ने कई समस्याओं के समाधान प्रदान किए हैं। इनमें किसी व्यक्ति की पहचान स्थापित करना, अन्य जीवों में विदेशी जीनों का प्रवेश, कई बीमारियों का निदान और उनका उपचार, चिकित्सीय एजेंटों/अणुओं का उत्पादन आदि शामिल हैं। इस अध्याय में, छात्रों को rDNA प्रौद्योगिकी के कुछ अनुप्रयोगों से परिचित कराया जाएगा, जैसे डीएनए फिंगरप्रिंटिंग, ट्रांसजेनिक जीवों का विकास, जीन थेरेपी, पुनर्संयोजी टीके और चिकित्सीय एजेंटों/अणुओं का उत्पादन।
4.1 डीएनए फिंगरप्रिंटिंग
जैसा कि आप जानते हैं, प्रत्येक व्यक्ति के डीएनए की रासायनिक संरचना समान होती है और यह चार आधारों से बनी होती है: A (एडेनिन), G (ग्वानिन), $\mathrm{C}$ (साइटोसिन) और $\mathrm{T}$ (थाइमिन)। डीएनए स्ट्रैंड्स के साथ इन आधारों की व्यवस्था किसी व्यक्ति के लिए विशिष्ट होती है। मानव जीनोम में $3.2 \times 10^{9} \mathrm{bp}$ होते हैं। हालांकि, मानव जीनोम में बहुत कम विशिष्टता होती है। मनुष्यों के बीच लगभग $99.9%$ जीनोम समान होता है और शेष $0.1%$ जीनोम में वंशानुगत विविधताओं के स्थान होते हैं। यही डीएनए में विविधताएं हैं जो हमें प्रत्येक को अद्वितीय बनाती हैं।
इन अंतरों की पहचान करना दो व्यक्तियों के बीच संबंधितता निर्धारित करने में सहायक होता है। इसे प्राप्त करने का एक तरीका डीएनए अनुक्रमण है। हालांकि, हर बार व्यक्तियों के डीएनए का अनुक्रमण और तुलना करना व्यावहारिक नहीं होगा। इसलिए, मानव डीएनए में वंशानुगत विचरणों का अध्ययन और तुलना बिना अनुक्रमण के करने के लिए, 1984 में लेस्टर विश्वविद्यालय में ब्रिटिश आनुवंशिकविद् सर अलेक जेफ्रीज़ द्वारा एक नई तकनीक विकसित की गई जिसे ‘डीएनए फिंगरप्रिंटिंग’ कहा जाता है।
मानव जीनोम का $90 %$ से अधिक भाग ऐसा होता है जो प्रोटीन के लिए कोड नहीं करता है। किसी व्यक्ति के जीनोम के गैर-कोडिंग क्षेत्रों के भीतर, न्यूक्लियोटाइड्स की छोटी अनुक्रमणाएँ होती हैं जो एक लोकस पर टैंडम में कई बार दोहराई जाती हैं (शॉर्ट टैंडम रिपीट्स) जिन्हें वीएनटीआर (वेरिएबल नंबर टैंडम रिपीट) कहा जाता है। वीएनटीआर को सामान्यतः माइक्रोसैटेलाइट्स (1 से $9 \mathrm{bp}$ तक के दोहराए गए अनुक्रम) और मिनिसैटेलाइट्स (10 से $100 \mathrm{bp}$ तक के दोहराए गए अनुक्रम) में विभाजित किया जाता है जैसा कि चित्र 4.1 में दिखाया गया है।

चित्र 4.1: 3 एलील्स में वीएनटीआर का आरेखीय प्रतिनिधित्व
ये अनुक्रम बहुधा बहुरूपता (या विचरण) दिखाते हैं और डीएनए फिंगरप्रिंटिंग का आधार बनाते हैं। इसके अतिरिक्त, चूँकि बहुरूपता माता-पिता से संतान में वंशानुगत होती है, डीनए फिंगरप्रिंटिंग विवादों की स्थिति में पितृत्व परीक्षण का आधार होती है।

चित्र 4.2: एक जोड़े के बच्चे का पता लगाने के लिए डीएनए प्रोफाइलिंग। उपरोक्त चित्र में, एक बच्चे के डीएनए प्रोफाइल की तुलना पिता और माता से की जाती है ताकि पितृत्व की पुष्टि हो सके। यहाँ, पिता और माता बच्चा 1 के माता-पिता हैं लेकिन बच्चा 2 के नहीं।
हम हर वीएनटीआर लोकस की दो भिन्न प्रतियाँ रखते हैं क्योंकि हम एक गुणसूत्र माता से और एक पिता से प्राप्त करते हैं। सबसे सरल तरीके से, डीएनए फिंगरप्रिंटिंग डीएनए के प्रतिबंधन पाचन का उपयोग करके की जा सकती है। इस तकनीक को प्रतिबंधन खंड लंबाई बहुलकता (आरएफएलपी) कहा जाता है। आरएफएलपी में, व्यक्ति के डीएनए को विशिष्ट क्षेत्रों में प्रतिबंधन एंजाइम से पचाने के बाद, अद्वितीय पैटर्न उत्पन्न होते हैं जिनका उपयोग आनुवंशिक विश्लेषण और पहचान के लिए किया जाता है (चित्र 4.2)।
संकल्पना के अनुसार, चित्र 4.3 में दिखाया गया डीएनए फिंगरप्रिंटिंग सही है, लेकिन वास्तव में, जेल पर व्यक्तिगत बैंडों की पहचान करना कठिन होता है और इसलिए, वीएनटीआर प्रोब का उपयोग करके संकरण (दक्षिणी संकरण) किया जाता है। वीएनटीआर प्रोब के साथ संकरण से बैंडों का एक पैटर्न उत्पन्न होता है जो हर व्यक्ति के लिए विशेष होता है (चित्र 4.3)। इस तकनीक में शामिल चरण इस प्रकार हैं:
1. डीएनए को विभिन्न नमूनों जैसे रक्त, बाल, त्वचा, वीर्य और बुक्कल स्वैब आदि से अलग किया जाता है।
2. एकत्र किए गए डीएनए नमूने को एक या अधिक प्रतिबंधन एंजाइमों का उपयोग करके विभिन्न आकारों के कई खंडों में काटा जाता है।
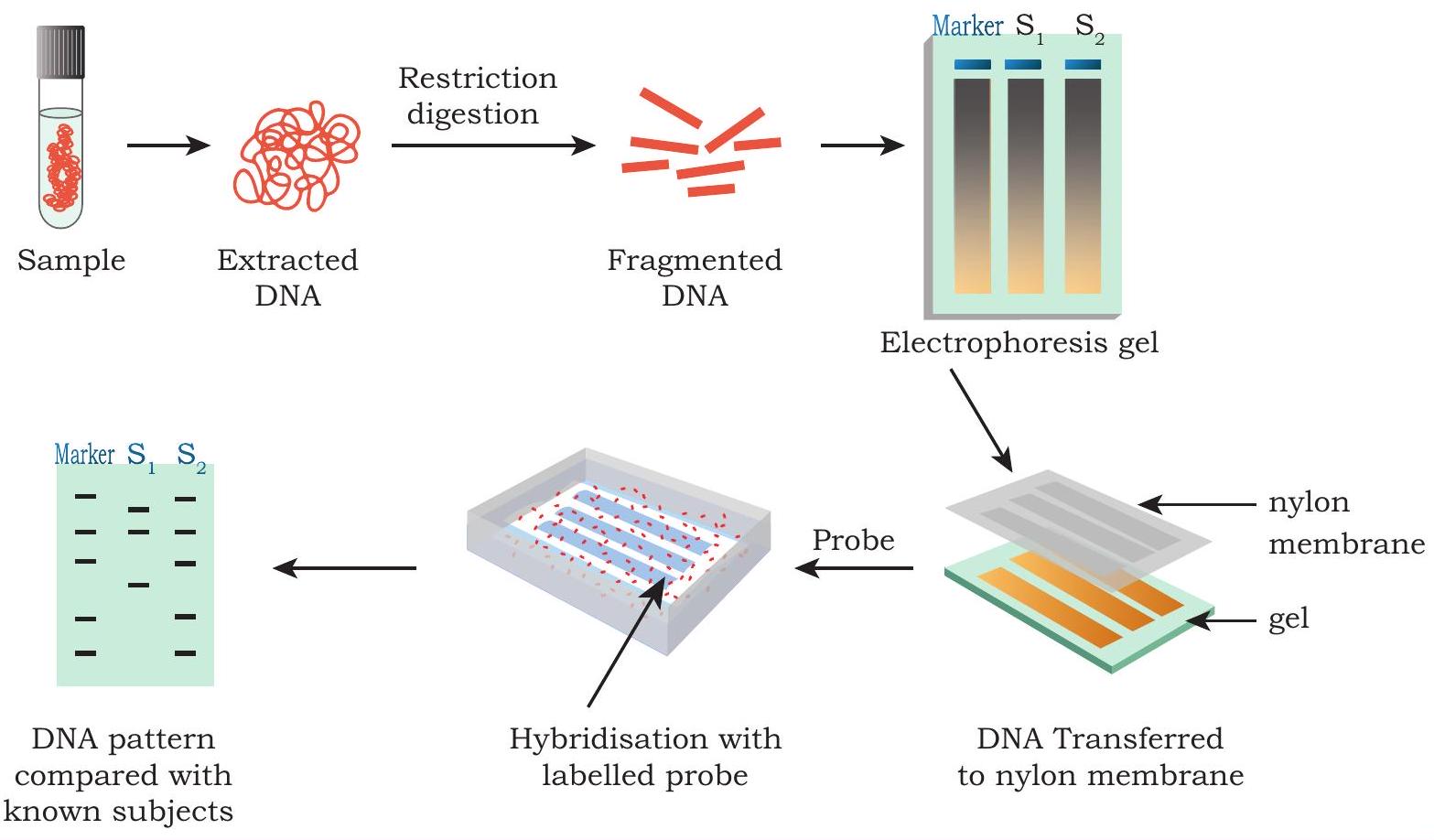
चित्र 4.3: डीएनए फिंगरप्रिंटिंग में शामिल चरण
3. डीएनए खंडों को तब अगरोज जेल इलेक्ट्रोफोरेसिस द्वारा अलग किया जाता है। विभिन्न आकारों के डीएनए टुकड़ों को आकार के आधार पर अलग किया जाता है।
4. जेल पर अलग हुआ डीएनए इस प्रकार नाइट्रोसेल्युलोज/नायलॉन झिल्ली पर स्थानांतरित किया जाता है। नायलॉन झिल्ली को तब तीन मिनट के लिए यूवी ट्रांसइलुमिनेटर पर यूवी विकिरण के संपर्क में रखा जाता है या दो घंटे तक 80°C पर बेक किया जाता है ताकि डीएनए को स्थायी रूप से झिल्ली से जोड़ा जा सके।
5. फिर, वीएनटीआर प्रोब्स (एकल डीएनए स्ट्रैंड के लेबल वाले हिस्से जो पूरक लक्ष्य अनुक्रमों की उपस्थिति का पता लगाने के लिए उपयोग किए जाते हैं) का उपयोग करके सदर्न हाइब्रिडाइजेशन किया जाता है।
6. अंत में, हाइब्रिडाइज़ हुए डीएनए खंडों का पता लगाया जाता है।
7. डीएनए बैंडों के पैटर्न प्रत्येक व्यक्ति के लिए अत्यधिक विशिष्ट होते हैं और इनका उपयोग फॉरेंसिक और पितृत्व विवादों में किया जा सकता है।
नोट: पॉलिमरेज चेन रिएक्शन (पीसीआर) का उपयोग अक्सर तकनीक की संवेदनशीलता बढ़ाने के लिए किया जाता है क्योंकि यह डीएनए की मात्रा की परवाह किए बिना डीएनए को प्रवर्धित करता है।
डीएनए फिंगरप्रिंटिंग के अनुप्रयोग
1. VNTR पैटर्न का उपयोग किसी व्यक्ति के पितृत्व और मातृत्व को सुनिश्चित करने के लिए किया जाता है, यह देखते हुए कि ये पैटर्न उनके माता-पिता से विरासत में मिलते हैं। चूँकि ये पैटर्न अत्यंत विशिष्ट होते हैं, इसलिए माता-पिता का VNTR पैटर्न उनके ज्ञात संतानों के VNTR पैटर्न से पुनः निर्मित किया जा सकता है। इसलिए, माता-पिता और संतान के VNTR पैटर्न का उपयोग पितृत्व और मातृत्व के मामलों को सुलझाने के लिए किया जा सकता है।
2. अपराध के स्थल से रक्त, बाल, त्वचा, वीर्य आदि जैसे ऊतकों से अलग किया गया DNA, VNTR पैटर्न विश्लेषण के लिए साक्ष्य के रूप में उपयोग किया जाता है, जहाँ DNA अलगाव के इस पैटर्न की तुलना अपराधी या संदिग्ध के VNTR पैटर्न से दोष या निर्दोषता स्थापित करने के लिए की जाती है। इसलिए, DNA फिंगरप्रिंटिंग आपराधिक पहचान और फॉरेंसिक अध्ययनों में सहायक होता है।
3. DNA फिंगरप्रिंटिंग का उपयोग जीवाश्मों से प्राप्त DNA निष्कर्षों की तुलना आधुनिक समकक्षों से करने के लिए भी किया जाता है और इसलिए, यह विकासवादी जीव विज्ञान अध्ययनों में महत्वपूर्ण स्थान रखता है।
4. किसी विशेष विकार से पीड़ित लोगों का DNA प्रोफ़ाइल, या इसकी तुलना बड़ी संख्या में विकार से पीड़ित और बिना विकार वाले लोगों से करने से, वंशानुगत विकारों के अध्ययन में DNA पैटर्न की पहचान करने में मदद मिलती है।
5. सामाजिक सुरक्षा संख्या, फोटो आईडी और अन्य अधिक नियमित तरीकों के अतिरिक्त, किसी व्यक्ति के DNA प्रोफ़ाइल (VNTR पैटर्न) को भी व्यक्तिगत पहचान के एक प्रकार के जेनेटिक बारकोड के रूप में उपयोग करने का प्रस्ताव रखा गया है।
4.2 ट्रांसजेनिक जीव
आपने ‘बीटी कॉटन’ या ‘रोज़ी, गाय’ के बारे में सुना होगा, लेकिन क्या आपने कभी सोचा है कि ये क्या हैं? क्या ये प्राकृतिक रूप से पर्यावरण में पाए जाते हैं? यदि नहीं, तो इन्हें कैसे बनाया गया है? या इन्हें बनाया ही क्यों गया है? उपरोक्त दोनों उदाहरण क्रमशः एक ट्रांसजेनिक पौधे और जानवर हैं। इन्हें ट्रांसजेनेसिस की प्रक्रिया के माध्यम से नए जीन खंडों को पेश करके उत्पादित किया गया है और ये प्राकृतिक रूप से पर्यावरण में नहीं पाए जाते हैं। इन्हें मानव जाति के लाभ के लिए बनाया गया है।
किसी जीव के जीनोम में विदेशी जीन (ट्रांसजीन) को सम्मिलित करने और उसके वंशजों में इसके संचरण और अभिव्यक्ति की प्रक्रिया को ट्रांसजेनेसिस कहा जाता है। ट्रांसजीन वहन करने वाले जीवों को ट्रांसजेनिक जीव या आनुवंशिक रूप से संशोधित जीव (जीएमओ) कहा जाता है।
4.2.1 ऐतिहासिक पृष्ठभूमि
पहला आनुवंशिक रूप से संशोधित जीव एक जीवाणु था जिसे हर्बर्ट बॉयर और स्टैनली कोहेन ने 1973 में बनाया था। अगले वर्ष, इसके बाद रुडोल्फ जेनिश और बीट्रिस मिंट्ज़ ने 1974 में पहले ट्रांसजेनिक जानवर (ट्रांसजेनिक चूहों) का इंजीनियरिंग किया। 1994 में, फ्लेवर सेवर टमाटर को पहली आनुवंशिक रूप से संशोधित (जीएम) खाद्य फसल के रूप में जारी किया गया जिसे अमेरिकी खाद्य और औषधि प्रशासन (यूएसएफडीए) द्वारा अनुमोदित किया गया था।
बॉक्स 1: जीएमओ प्रौद्योगिकी का इतिहास

‘ट्रांसजेनिक जीवों की अवधारणा में प्रगति’ के लिए समयरेखा
संदर्भ: रैंजेल, जी. (2015). From Corgis to Corn: a Brief Look at the Long History of GMO Technology. Science in the News.
4.2.2 ट्रांसजेनिक जीवों का उत्पादन
ट्रांसजेनिक पौधे
ट्रांसजेनिक या आनुवंशिक रूप से संशोधित पौधे वे पौधे होते हैं जिनके जीनोम को आनुवंशिक इंजीनियरिंग के माध्यम से संशोधित किया जाता है (किसी अन्य प्रजाति के एक या अधिक जीनों की शुरूआत करके)। आनुवंशिक रूपांतरण की मूल आवश्यकता आनुवंशिक वाहन (वेक्टर) का निर्माण है, जो रुचि के जीनों को आवश्यक नियामक अनुक्रमों, जैसे प्रमोटर या टर्मिनेटर से घिरा हुआ ले जाता है। जीन स्थानांतरण के लिए सबसे अधिक प्रयुक्त तकनीकें दो प्रकार की होती हैं।
- वेक्टर-आधारित या अप्रत्यक्ष जीन स्थानांतरण
- वेक्टर-रहित या प्रत्यक्ष जीन स्थानांतरण
वेक्टर-आधारित या अप्रत्यक्ष जीन स्थानांतरण
बैक्टीरिया-मध्यस्थ स्थानांतरण: Agrobacterium tumefaciens एक छड़ाकार ग्राम-ऋणात्मक मृदा-जीव है जो स्वाभाविक रूप से डीएनए को पौधे के जीनोम में स्थानांतरित करने में सक्षम है और क्राउन गॉल रोग (एक प्रकार का पौधे का ट्यूमर) उत्पन्न करता है। यह द्विबीजपत्री पौधों में रूपांतरण के लिए सबसे अधिक प्रचलित और व्यापक रूप से प्रयुक्त वेक्टर है। Agrobacterium में अपना डीएनए यादृच्छिक रूप से पौधे के जीनोम में स्थानांतरित करने की स्वाभाविक क्षमता होती है, जहाँ वह स्वयं की प्रतियाँ बना सकता है, इसलिए इसे ‘प्राकृतिक आनुवंशिक अभियंता’ भी कहा जाता है। इसमें एक बड़ा आकार का ट्यूमर-प्रेरण (Ti) प्लाज्मिड होता है। प्लाज्मिड का वह भाग जो ट्यूमर-प्रेरक जीनों को वहन करता है, T-DNA कहलाता है, जो संक्रमण के समय पौधे के जीनोम में स्थानांतरित हो जाता है। ये जीन फाइटोहार्मोन—जैसे ऑक्सिन और साइटोकाइन—कोडित करते हैं जो मेजबान पौधे की कोशिका में तेज कोशिका विभाजन प्रेरित करते हैं और क्राउन गॉल नामक ट्यूमर बनाते हैं। A. tumefaciens की T-DNA स्थानांतरित करने की इसी प्राकृतिक क्षमता का उपयोग करके रुचि के जीनों को पौधों में स्थानांतरित कर ट्रांसजेनिक पौधे उत्पन्न किए जाते हैं। T-DNA के ट्यूमर-प्रेरक जीनों को रुचि के जीनों—जैसे कीट-प्रतिरोधी Bt जीन—से प्रतिस्थापित कर दिया जाता है। ट्यूमर-प्रेरक जीनों से रहित Ti प्लाज्मिड को निष्क्रिय प्लाज्मिड कहा जाता है और इस प्रक्रिया को निष्क्रियीकरण (disarming) कहते हैं। रुचि के जीनों के साथ-साथ एंटीबायोटिक मार्कर जीन भी प्रस्तुत किए जा सकते हैं ताकि रूपांतरित और अन-रूपांतरित कोशिकाओं में भेद किया जा सके। संशोधित T-DNA (पुनःसंयोजी निष्क्रिय T-DNA) युक्त वेक्टरों को Agrobacterium कोशिकाओं में स्थानांतरित किया जाता है, जिन्हें आगे पौधा-रूपांतरण के लिए प्रयुक्त किया जाता है। पत्ती के टुकड़ों को पुनःसंयोजी निष्क्रिय Ti-प्लाज्मिड वाले A. tumefaciens के साथ इनक्यूबेट किया जाता है। Agrobacterium संक्रमण T-DNA को पौधे की कोशिकाओं में स्थानांतरित करता है और लक्ष्य जीन को वहन करने वाला T-DNA पौधे के केंद्रक डीएनए में समाकलित हो जाता है। इन्हें पुनः उत्पत्ति माध्यम पर संवर्धित किया जाता है जिसमें बैक्टीरियोस्टेटिक एजेंट होता है जो Agrobacterium की आगे की वृद्धि रोकता है और मार्कर एंटीबायोटिक की घातक सांद्रता होती है जो अन-रूपांतरित पौधे की कोशिकाओं को चयनपूर्वक समाप्त करती है। कुछ सप्ताहों में रूपांतरित ऊतक कलिकाएँ बनाते हैं जिन्हें जड़ निर्माण माध्यम पर स्थानांतरित किया जाता है, जहाँ रूपांतरित कलिकाएँ दो-तीन सप्ताह में जड़ें बना लेती हैं। पौधों को फिर मिट्टी में स्थानांतरित किया जाता है; और पीसीआर जैसी आणविक तकनीकों का उपयोग इन पौधों के जीनोम में रुचि के जीनों के समाकलन की पुष्टि के लिए किया जाता है। Agrobacterium-मध्यस्थ पौधा-रूपांतरण की एक आरेखीय प्रस्तुति चित्र 4.4 में दी गई है।
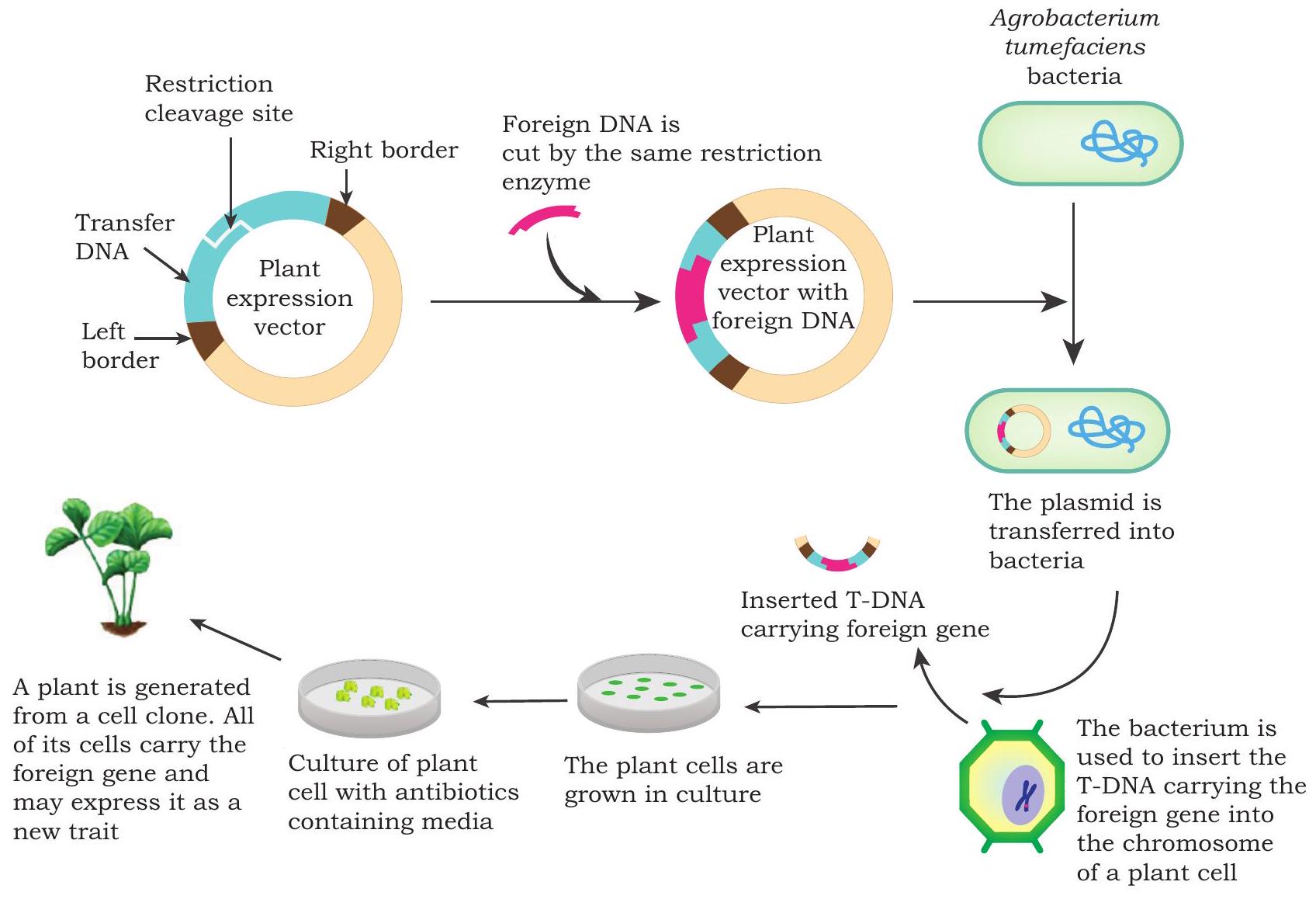
चित्र 4.4: Agrobacterium द्वारा पौधे के रूपांतरण के लिए चरणबद्ध प्रक्रिया
- पूर्ण पौधे के भाग, जैसे कि रूपांतरण के लिए पत्ती के टुकड़ों या अलग किए गए पौधे की कोशिकाओं के बजाय फूल। फूलों को कुछ मिनटों के लिए Agrobacterium घोल में डुबोया जाता है और फिर पौधों को स्वाभाविक रूप से परिपक्व होने दिया जाता है। इन पौधों से प्राप्त बीजों को एंटीबायोटिक्स की उपस्थिति में अंकुरित किया जाता है और ट्रांसजेनिक पौधों का चयन किया जाता है। यह एक समय बचाने वाला दृष्टिकोण है क्योंकि यह पिछले अनुभाग में वर्णित ऊतक संवर्धन चरण को छोड़ देता है।
- पौधे के वायरस-माध्यमित हस्तांतरण: पौधे के वायरस, जैसे कि caulimoviruses, पूर्ण पौधे की कोशिकाओं में प्रवेश करने और अपना डीएनए पौधे के डीएनए में पेश करने की क्षमता रखते हैं। पौधे के वायरसों का उपयोग रुचि के जीन को पौधे की कोशिकाओं में स्थानांतरित करने की एक अन्य विधि का गठन करता है। हालांकि, यह Agrobacterium की तुलना में पौधे के रूपांतरण की एक सामान्य विधि नहीं है।
B. वेक्टर-रहित या प्रत्यक्ष जीन हस्तांतरण
पौधे की कोशिकाओं में डीएनए की प्रत्यक्ष प्रविष्टि में सहायता के लिए कई भौतिक या यांत्रिक विधियों का विकास किया गया है।
- कण बमबारी जीन स्थानांतरण: यह एक लोकप्रिय प्रत्यक्ष जीन स्थानांतरण विधि है और यह एकलबीजपत्री तथा द्विबीजपत्री दोनों प्रकार के पौधों में विदेशी डीएनए पहुँचाने में सक्षम है। इसे बायोलिस्टिक्स भी कहा जाता है। रुचि के जीनों और प्रतिजैविक प्रतिरोध चिह्नक जीन को लेकर डीएनए को सोने या टंगस्टन कणों ($1 \mu \mathrm{m}-3 \mu \mathrm{m}$ आकार के) की सतह पर लेपित किया जाता है। इन कणों को उच्च वेग से त्वरित कर एक शक्तिशाली बंदूक—जिसे कण बंदूक या जीन बंदूक कहा जाता है—द्वारा लक्ष्य ऊतक या कोशिकाओं पर बमबारी की जाती है। बमबारी किए गए ऊतकों को तत्पश्चात उपयुक्त प्रतिजैविक युक्त पोषक माध्यम पर संवर्धित किया जाता है। रूपांतरित कोशिकाएँ कैलस बनाती हैं और फिर पुनः उत्पन्न होकर उत्कृष्ट जीनयुक्त पौधे तैयार होते हैं। यह विधि उन पौधों की प्रजातियों के लिए अत्यंत उपयोगी है जहाँ एग्रोबैक्टीरियम-आधारित रूपांतरण अधिक सफल नहीं हो पाता, उदाहरणस्वरूप अनाज।
कण बमबारी तकनीक का उपयोग क्लोरोप्लास्ट के रूपांतरण के लिए भी किया जाता है, जिसमें पौधे की कोशिकाओं को इस प्रकार बमबारी करनी होती है कि ट्रांसजीन क्लोरोप्लास्ट जीनोम में समाकलित हो जाए। चूँकि एक पौधे की कोशिका में अनेक क्लोरोप्लास्ट होते हैं, यह विधि ट्रांसजीन अभिव्यक्ति को कई गुना अधिक स्तर पर पहुँचाने की अनुमति देती है।
- प्रोटोप्लास्ट ट्रांसफॉर्मेशन और इलेक्ट्रोपोरेशन: प्रोटोप्लास्ट्स गोलाकार नग्न पादप कोशिकाएँ होती हैं, जो कोशिका भित्ति को हटाने से उत्पन्न होती हैं। ये नग्न कोशिकाएँ अपने आस-पास से डीएनए को ग्रहण करने में सक्षम होती हैं, जो ट्रांसफ़ेक्टेड कोशिकाओं के जीनोम में समाकलित हो जाता है। जीन स्थानांतरण प्रक्रिया को पॉलीएथिलीन ग्लाइकोल (PEG) और डेक्सट्रान सल्फेट के प्रयोग से तेज किया जा सकता है। वैकल्पिक रूप से, प्रोटोप्लास्ट में जीन स्थानांतरण के लिए विद्युत धारा का भी उपयोग किया जा सकता है और इस विधि को इलेक्ट्रोपोरेशन कहा जाता है। ट्रांसफ़ेक्टेड प्रोटोप्लास्ट्स को कोशिका भित्ति पुनः उत्पन्न करने की अनुमति दी जाती है और फिर कोशिका विभाजन प्रारंभ होता है। रूपांतरित कोशिकाओं का चयन चयनात्मक पोषक माध्यम पर किया जाता है और ट्रांसजेनिक पादप पुनः उत्पन्न किए जाते हैं।
ट्रांसजेनिक जानवर
ट्रांसजेनिक जानवरों में, विभिन्न आनुवंशिक इंजीनियरिंग तकनीकों के उपयोग से आनुवंशिक संरचना को बदल दिया गया है (चित्र 4.5)। ट्रांसजेनिक जानवरों के विकास के लिए सबसे अधिक प्रयोग की जाने वाली तकनीकें हैं:
1. डीएनए प्रोन्यूक्लियर सूक्ष्म इंजेक्शन
2. भ्रूणीय स्टेम सेल-मध्यस्थित जीन स्थानांतरण
3. रेट्रोवायरस-मध्यस्थित जीन स्थानांतरण
1. डीएनए प्रोन्यूक्लियर सूक्ष्म इंजेक्शन
यह ट्रांसजेनिक माउस बनाने के लिए प्रयुक्त प्रारंभिक रणनीतियों में से एक है। निषेचन के ठीक बाद, अंडे में एक छोटा स्त्री प्रोन्यूक्लियस और एक बड़ा पुरुष प्रोन्यूक्लियस होता है। प्रोन्यूक्लियर सूक्ष्मइंजेक्शन तकनीक में, ट्रांसजीन को सीधे बड़े पुरुष प्रोन्यूक्लियस में इंजेक्ट किया जाता है। इंजेक्ट किए गए ट्रांसजीन वाले भ्रूणों को इन विट्रो में संवर्धित किया जाता है और फिर उन्हें फोस्टर माताओं के गर्भाशय में प्रत्यारोपित किया जाता है। ट्रांसजीन जाइगोट के डीएनए में समाकलित हो सकता है, जिससे ट्रांसजेनिक जानवर बनते हैं।
यह तकनीक सरल और विश्वसनीय है, लेकिन सफलता की दर कम है क्योंकि ट्रांसजीन होस्ट डीएनए में समाकलित हो भी सकता है या नहीं भी। साथ ही, ट्रांसजीन के समाकलन का स्थान यादृच्छिक होता है जिससे अप्रत्याशित प्रभाव हो सकते हैं।
2. भ्रूणीय स्टेम सेल-मध्यस्थ जीन स्थानांतरण
भ्रूणीय स्टेम (ES) कोशिकाओं में शरीर की किसी भी अन्य कोशिका प्रकार सहित जर्म कोशिकाओं में विभेदित होने की क्षमता होती है। ES कोशिकाओं को ब्लास्टोसिस्ट स्तर के आंतरिक कोशिका द्रव्य क्षेत्र से एकत्र किया जाता है। इन ES कोशिकाओं को फिर ट्रांसजीन वाले पुनःसंयोजी डीएनए के साथ मिलाया जाता है, ताकि कुछ ES कोशिकाएं ट्रांसजीन को ग्रहण करके रूपांतरित हो जाएं। इन रूपांतरित ES कोशिकाओं को फिर इंजेक्शन के माध्यम से ब्लास्टोसिस्ट के आंतरिक कोशिका द्रव्य में वापस स्थानांतरित किया जाता है। ब्लास्टोसिस्ट को एक फोस्टर माता के गर्भाशय में प्रत्यारोपित किया जाता है। फिर संतानों में ट्रांसजीन की अभिव्यक्ति की निगरानी की जाती है।

चित्र 4.5: ट्रांसजेनिक जानवरों के उत्पादन के लिए चरणबद्ध प्रक्रिया
बॉक्स 1: काइमेरिक माउस
काइमेरा ऐसे जीव होते हैं जो कम से कम दो आनुवंशिक रूप से भिन्न कोशिका वंशों से बने होते हैं जो विभिन्न जाइगोट्स से उत्पन्न हुई हैं। एक काइमेरिक माउस में सामान्य कोशिकाएं और आनुवंशिक रूप से हेरफेर की गई ‘नॉकआउट’ कोशिकाएं दोनों होती हैं। कोट का रंग इसे धब्बेदार पैटर्न के साथ दर्शा सकता है। यह सामान्य कोशिका और आनुवंशिक रूप से हेरफेर की गई ‘नॉकआउट’ कोशिका का एक पैचवर्क है। माउस की भ्रूणीय काइमेरा महत्वपूर्ण विकासात्मक प्रक्रियाओं की जांच करने के लिए एक उपकरण बन गई है, जिनमें कोशिका विनिर्देशण, विभेदन, कोशिका वंश, संभावित पैटर्निंग और विशिष्ट जीनों की कार्यप्रणाली शामिल हैं। इसके अतिरिक्त, काइमेरा को वयस्क जीवों में जैविक प्रक्रियाओं को संबोधित करने के लिए भी उत्पन्न किया जा सकता है, जिनमें रोगों या ऊतक मरम्मत और पुनर्जनन के तंत्र शामिल हैं।
पौधों के ट्रांसजेनिक्स का एक प्रमुख लक्ष्य फसलों की पैदावार बढ़ाना और साथ ही फसल उत्पादों की पोषण संबंधी गुणवत्ता में सुधार करना है ताकि लगातार बढ़ती मानव आबादी की जरूरतों को पूरा किया जा सके। रोगजनकों—जैसे बैक्टीरिया, फंगस, वायरस या कीटों—के कारण होने वाली जैविक तनाव और सूखा, लवणता, चरम तापमान जैसी अजैविक तनाव स्थितियाँ फसल उत्पादकता को पैदावार के मामले में भारी नुकसान पहुँचाती हैं। स्थिर जीव होने के नाते पौधे दोनों जैविक और अजैविक तनावों का सामना करते हैं। जैवप्रौद्योगिकी रणनीतियों का उपयोग नए और प्रभावी किस्मों को तैयार करने के लिए प्रभावी रूप से किया गया है जो रोगजनकों के प्रति अधिक प्रतिरोधी हैं या कठोर पर्यावरणीय परिस्थितियों में बेहतर प्रदर्शन करती हैं। अजैविक तनाव प्रतिक्रिया में तनाव संबंधी ओस्मोलाइट्स—जैसे शर्करा (उदाहरणार्थ, ट्रैहेलोज और फ्रुक्टान), अमीनो अम्ल (उदाहरणार्थ, बीटाइन, प्रोलाइन)—का उत्पादन होता है और कुछ विशिष्ट प्रोटीन ऐसे बनाए गए हैं जो उपरोक्त में से किसी एक यौगिक को अधिक अभिव्यक्त करते हैं। ये पर्यावरणीय तनावों के प्रति बेहतर सहनशीलता दिखाते हैं। कीटों के प्रति प्रतिरोध प्रदान करने वाले पौधे का एक सामान्य उदाहरण Bt कपास है। इस कीट-प्रतिरोधी ट्रांसजेनिक फसल को बैसिलस थुरिंजिएंसिस नामक जीवाणु से Bt जीन (जिसे cry जीन भी कहा जाता है) स्थानांतरित कर कपास के पौधे में अभिव्यक्त करके विकसित किया गया है। Bt जीन एक विष (Bt toxin) को कूटबद्ध करता है जो स्वाभाविक रूप से B. thuringiensis द्वारा कीटों को मारने वाले प्रोटीन के रूप में उत्पन्न किया जाता है। cry जीनों की कई श्रेणियाँ हैं और प्रत्येक श्रेणी के उत्पाद केवल विशिष्ट समूह के कीटों के लिए हानिकारक होते हैं और तितलियों व रेशमकीड़ों जैसे अन्य उपयोगी कीटों को प्रभावित नहीं करते। उदाहरण के लिए, cryIAc और cryIIAb कपास के बोलवर्म को नियंत्रित करने वाले विष के लिए कोड करते हैं जबकि cryIAb मकई के बोरर को नियंत्रित करने वाले विष के लिए कोड करता है। कुछ अन्य फसलें जिनके लिए Bt जीनों को पेश कर ट्रांसजेनिक पौधे विकसित किए गए हैं, वे हैं बैंगन, मक्का, चावल, टमाटर आदि। इन सभी ट्रांसजेनिक फसलों को कीटों के प्रभावी नियंत्रण में सिद्ध किया गया है। इनमें से कई ट्रांसजेनिक फसलें वर्तमान में व्यावसायिक रूप से उगाई जाती हैं और कुल पैदावार में उल्लेखनीय वृद्धि हुई है। भारत में सबसे उल्लेखनीय उदाहरण Bt कपास है (जो कीट पीड़क गुलाबी बोलवर्म के प्रति प्रतिरोध प्रदान करता है) जिसे 2002 से व्यावसायिक रूप से उगाया जा रहा है।
इसी प्रकार, अन्य कई लक्षणों के लिए भी ट्रांसजेनिक फसलें तैयार की गई हैं, जिससे फसल उत्पादकता में उल्लेखनीय वृद्धि होती है। इन लक्षणों में शामिल हैं: हर्बिसाइड सहिष्णुता; जीवाणुओं, कीटों, वायरसों या निमेटोडों के प्रति प्रतिरोध; पर्यावरणीय तनावों की सहिष्णुता; पोषक तत्वों की गुणवत्ता और फलों की पकने की प्रक्रिया में देरी आदि।
फसल उत्पादन बढ़ाने की रणनीतियों में पौधे की प्रकाश-संश्लेषण मशीनरी को संशोधित करना, एंजाइम गतिविधि में हेरफेर करना और शर्करा को स्टार्च में बदलने की दर बढ़ाना, पोषण गुणवत्ता में सुधार करना शामिल है; उदाहरण के लिए, पौधों में विटामिन जैसे विटामिन A की अभिव्यक्ति बढ़ाना, जैसे गोल्डन राइस। कई लक्षणों को पहले ही वाणिज्यिक रूप से उपयोग में लाया गया है और कई अन्य लक्षणों को खेत की परिस्थितियों में उनके प्रदर्शन के लिए परखा जा रहा है।
बॉक्स 2: कुछ ट्रांसजेनिक फसलों और उनके इंजीनियर्ड लक्षणों की सूची
फसल सम्मिलित लक्षण का स्रोत लक्षण मक्का बैक्टीरिया, अन्य
मक्का की प्रजातियाँकीटों के प्रति प्रतिरोध
हर्बिसाइड सहिष्णुता
नर मक्का बंजरता
अल्फा-एमिलेज अभिव्यक्ति
पशु आहार में उपयोग के लिए लाइसिन स्तर में वृद्धि
जल-सीमित परिस्थितियों के तहत
उत्पादन-हानि में कमीकपास बैक्टीरिया हर्बिसाइड सहिष्णुता
कीटों के प्रति प्रतिरोधसोयाबीन बैक्टीरिया, मक्का, जई, अन्य
सोयाबीन की प्रजातियाँ
सरसों की सब्जियाँहर्बिसाइड सहिष्णुता
उच्च ओलिक एसिड सोयाबीन तेल
कीटों के प्रति प्रतिरोध
कीटों के प्रति प्रतिरोधकैनोला बैक्टीरिया
कवकहर्बिसाइड सहिष्णुता
प्रजनन क्षमता पुनर्स्थापना
नर कैनोला बंजरता
पशु आहार में फाइटेट का विघटनआलू बैक्टीरिया
आलू वायरस
आलू की अन्य प्रजातियाँकीटों के प्रति प्रतिरोध
आलू की चीनी के प्रति प्रतिरोध
कम स्तर की रिड्यूसिंग शर्करा
मुक्त एस्पैराजिन का कम स्तर
काले धब्बे वाली चोट में कमीटमाटर बैक्टीरिया, आलू
बैक्टीरियादेरी से नरम होना
कीटों के प्रति प्रतिरोधरेडिकियो बैक्टीरिया हर्बिसाइड सहिष्णुता
नर रेडिकियो बंजरताअल्फाल्फा बैक्टीरिया हर्बिसाइड सहिष्णुता चुकंदर बैक्टीरिया हर्बिसाइड सहिष्णुता चावल बैक्टीरिया हर्बिसाइड सहिष्णुता सेब सेब की अन्य प्रजातियाँ भूरापन और चोट में कमी खरबूजा बैक्टीरिया पकने में देरी स्क्वैश वायरस वायरस के प्रति प्रतिरोध पपीता वायरस वायरस के प्रति प्रतिरोध अलसी सरसों की सब्जी हर्बिसाइड सहिष्णुता आलूबुखारा वायरस वायरस के प्रति प्रतिरोध क्रीपिंग
बेंटग्रासबैक्टीरिया हर्बिसाइड सहिष्णुता
एंटीसेंस प्रौद्योगिकी
एंटीसेंस प्रौद्योगिकी का उपयोग जीन अभिव्यक्ति को रोकने/शांत करने के लिए किया जाता है। इस तकनीक में, किसी विशिष्ट जीन की अभिव्यक्ति को रोकने के लिए उसके mRNA के अनुवाद को रोका जाता है। इसके दो तरीके हैं, पहला तरीका एंटीसेंस ओलिगोन्यूक्लियोटाइड (ASO) तकनीक के रूप में जाना जाता है। इस तकनीक में, एक संश्लिष्ट ओलिगोन्यूक्लियोटाइड (एक छोटा RNA या DNA अणु) जो लक्ष्य जीन के mRNA के पूरक होता है, को कोशिका में प्रवेश कराया जाता है। एंटीसेंस ओलिगोन्यूक्लियोटाइड (ASO) लक्ष्य जीन के mRNA के साथ पूरक आधार युग्मन बनाता है और इस प्रकार, उसके अनुवाद को रोकता है। ASO अपना प्रभाव दो तरह से पैदा कर सकता है: या तो ASO के लक्ष्य mRNA से बंधने के बाद RNase $\mathrm{H}$ द्वारा नियंत्रित अपघटन द्वारा या उसके राइबोसोम से बंधने में बाधा डालकर अनुवाद को रोककर। दूसरा तरीका RNA हस्तक्षेप (RNAi) तकनीक के रूप में जाना जाता है। इस तकनीक में, लक्ष्य जीन की अभिव्यक्ति को RNA प्रेरित शांत करने वाला संकुल (RISC) द्वारा उसके mRNA को निष्क्रिय करके रोका जाता है। बाह्य (वायरल मूल) या आंतरिक मूल (कोशिकीय मूल) की द्वि-श्रृंखला RNA को साइटोप्लाज्म में DICER नामक एंडोराइबोन्यूक्लिएस द्वारा छोटे टुकड़ों में काटा जाता है। छोटे द्वि-श्रृंखला टुकड़ों को एक बहु-प्रोटीन संकुल RISC द्वारा गाइड स्ट्रैंड और पैसेंजर स्ट्रैंड में अलग किया जाता है।
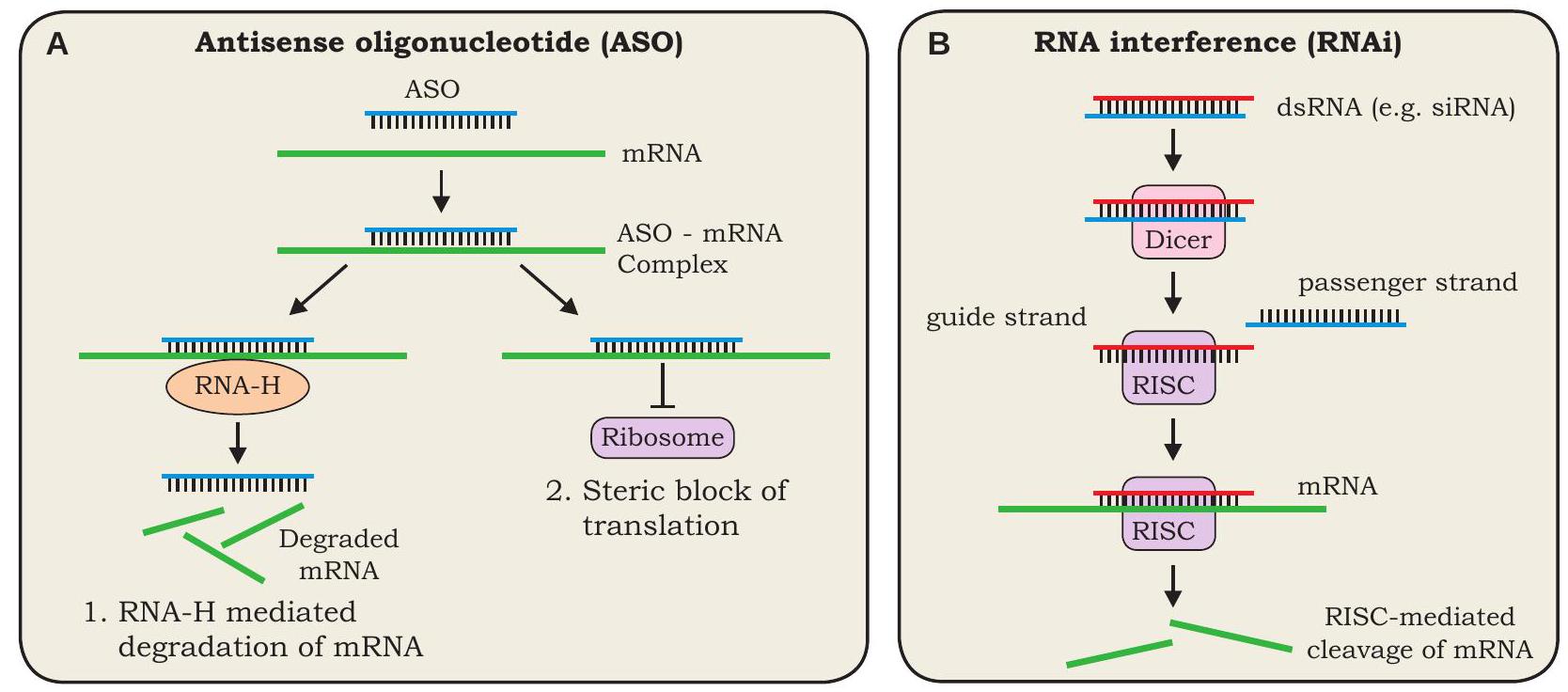
आकृति 4.6: (A) प्रतिसंवेदी ओलिगोन्यूक्लियोटाइड द्वारा जीन शांतिकरण की क्रियाविधि, (B) RNA हस्तक्षेप (RNAi) की क्रियाविधि।
पैसेंजर स्ट्रैंड नष्ट हो जाता है जबकि गाइड स्ट्रैंड RISC से जुड़कर लक्ष्य mRNA से बांधता है और उसे काट देता है, जिससे लक्ष्य जीन शांत हो जाता है।
एग्रोबैक्टीरियम-माध्यमित रूपांतरण और प्रतिसंवेदी प्रौद्योगिकी के संयोजन का उपयोग कर कीट-प्रतिरोधी पौधे बनाए गए हैं। एक उदाहरण तंबाकू का पौधा है, जो निमेटोड Meloidogyne incognita से संक्रमित होता है। निमेटोड-विशिष्ट जीनों को एग्रोबैक्टीरियम को वेक्टर बनाकर पौधे में पेश किया गया। जब ये जीन ट्रांस्क्राइब होते हैं, तो प्रतिसंवेदी RNA बनता है। प्रतिसंवेदी RNA निमेटोड के संवेदी RNA से पूरक होने के कारण उससे बांध जाता है और इस प्रकार निमेटोड के जीवन के लिए आवश्यक प्रोटीनों के अनुवाद को रोकता है। इससे ट्रांसजेनिक पौधे निमेटोडों के परजीवी आक्रमण के प्रति प्रतिरोधी हो जाते हैं।
औद्योगिक उत्पादन के लिए
पौधे पृथ्वी पर सभी जीवन रूपों की रीढ़ हैं क्योंकि वे सूर्य की ऊर्जा को रासायनिक ऊर्जा में परिवर्तित करते हैं जो दुनिया को पोषण देती है। आज हजारों पौधे भोजन, चारा और तीव्र तथा दीर्घकालिक स्वास्थ्य समस्याओं के उपचार के लिए दवाओं के रूप में उपयोग किए जा रहे हैं। पौधों की आनुवंशिकी और जैवप्रौद्योगिकीय उपकरणों की हमारी समझ में हुई प्रगति ने अपेक्षाकृत नई जैवविज्ञान शाखा ‘आणविक खेती’ के विकास को जन्म दिया है। इसमें मेज़बान पौधे में उद्देश्यपूर्ण रूप से एक जीन या जीनों के समूह को जोड़कर आनुवंशिक संशोधन किया जाता है जिससे नई वांछित जैवअणुओं का उत्पादन होता है। विदेशी जीनों को या तो केन्द्रक जीनोम में या क्लोरोप्लास्ट जीनोम में सम्मिलित किया जा सकता है। चूँकि क्लोरोप्लास्ट में जीनोम की कई प्रतियाँ होती हैं, इसलिए रुचि के जीन को क्लोरोप्लास्ट में सम्मिलित करने से लक्ष्य जैवअणुओं की उच्च संचयन होती है। इस प्रकार, पौधों में बड़ी संख्या में उत्पाद उत्पन्न किए गए हैं जिनमें टीके के प्रतिजन, चिकित्सीय प्रोटीन, निदानात्मक अभिकर्मक, पोषण उत्पाद, जैवप्लास्टिक या औद्योगिक एंजाइम आदि शामिल हैं। 2012 में, यू.एस. एफ.डी.ए. ने पहले पौधे-निर्मित मानव जैविक ‘एलेलिसो’ को मंजूरी दी। यह एक एंजाइम है जिसका उपयोग गॉशर रोग के उपचार के लिए किया जाता है और इसे गाजर कोशिका संवर्धन में उत्पादित किया गया है। तालिका 4.2 कुछ चिकित्सीय अणुओं के उदाहरणों की सूची देती है जिन्हें आनुवंशिक इंजीनियरिंग के माध्यम से पौधों में उत्पादित किया गया है।
तालिका 4.2: आनुवंशिक इंजीनियरिंग के माध्यम से पौधों में उत्पादित औद्योगिक या चिकित्सीय उत्पादों की सूची।
| ट्रांसजेनिक पौधा | औद्योगिक/चिकित्सीय उत्पाद | रोग/अन्य उपयोग |
|---|---|---|
| लेट्यूस | हेपेटाइटिस B एंटीजन | हेपेटाइटिस B |
| तम्बाकू | कैंसर वैक्सीन | नॉन-हॉजकिन लिंफोमा |
| गाजर | मानव ग्लूकोसेरेब्रोसाइडेस | गॉशर रोग |
| सफलॉवर | इंसुलिन | मधुमेह |
| चावल | मानव लाइसोजाइम | संक्रमण-रोधी, सूजन-रोधी |
पर्यावरणीय लाभों के लिए
- जैव-विघटनीय प्लास्टिक: जैसा कि आप जानते हैं, प्लास्टिक गैर-जैव-विघटनीय होते हैं और पर्यावरण के लिए एक समस्या हैं। ट्रांसजेनिक पौधों का उपयोग करके बायोपॉलिमर उत्पादित किए जा सकते हैं जो प्लास्टिक की जगह ले सकते हैं। पॉलीहाइड्रॉक्सीएल्केनोएट्स (PHAs) प्रदूषण-रहित और जैव-विघटनीय प्लास्टिक का एक आकर्षक स्रोत हैं। ट्रांसजेनिक पौधों का उपयोग करके PHAs का उत्पादन एक आर्थिक रूप से व्यवहार्य विकल्प प्रदान करता है। एक उदाहरण ट्रांसजेनिक गन्ने में जीवाणु पॉलिएस्टर पॉलीहाइड्रॉक्सीब्यूटिरेट (PHB) का उत्पादन है।
- फाइटोरिमीडिएशन: फाइटोरिमीडिएशन का अर्थ है पर्यावरण, विशेष रूप से मिट्टी से प्रदूषकों को हटाने के लिए पौधों का उपयोग। जीवाणुओं और अन्य जीवों से धातु-विषहरण जीनों को पौधों में पेश किया जाता है, और ट्रांसजेनिक पौधे तब विषाक्त तत्वों को कम विषाक्त रूपों में परिवर्तित कर लेते हैं।
पारा एक खतरनाक भारी धातु है, जो मुख्य रूप से जलीय पारिस्थितिक तंत्रों में पाई जाती है। ट्रांसजेनिक पौधों को मरक्यूरिक रिडक्टेस जीन को समाहित करने के लिए डिज़ाइन किया गया है, जो हानिकारक पारे को कम विषाक्त रूपों में डिटॉक्सीफाई करने में मदद करता है। ऐसे ट्रांसजेनिक पौधे ‘पारा-सांस लेने वाले पौधों’ के रूप में कार्य करते हैं और पर्यावरणीय उपचार के लिए उपयोग किए जा सकते हैं।
ट्रांसजेनिक जानवरों के अनुप्रयोग
औद्योगिक उत्पादन के लिए
ट्रांसजेनिक जानवरों का उपयोग बायोरिएक्टर के रूप में किया जाता है ताकि सामान्य और पुनः संयोजन प्रोटीन उत्पादों को बड़ी मात्रा में उत्पादित किया जा सके (मॉलिक्यूलर फार्मिंग)। 1990 के दशक की एक प्रारंभिक सफलता का उदाहरण ट्रांसजेनिक भेड़, ट्रेसी थी, जिसने अपने दूध में मानव प्रोटीन a1-एंटीट्रिप्सिन उच्च स्तर पर उत्पादित किया। मनुष्यों में a1-एंटीट्रिप्सिन की कमी से फेफड़ों की बीमारियां होती हैं। ट्रेसी के दूध में उत्पादित प्रोटीन को इस कमी के लक्षणों को ठीक करने के लिए माना गया था, लेकिन इस पुनः संयोजन प्रोटीन के लिए किए गए नैदानिक परीक्षणों में रोगियों में दुष्प्रभाव प्रकट हुए।
1997 में, पहली ट्रांसजेनिक गाय, रोज़ी बनाई गई थी जो मानव a-लैक्टल्ब्यूमिन-समृद्ध दूध उत्पादित कर सकती थी। मानव a-लैक्टल्ब्यूमिन-समृद्ध दूध को प्राकृतिक गाय के दूध की तुलना में मानव शिशुओं के लिए अधिक संतुलित उत्पाद पाया गया। तालिका 4.3 कुछ मानव पुनः संयोजन प्रोटीनों के उदाहरणों की सूची देती है जिन्हें आनुवंशिक इंजीनियरिंग के माध्यम से ट्रांसजेनिक जानवरों में उत्पादित किया गया है।
तालिका 4.3: आनुवंशिक इंजीनियरिंग के माध्यम से ट्रांसजेनिक जानवरों के दूध में उत्पादित मानव पुनःसंयोजित प्रोटीनों की सूची
नाम ट्रांसजेनिक जानवर एल्ब्यूमिन गाय अल्फा-फीटोप्रोटीन बकरी वृद्धि हार्मोन बकरी ऊतक प्लाज्मिनोजन सक्रियक बकरी जमाव कारक IX चूहा जमाव कारक VIII खरगोश
अनुसंधान के लिए
वैज्ञानिक ट्रांसजेनिक जानवरों का उपयोग मॉडल जीव के रूप में सामान्य मानव शरीर क्रिया, विकास और रोगों का अध्ययन करने के लिए करते हैं।
ट्रांसजेनिक जानवरों को आनुवंशिक रूप से इस प्रकार हेरा जाता है कि वे कैंसर, अल्जाइमर आदि रोगों के लक्षण विकसित करें। यह शोधकर्ताओं को विभिन्न रोगों में शामिल जीनों के कार्य को समझने में भी मदद करता है।
ट्रांसजेनिक जानवरों का उपयोग टीकों, दवाओं और रसायनों की मानवों पर प्रयोग से पहले विषाक्तता परीक्षण के लिए भी किया जाता है।
4.2.4 जीएमओ को लेकर चिंता
जीएमओ को लेकर प्रमुख चिंता मानव स्वास्थ्य और पर्यावरण के प्रति संभावित जोखिम है। ट्रांसजेनिक फसलें ऐसे प्रोटीन उत्पन्न कर सकती हैं जो मनुष्यों में एलर्जी का कारण बन सकते हैं। जीएमओ में वायरल वेक्टरों और प्रमोटरों के उपयोग को लेकर चिंता उत्पन्न होती है, क्योंकि ये मनुष्यों में वायरल संक्रमण का कारण बन सकते हैं। जीएमओ में सुधारित विशेषताएं उन्हें देशी या जंगली प्रजातियों के लिए आक्रामक बना सकती हैं। ट्रांसजीन का अस्थिर समावेशन अप्रत्याशित या गैर-लक्षित प्रभावों का कारण बन सकता है।
पारगत जंतुओं के उपयोग से जुड़े नैतिक मुद्दों के लिए, भारत ने जीएमओ के उत्पादन और उपयोग के लिए जैव-सुरक्षा नियम स्थापित किए हैं। पर्यावरण, वन और जलवायु परिवर्तन मंत्रालय ने जेनेटिक इंजीनियरिंग अप्रूवल कमेटी (GEAC) की स्थापना की है, जो जैव-प्रौद्योगिकी से संशोधित जीवों और कोशिकाओं/खतरनाक सूक्ष्मजीवों के निर्माण, उपयोग, आयात, निर्यात और भंडारण को नियंत्रित करती है और जीएमओ को लाने की वैधता और सुरक्षा पर निर्णय लेती है।
4.3 जीन थेरेपी
मनुष्यों में कई रोगों का कारण या तो सामान्य जीन की अनुपस्थिति होती है, या दोषपूर्ण और रोग-कारक जीन की उपस्थिति होती है। क्या ऐसे विकारों को सुधारा जा सकता है? उत्तर उस दृष्टिकोण में निहित है
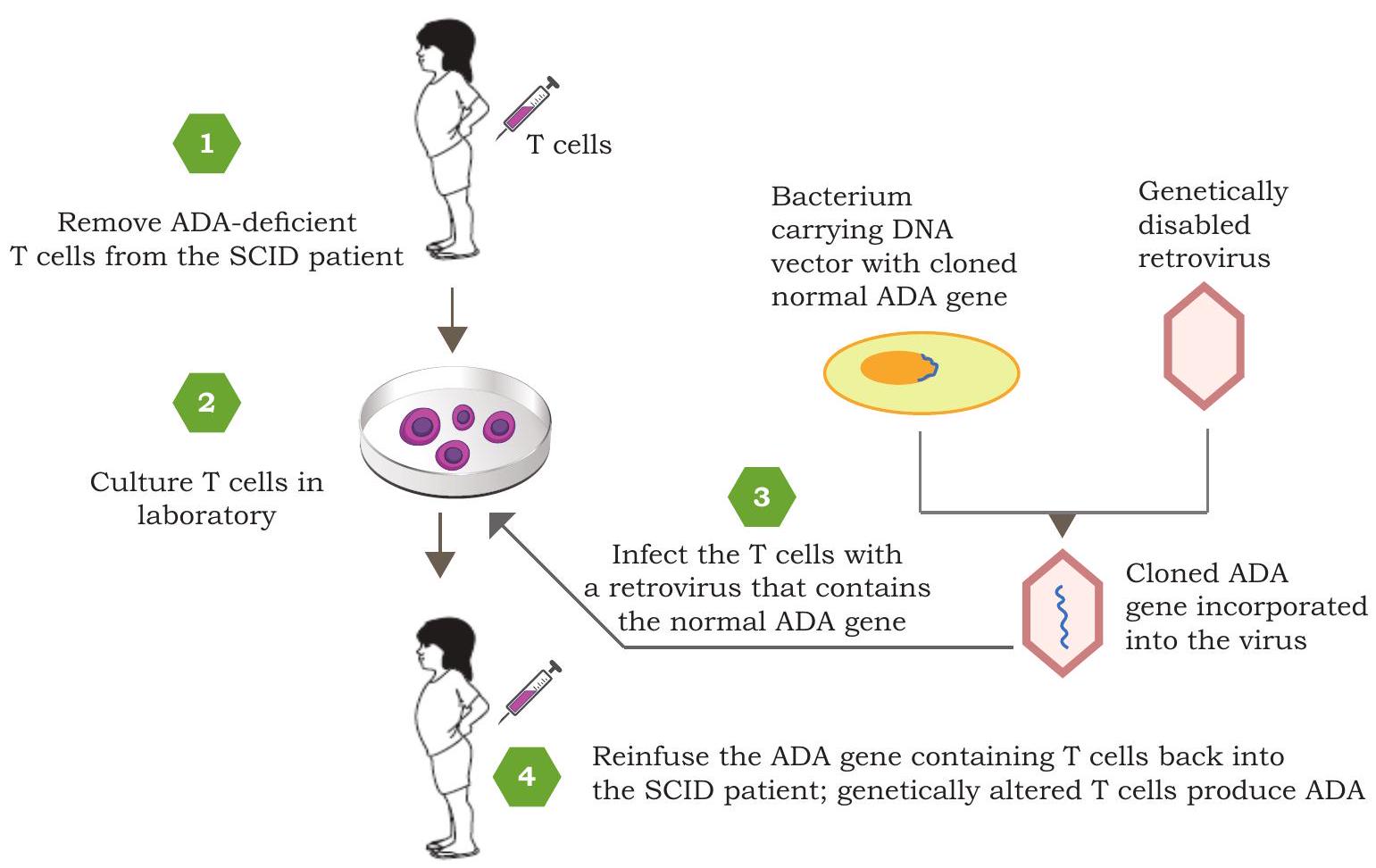
चित्र 4.7: SCID के लिए जीन थेरेपी में शामिल चरण, जिसमें एक कार्यात्मक एडेनोसीन डिएमिनेज (ADA) के प्रतिस्थापन द्वारा
‘जीन थेरेपी’ के रूप में। जीन थेरेपी एक ऐसी तकनीक है जिसे मनुष्यों में खराब जीनों की मरम्मत के लिए डिज़ाइन किया गया है ताकि कोशिकाओं के अंदर सही आनुवांशिक सामग्री पेश की जा सके। जीन थेरेपी के लिए स्पष्ट उम्मीदवार रोगों में प्रतिरक्षा विकार जिसे गंभीर संयुक्त प्रतिरक्षा अपूर्णता (SCID) कहा जाता है और विरासत में मिले आनुवांशिक विकार जैसे सिस्टिक फाइब्रोसिस, हीमोफीलिया, मस्कुलर डिस्ट्रॉफी आदि शामिल हैं। पहली जीन थेरेपी 1990 में एक चार वर्षीय बच्ची पर की गई थी जो एडेनोसीन डिएमिनेज (ADA) कोडिंग जीन में दोष के कारण SCID से पीड़ित थी। ADA की कमी के कारण पर्याप्त प्रतिरक्षा कोशिकाएं उत्पन्न करने में असमर्थता हुई जिससे बच्ची को बार-बार जानलेवा संक्रमण होने लगे। ADA जीन की एक कार्यात्मक प्रति को एक वायरल वेक्टर में डाला गया, जिसे रोगी से एकत्रित लिम्फोसाइट्स में पेश किया गया और फिर इन लिम्फोसाइट्स को रोगी की रक्तधारा में पुनः पेश किया गया (चित्र 4.7)। रोगी की प्रतिरक्षा प्रणाली के कार्य में सुधार आया लेकिन यह इलाज स्थायी नहीं था।
4.3.1 जीन थेरेपी के लिए दृष्टिकोण
जीन थेरेपी के तीन मुख्य दृष्टिकोण हैं-जीन प्रतिस्थापन या जीन जोड़ना, जीन निषेध और जीन मरम्मत या जीन संपादन थेरेपी।

चित्र 4.8: वायुमार्ग का अनुप्रस्थ काट (क) सामान्य और (ख) सिस्टिक फाइब्रोसिस में
जीन प्रतिस्थापन या जीन संवर्धन चिकित्सा में, कार्यात्मक जीन की एक प्रति को जीनोम में डाला जाता है ताकि अकार्यक्षम दोषपूर्ण जीन को प्रतिस्थापित किया जा सके। नया जीन उस प्रोटीन के संश्लेषण के लिए निर्देश ले जाता है जो दोषपूर्ण जीन के कारण कोशिका में उपलब्ध नहीं था। उदाहरण के लिए, सिस्टिक फाइब्रोसिस एक वंशानुगत रोग है जो सिस्टिक फाइब्रोसिस ट्रांसमेम्ब्रेन कंडक्टेंस रेगुलेटर (CFTR) नामक एक दोषपूर्ण झिल्ली प्रोटीन के कारण होता है। दोषपूर्ण प्रोटीन CFTR जीन में उत्परिवर्तन के कारण बनता है। दोषपूर्ण प्रोटीन के कारण शरीर की कोशिकाओं में नमक और पानी की गति बाधित हो जाती है, जिससे श्वसन और पाचन तंत्र को क्षति पहुँचती है (चित्र 4.8)। यदि उत्परिवर्तित CFTR जीन को सामान्य CFTR जीन से प्रतिस्थापित कर दिया जाए, तो रोग को ठीक किया जा सकता है। एक अन्य उदाहरण p53 जीन है जो सामान्यतः ट्यूमर वृद्धि को रोकता है। कई प्रकार के कैंसर दोषपूर्ण p53 से जुड़े हुए हैं। कैंसर कोशिकाओं में दोषपूर्ण p53 के स्थान पर सामान्य p53 डालने से कैंसर कोशिकाओं की रोकथाम या मृत्यु हो सकती है, जिससे कैंसर ठीक हो सकता है।
जीन निषेध के मामले में, एक ऐसे जीन की कार्यक्षमता निष्क्रिय कर दी जाती है जो कोशिका में रोग का कारण बनता है। इसलिए, जीन चिकित्सा की जीन निषेध विधि संक्रामक रोगों, कैंसर और उन उत्परिवर्तित जीनों पर लागू होती है जिनके उत्पाद रोग उत्पन्न करते हैं (उदाहरण के लिए, सिकल सेल एनीमिया, टे-सैक्स रोग, फेनिलकेटोनूरिया, रंग-अंधता)। जीन निषेध में, एक जीन कोशिका में प्रवेश कराया जाता है जिसका उत्पाद या तो दोषपूर्ण जीन की अभिव्यक्ति को रोकता है या दोषपूर्ण जीन के उत्पाद को निष्क्रिय कर देता है।
अंत में, जीन मरम्मत या जीन संपादन के मामले में, जीवित कोशिकाओं के जीनोम के दोषपूर्ण जीन में डीएनए सम्मिलित, विलोपित, संशोधित या प्रतिस्थापित किया जाता है। यह एक नवीनतम तकनीक CRISPR/Cas9 प्रणाली द्वारा प्राप्त किया जाता है। क्लस्टर्ड रेगुलरली इंटरस्पेस्ड शॉर्ट पैलिंड्रोमिक रिपीट्स/क्रिस्पर एसोसिएटेड प्रोटीन 9। CRISPR/Cas9 प्रणाली को बैक्टीरिया या आर्किया के उन वायरसों के खिलाफ प्राकृतिक रक्षा तंत्र से अपनाया गया है जो उन पर आक्रमण करते हैं। CRISPR प्रणाली के साथ, बैक्टीरिया आक्रमणकारी वायरस को पहचानते हैं और Cas9 एंजाइम की सहायता से वायरल डीएनए को छोटे टुकड़ों में काट देते हैं। यह तकनीक उत्परिवर्तित डीएनए को काटकर बाहर निकालने और उसकी जगह सही अनुक्रम रखने का एक आसान तरीका प्रदान करती है। यह तकनीक भविष्य में कई आनुवंशिक विकारों के उपचार की संभावना दिखाती है (अनुभाग 5.4.2, अध्याय 5 देखें)।
4.3.2 जीन चिकित्साओं के प्रकार
जीन डिलीवरी के लिए इस्तेमाल की गई रणनीति के आधार पर, जीन थेरेपी को एक्स-वीवो और इन-वीवो (चित्र 4.9) में वर्गीकृत किया जा सकता है। एक्स-वीवो (एक्स का अर्थ है ‘बाहर’ और विवो का अर्थ है ‘कुछ जीवित’) जीन थेरेपी में, रोगी से कोशिकाओं को बाहर निकाला जाता है, संस्कृति में उगाया जाता है, फिर इन कोशिकाओं में सामान्य जीन पेश किए जाते हैं, और अंत में इन रूपांतरित कोशिकाओं को रोगी में पुनः पेश किया जाता है। इसे सेल-आधारित डिलीवरी भी कहा जाता है। एक्स-वीवो दृष्टिकोण इन-वीवो दृष्टिकोण की तुलना में बहुत सरल होता है, क्योंकि कोशिकाओं को बाहर से संचालित करना आसान हो जाता है (चित्र 4.9)।
इन-वीवो जीन थेरेपी में, एक्स-वीवो दृष्टिकोण के विपरीत, सामान्य कार्यात्मक जीन सीधे रोग की स्थिति वाले व्यक्ति की लक्षित कोशिकाओं और ऊतकों में पेश किए जाते हैं। इसे प्रत्यक्ष डिलीवरी विधि भी कहा जाता है।
कार्यात्मक जीनों को पेश करने के लिए इस्तेमाल की जाने वाली लक्षित कोशिकाओं या ऊतकों की प्रकृति के आधार पर, जीन थेरेपी को: सोमैटिक और जर्म-लाइन जीन थेरेपी में वर्गीकृत किया जा सकता है। सोमैटिक जीन थेरेपी में, लक्षित जीन की कार्यात्मक प्रतियां रोगी की सोमैटिक कोशिकाओं में पेश की जाती हैं। जर्म-लाइन जीन थेरेपी में, कार्यात्मक जीन जर्म कोशिकाओं (अंडाणु या शुक्राणु) में पेश किए जाते हैं। कार्यात्मक जीन जर्म कोशिकाओं के जीनोम में समाकलित हो जाते हैं। जर्म-लाइन में किए गए परिवर्तन वंशानुगत होते हैं।

चित्र 4.9: एक्स-वीवो और इन-वीवो जीन थेरेपी
इस प्रकार, उपयोग की गई कार्यात्मक रणनीति के आधार पर, जीन थेरेपी को वर्गीकृत किया जा सकता है:
- जीन वृद्धि थेरेपी (GAT): लापता जीन उत्पाद को बदलने के उद्देश्य से कार्यात्मक जीन को जीनोम में जोड़ना।
- जीन अवरोधन थेरेपी (GIT): प्रभावी रूप से कार्य करने वाले उत्परिवर्तित जीनों की अभिव्यक्ति को रोकने के लिए प्रतिसमान RNA या अन्य अवरोधन तकनीकों का उपयोग करना।
- जीन लक्ष्यीकरण: समजात पुनर्योजन का उपयोग करके गैर-कार्यात्मक जीन को सामान्य जीन से बदलना।
उपरोक्त वर्णित तरीके से एक दोषपूर्ण जीन के कार्य को सुधारने के प्रयास तभी संभव हो सके जब rDNA प्रौद्योगिकी, जीन स्थानांतरण और जीन संपादन तंत्र में प्रगति हुई। आपने इस अध्याय में और अध्याय 3 में पहले भी लक्ष्य जीन (वांछित DNA अनुक्रम) की वितरण प्रक्रिया को या तो वायरल (प्रत्यक्ष जीन स्थानांतरण) या गैर-वायरल (अप्रत्यक्ष जीन स्थानांतरण) विधि के माध्यम से पढ़ा है।
4.3.3 जीन थेरेपी के गुण और दोष
जीन थेरेपी उन विनाशकारी आनुवंशिक रोगों के उपचार के लिए एक संभावित इलाज प्रदान करती है जिनके लिए पारंपरिक उपचार रणनीतियाँ बहुत कम आशा प्रदान करती हैं। मानव जीनोमिक्स में प्रगति ने दिखाया है कि कैंसर मानव जीनोम में सोमेटिक विसंगतियों के कारण होता है। इससे कैंसर शोधकर्ताओं में कैंसर कोशिकाओं की आनुवंशिक हेरफेर के लिए जीन थेरेपी दृष्टिकोण का उपयोग करने और रोग के संभावित इलाज को खोजने के प्रति उत्साह पैदा हुआ है।
हालांकि, चिकित्सीय जीन की अनियंत्रित अभिव्यक्ति को कुशल जीन चिकित्सा तंत्र के लिए हल करने की आवश्यकता है। साथ ही, चिकित्सीय जीन का गैर-लक्ष्य कोशिकाओं में प्रवेश या मेजबान जीनोम में गलत स्थान पर यादृच्छिक एकीकरण एक अन्य चिंता का विषय है। उदाहरण के लिए, यदि DNA किसी ट्यूमर-सप्रेसर जीन में एकीकृत हो जाता है, तो इससे ट्यूमर हो सकता है। चिकित्सीय जीन के बार-बार प्रशासन की आवश्यकता हो सकती है क्योंकि जीन चिकित्सा प्रकृति में अल्पकालिक होती है। चिकित्सीय जीन या प्रक्रिया में प्रयुक्त वायरल वेक्टर को मेजबान द्वारा अस्वीकृति मेजबान की प्रतिरक्षा प्रणाली को उत्तेजित कर सकती है। एक महंगी प्रक्रिया होने के अलावा, जीन चिकित्सा एकल-जीन दोषों के लिए प्रभावी है लेकिन बहु-जीन विकारों के लिए नहीं।
4.3.4 नैतिक मुद्दे
जैवनैतिकता किसी भी नई तकनीकों से जुड़ी प्रक्रियाओं और नैतिक प्रभावों से जुड़े जोखिमों के आकलन को संदर्भित करती है। जबकि सोमैटिक कोशिकाओं की आनुवंशिक संशोधन को वैज्ञानिक समुदाय के एक बड़े हिस्से द्वारा स्वीकृत किया जाता है, जर्मलाइन कोशिकाओं में जीन चिकित्सा अक्सर विज्ञान के क्षेत्र में गरमागरम चर्चा का विषय बनती है। चूंकि जीन चिकित्सा शरीर के मूलभूत जीन समूह में परिवर्तन करने को शामिल करती है, यह अद्वितीय नैतिक विचारों को उत्पन्न करती है। जीन चिकित्सा से जुड़ी कुछ नैतिक चिंताएं इस प्रकार हैं:
- जर्मलाइन जीन थेरेपी के पीछे की नैतिकता को तय करना एक बड़ा प्रश्न है। संबद्ध जोखिमों के अलावा, यह अक्सर तर्क दिया जाता है कि प्रजनन प्रक्रियाओं, जैसे इन विट्रो फर्टिलाइजेशन को आनुवंशिक रोगों के उपचार के लिए शामिल करने के बजाय, दोषी भ्रूण को त्याग देना चाहिए। साथ ही, जर्मलाइन उत्परिवर्तनों की पहचान के लिए प्रसवपूर्व आनुवंशिक परीक्षण की आवश्यकता होती है, जिससे गर्भपात और भ्रूणहत्याओं की संख्या में वृद्धि हो सकती है।
- जीन थेरेपी को किसी लक्ष्य जीन में परिवर्तन (जीन एन्हांसमेंट) से अलग करना एक अन्य चिंता है। सख्त नियमों की आवश्यकता है ताकि ऐसे शोधों का दुरुपयोग जीन एन्हांसमेंट शोध के लिए न हो, जिसका परिणाम अप्रत्याशित है।
- ऐसी तकनीक और इसके लाभों तक पहुंच समान रूप से वितरित नहीं की जा सकती है क्योंकि विकसित और धनी देश या लोग इसका लाभ उठा सकते हैं। साथ ही, अधिकांश मामलों में, जीन थेरेपी का उपयोग मुख्य रूप से उन रोगियों में किया गया है जिनके लिए अन्य सभी उपचार विफल रहे हैं। कोई भी नई तकनीक पूर्ण होने में समय लेती है और यही धारणा जीन थेरेपी पर भी लागू होती है।
जीन थेरेपी को एक दृष्टिकोण के रूप में अक्सर इस आरोप में आलोचना का सामना करना पड़ता है कि यह बहुत अधिक वादे करती है लेकिन बहुत कम वितरित करती है। हालांकि, निरंतर प्रयासों के साथ यह एकल जीन दोषों वाले आनुवंशिक रोगों के उपचार के लिए एक सामान्य प्रथा साबित हो सकती है।
4.4 पुनःसंयोजी टीके
एक ऐसी तैयारी जिसमें मारे गए या कमजोर किए गए रोगजनक या उनके अंश होते हैं और जिसे प्रतिरक्षा प्रतिक्रिया उत्पन्न करने के लिए दिया जाता है ताकि बाद में संक्रामक एजेंट को पहचाना जा सके और रोग से लड़ा जा सके, उसे वैक्सीन कहा जाता है। वैक्सीन शब्द की रचना एडवर्ड जेनर ने की थी (लैटिन शब्द vacca का अर्थ है गाय), जिसने एक व्यक्ति की त्वचा में गाय के चेचक वायरस का इंजेक्शन देकर चेचक के खिलाफ सफल सुरक्षा प्रदान की। इंजेक्शन और वैक्सीन देने की इस प्रक्रिया को ‘वैक्सीनेशन’ कहा जाता है। वैक्सीनेशन शब्द की रचना लुई पाश्चर ने 1881 में की थी। वैक्सीनेशन के दौरान, रोगजनक (जीवित या निष्क्रिय) या रोगजनक के एक अंश को एंटीजन कहा जाता है, जिसे एक व्यक्ति में प्रतिरक्षा उत्पन्न करने के उद्देश्य से इंजेक्ट किया जाता है। परिणामस्वरूप, बाद में उसी रोगजनक के संपर्क में आने पर, एंटीबॉडी और स्मृति प्रतिरक्षा कोशिकाओं की भागीदारी से तेज और उच्च स्तर की प्रतिरक्षा प्रतिक्रिया उत्पन्न होती है। शिशुओं और छोटे बच्चों को दी जाने वाली सबसे सामान्य वैक्सीनें DPT (डिप्थीरिया, परटुसिस, टेटनस) और MMR (खसरा, कण्ठमाला, रूबेला) हैं, क्योंकि उनकी प्रतिरक्षा का स्तर कम होने के कारण उन्हें सबसे अधिक जोखिम होता है। प्रारंभ में, वैक्सीनें ज्यादातर रोगजनकों को कमजोर या निष्क्रिय करके विकसित की गई थीं। पारंपरिक वैक्सीनों से जुड़ी कई संभावित चिंताओं, जैसे जीवित कमजोर की गई वैक्सीन के मामले में संक्रमण की संभावना, टॉक्सॉइड्स के फिर से विषैले रूप में बदलने, या अवांछित अंशों के सह-शुद्धिकरण और पर्याप्त मात्रा में शुद्ध एंटीजेनिक अंश प्राप्त करने में आने वाली जटिलता को दूर करने के लिए, rDNA तकनीक के विभिन्न उपकरणों का उपयोग करके पुनःसंयोजी वैक्सीनें विकसित की गईं। पुनःसंयोजी वैक्सीन की तीन मुख्य प्रकार हैं:
1. जीवित आनुवंशिक रूप से संशोधित टीके
जीवित रोगजनक जीव (बैक्टीरिया या वायरस) को एक या अधिक जीनों की विलोपन या निष्क्रियता द्वारा जोखिम रहित और सुरक्षित गैर-रोगजनक जीव में संशोधित किया जाता है। इन विलोपन या जीन-निष्क्रिय टीकों को मुख्य रूप से रोग एजेंट को कमजोर या अपचयित करने के लिए विकसित किया जाता है।
वेक्टर-आधारित टीके जो किसी अन्य रोग एजेंट से विदेशी जीन ले जाते हैं, वे भी इस श्रेणी के जीवित आनुवंशिक रूप से संशोधित जीवों के अंतर्गत आते हैं। ये वेक्टर-आधारित टीके बैक्टीरिया, वायरस या पौधे होते हैं जो किसी अन्य रोग एजेंट से एक जीन ले जाते हैं जो व्यक्त होता है और जब मेजबान में इंजेक्ट किया जाता है, तो एक प्रतिरक्षा प्रतिक्रिया उत्पन्न करता है। ऐसे टीकों के उदाहरणों में साल्मोनेला टीका (भेड़ और पोल्ट्री के लिए) और एक छद्म-रेबीज वायरस टीका (सूअरों के लिए) शामिल हैं। वायरल और बैक्टीरियल वेक्टरों के मामले में, टीका स्वयं के अलावा रोगजनक जीव के खिलाफ भी एक सुरक्षात्मक प्रतिक्रिया उत्पन्न करता है। विदेशी जीनों को टीका वेक्टर के जीनोम में इस तरह सम्मिलित किया जाना चाहिए कि टीका जीवित बना रहे। वेक्टर-आधारित टीकों का उदाहरण वैक्सीनिया वायरस है, एक लिपटा हुआ वायरस जो पॉक्स परिवार से संबंधित है। इसमें लगभग 200 जीनों के साथ एक बड़ा रेखीय द्वि-स्ट्रैंडेड डीएनए जीनोम होता है। इस वायरस के जीनोम में विदेशी डीएनए के खंडों को समायोजित किया जा सकता है जो अपने स्वयं के जीनों के साथ-साथ व्यक्त हो सकते हैं।

चित्र 4.10: वायरस का उपयोग करके वेक्टर आधारित वैक्सीन का उत्पादन
rDNA तकनीक की सहायता से, कई भिन्न रोगजनकों की प्रतिजनिक जीनों को ले जाने वाले वैक्सीनिया वायरस का निर्माण किया गया है जो एक साथ कई भिन्न रोगों से सुरक्षा प्रदान करने में सक्षम हैं। ऐसे टीकों को बहु-प्रतिरक्ष (polyvalent) या बहु-प्रतिजनिक (multivalent) टीके कहा जाता है, जो उनके प्रतिजनिक स्थलों पर आधारित होते हैं (चित्र 4.10)। इस प्रकार, टीके के रूप में प्रयुक्त होने वाले वैक्सीनिया वेक्टरों के उत्पादन के लिए, वैक्सीनिया वायरस के DNA को हटाया जाता है और हेपेटाइटिस वायरस, हर्पीज सिंप्लेक्स वायरस और इन्फ्लुएंजा वायरस की जीनों को प्लाज्मिड वेक्टर में डाला जाता है (चित्र 4.10)। ये सम्मिलन वेक्टर अब वैक्सीनिया वायरस के रखरखाव के लिए आवश्यक जीनों के साथ-साथ रुचि के विदेशी सब-यूनिट जीनों को भी धारण करते हैं। इन सम्मिलन वेक्टरों को फिर सामान्य वैक्सीनिया वायरसों के साथ मेजबान कोशिकाओं में पेश किया जाता है। चूँकि वैक्सीनिया वायरस मेजबान की मशीनरी पर कब्जा कर लेता है, यह मेजबान कोशिका के कोशिकाद्रव्य में प्रतिकृतिकरण करने और अपने प्रोटीन उत्पन्न करने के लिए ट्रांसक्राइब करने में सक्षम होता है। वायरल DNA प्रतिकृतिकरण के दौरान, प्लाज्मिड सामान्य वैक्सीनिया DNA के साथ ले लिए जाते हैं ताकि पुनः संयुक्त वैक्सीनिया वायरस उत्पन्न हो सकें। ये पुनः संयोजित वैक्सीनिया वेक्टर टीके हेपेटाइटिस, इन्फ्लुएंजा, मलेरिया, हर्पीज सिंप्लेक्स वायरस, रेबीज और वेसिकुलर स्टोमाटाइटिस के खिलाफ 1990 के दशक की शुरुआत से उपलब्ध हैं। वेक्टर आधारित टीकों का सबसे महत्वपूर्ण लाभ यह है कि वे B कोशिकाओं और T कोशिकाओं दोनों को उत्तेजित करने में सक्षम होते हैं। परिणामस्वरूप, वैक्सीनिया वायरस रोगजनकों के खिलाफ उच्च स्तर की सुरक्षा प्रदान करता है। लेकिन, सुरक्षा संबंधी चिंताओं के कारण, इनमें से कोई भी टीका मानव उपयोग के लिए लाइसेंस प्राप्त नहीं हुआ है।
बॉक्स 3: पौधों में बनने वाले टीके
खाने योग्य टीके ऐसे टीके होते हैं जिनका उत्पादन पौधों में किया जाता है और इन्हें आसानी से उस पौधे के भाग को खाने से दिया जा सकता है जिसमें टीका होता है, जैसे फल, पत्तियाँ और बीज आदि। महत्वपूर्ण प्रतिजन जीनों को विभिन्न पौधों—जैसे तम्बाकू, केला, आलू, टमाटर और चावल आदि—में विभिन्न वेक्टरों की सहायता से डाला गया है। इन पुनःसंयोजित वेक्टरों को पौधों में या तो जीवाणु रूपांतरण प्रणाली (जैसे Agrobacterium tumefaciens) द्वारा या सूक्ष्मकण बमबारी विधि से पेश किया जाता है। खाने योग्य टीके को खाने से म्यूकोसल प्रतिरक्षा तंत्र उत्तेजित होता है और प्रतिरक्षा प्रतिक्रिया उत्पन्न होती है।
उदाहरण: हेपेटाइटिस B केला HBsAg जीन को एक प्लाज्मिड वेक्टर में डालकर सफलतापूर्वक बनाया गया है और अंततः इस संरचना को पौधे की कोशिका में डाला गया। केला मौखिक टीका उत्पादन के लिए सर्वोत्तम पौधा है क्योंकि यह आसानी से पच जाता है, पकाने की आवश्यकता नहीं होती, स्वादिष्ट होता है, सस्ता होता है और वर्ष भर उपलब्ध रहता है।

2. पुनःसंयोजित सब-यूनिट टीके
उप-इकाई टीके पूर्ण रोगजनक जीव का केवल एक भाग रखते हैं। ये या तो एक संश्लेषित पेप्टाइड हो सकते हैं या एक पूर्ण प्रोटीन जो रोगजनक जीव से निकाला गया हो या प्रयोगशाला में क्लोन किए गए जीन से अभिव्यक्त किया गया हो। प्रोकैरियोटिक प्रणालियाँ, जैसे कि Escherichia coli, या यूकैरियोटिक प्रणालियाँ, जैसे कि यीस्ट, का उपयोग रीकॉम्बिनेंट प्रोटीन को अभिव्यक्त करने के लिए किया जा सकता है। इन टीकों के लाभों में शुद्धता, स्थिरता और सुरक्षित उपयोग शामिल हैं। हेपेटाइटिस B के खिलाफ विकसित किया गया एक ऐसा ही उप-इकाई टीका है, जो एक व्यापक रोग है जो मुख्य रूप से यकृत को प्रभावित करता है और सिरोसिस, पुरानी हेपेटाइटिस और कैंसर का कारण बनता है। हेपेटाइटिस B वायरस में एक कोर होता है जिसमें वायरल जीनोम (DNA) होता है और यह एक फॉस्फोलिपिड एन्वलप से घिरा होता है जिसमें सतह एंटीजन HBsAg होते हैं, जो हेपेटाइटिस B टीके के लिए प्रमुख तत्व हैं। हेपेटाइटिस B वायरस को संवर्धित करना और इन सतह एंटीजन का उत्पादन करना बहुत जटिल है। इसलिए, rDNA तकनीक के आगमन के साथ, HBsAg सतह प्रोटीन को कोड करने वाले जीन की पहचान की गई और इसे pMA56, एक यीस्ट प्लाज्मिड वेक्टर में सम्मिलित किया गया और Saccharomyces cerevisiae यीस्ट कोशिकाओं में अभिव्यक्त किया गया।
3. DNA टीके
हाल के वर्षों में, डीएनए वैक्सीन वैक्सीन प्रौद्योगिकी में एक आशाजनक प्रगति हैं। डीएनए वैक्सीन के लिए, रुचि के जीन (एंटीजन) की पहचान की जाती है और प्लाज्मिड में क्लोन किए जाते हैं। डीएनए वैक्सीन ले जाने वाला प्लाज्मिड एक प्रमोटर साइट, क्लोनिंग साइट, रेप्लिकेशन का मूल, एक चयनात्मक मार्कर अनुक्रम और एक टर्मिनेटर अनुक्रम, जैसे कि पॉली-ए टेल रखता है। टीकाकरण के दौरान, डीएनए को सीधे जानवर के मॉडल सिस्टम जैसे कि चूहों की मांसपेशियों में इंजेक्ट किया जाता है, आमतौर पर एक ‘जीन गन’ का उपयोग करके जो संपीडित गैस पर आधारित होता है, डीएनए को मांसपेशी में इंजेक्ट करने के लिए। डीएनए वैक्सीन को नेजल स्प्रे द्वारा भी दिया जा सकता है। एंटीजेनिक डीएनए कुछ मांसपेशी कोशिकाओं द्वारा लिया जाता है, जो प्रोटीन अभिव्यक्ति के बाद, प्रतिरक्षा प्रणाली को प्रेरित करती हैं। डीएनए वैक्सीन ह्यूमोरल और सेलुलर दोनों प्रतिरक्षा प्रतिक्रियाओं को प्रेरित करने में सक्षम हैं।
बॉक्स 4
HBsAg जीन को एक मजबूत अल्कोहल डिहाइड्रोजनेज प्रोमोटर (ADH प्रोमोटर) से जोड़ा जाता है। इन प्लाज्मिडों को ट्रांसफर और कल्चर किया जाता है। pMA56 प्लाज्मिड में यीस्ट जीन से एक टर्मिनेशन सीक्वेंस और बैक्टीरिया से रेप्लिकेशन ऑरिजिन भी होता है। रिकॉम्बिनेंट्स के चयन के लिए, pMA56 में एक एंटीबायोटिक प्रतिरोध मार्कर और एक ऐसा जीन उपयोग किया गया है जो केवल ट्रिप्टोफेन अमीनो एसिड की अनुपस्थिति में वृद्धि की अनुमति देता है। प्रोटीन को अलग किया जाता है, शुद्ध किया जाता है और इम्यूनाइज़ेशन के लिए उपयोग किया जाता है। यह पहला रिकॉम्बिनेंट सबयूनिट वैक्सीन था जो सार्वजनिक उपयोग के लिए लाइसेंस प्राप्त हुआ था, 1987 में लाइसेंस प्राप्त हुआ और Recombivax ${ }^{\circledR}$ और Engerix-B ${ }^{\circledR}$ के रूप में बाजार में उतारा गया।

यीस्ट कोशिकाओं में HBsAg का उत्पादन (ADH: अल्कोहल डिहाइड्रोजनेज TrpI: ट्रिप्टोफान बायोसिंथेसिस जीन I; $2 \mu \mathrm{m}$. यीस्ट अनुक्रम
4. RNA वैक्सीन
RNA वैक्सीन में mRNA होता है। एक बार टीकाकरण के लिए इंजेक्ट होने पर, mRNA सीधे एंटीजन प्रेजेंटिंग कोशिकाओं और अन्य लक्ष्य कोशिकाओं द्वारा लिया जाता है, जहाँ mRNA एक सही तरीके से फोल्ड और ग्लाइकोसिलेटेड प्रोटीन के रूप में व्यक्त होता है जो एक एंटीजन के रूप में कार्य करता है (चित्र 4.11)। ये वैक्सीन एन्कोडेड प्रोटीन के खिलाफ ह्यूमोरल और सेलुलर दोनों इम्यून प्रतिक्रिया उत्पन्न करते हैं।
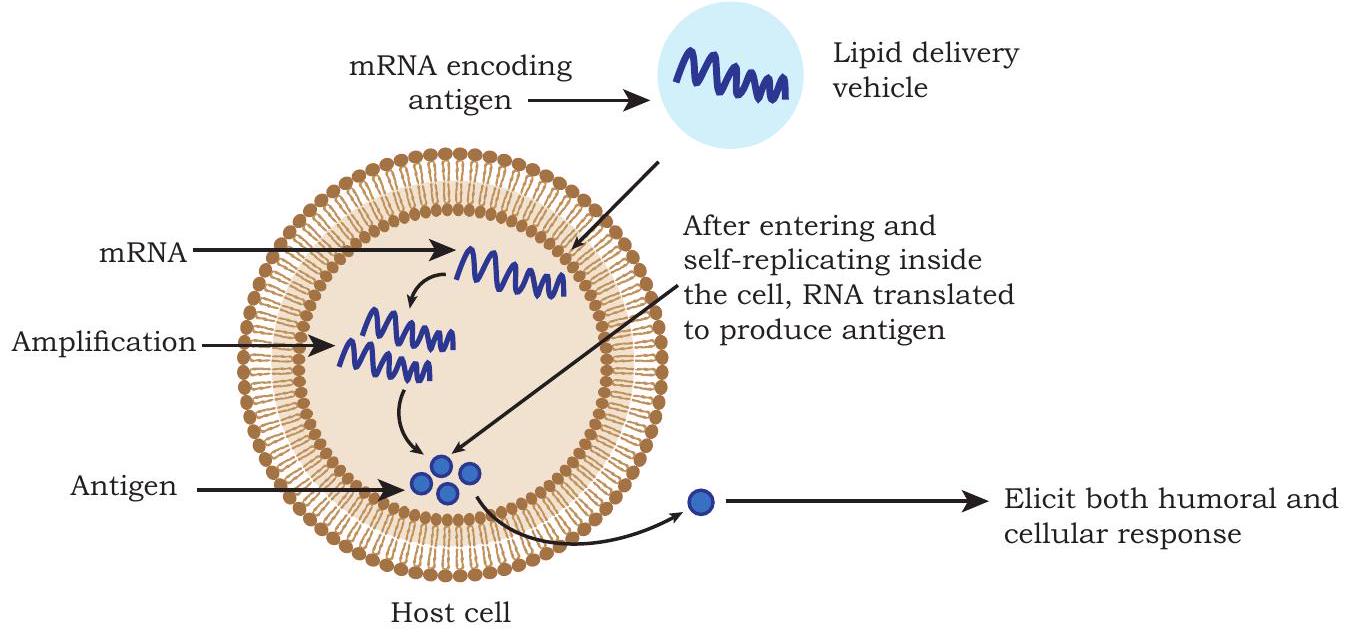
चित्र 4.11: RNA वैक्सीन
RNA अस्थिर होने के कारण, इंजेक्ट किए गए mRNA की स्थिरता को विभिन्न तरीकों से संशोधित करके बनाए रखा जाता है, जैसे कि 5’ कैप जोड़ना; 3’ PolyA पूंछ की लंबाई और संरचना; अनअनुवादित क्षेत्रों का उपयोग और न्यूक्लियोटाइड्स का संशोधन आदि। ऐसे RNA संशोधन mRNA की प्रतिरक्षजनकता को बढ़ाने में भी सहायक होते हैं। इसलिए, RNA वैक्सीनों को विशिष्ट डिलीवरी सिस्टम जैसे लिपिड नैनोपार्टिकल्स (LNPs) के साथ तैयार किया जाता है, जो RNA को अपघटन से बचाते हैं और लक्ष्य कोशिका में अपटेक को बढ़ाते हैं।
एक वैक्सीन की थर्मोस्थेबिलिटी वैक्सीन के भंडारण और उपयोग के दौरान ठंडी स्थितियों की आवश्यकता को कम करने के लिए महत्वपूर्ण है। चूंकि RNA अस्थिर होता है, इसे लंबे समय तक स्थिर रखने के लिए भंडारित करते समय जमाना पड़ता है। RNA वैक्सीनों की थर्मोस्थेबिलिटी को बेहतर बनाने के प्रयास जारी हैं। लायोफिलाइज़ेशन या फ्रीज़-ड्राइंग को उनकी थर्मोस्थेबिलिटी बढ़ाने के तरीके के रूप में प्रस्तावित किया गया है। इस दिशा में, उपरोक्त उल्लिखित थर्मोस्थेबल लिपिड नैनोपार्टिकल्स के साथ RNA का फॉर्मूलेशन भी RNA वैक्सीनों की थर्मोस्थेबिलिटी को बेहतर बनाने के लिए सुझाया गया है।
RNA वैक्सीन तुलनात्मक रूप से सरल होती हैं और उनका उत्पादन उच्च यील्ड देता है। इनका वायरस-रहित उत्पादन प्रक्रिया मामूली और स्केलेबल उत्पादन सुविधाओं को सक्षम बनाता है। सेल-रहित उत्पादन के परिणामस्वरूप, दूषित एजेंटों के संबंध में कम चिंता रहती है। mRNA वैक्सीन तकनीक का एक अन्य महत्वपूर्ण लाभ यह है कि यह उभरते हुए वायरल वेरिएंट्स पर तेजी से प्रतिक्रिया करने की क्षमता रखती है। इसका अर्थ है कि बदले हुए अनुक्रमों वाले म्यूटेंट्स के लिए संशोधित mRNA वैक्सीन बनाना तेज और सरल है।
इस प्रकार, RNA वैक्सीन अन्य वैक्सीन श्रेणियों की तुलना में कई लाभ प्रदान करती हैं, जिनमें शामिल हैं तेज और कम लागत वाला विकास (पूरी तरह से सिंथेटिक दृष्टिकोण का उपयोग करके mRNA के तेज डिज़ाइन और संश्लेषण के कारण), अनुकूलन और नियामक परीक्षण की कम आवश्यकता (पहले से मौजूद अनुकूलित और लाइसेंस प्राप्त फॉर्मूलेशन और डिलीवरी विधि के कारण)। इसके अतिरिक्त, mRNA वैक्सीन को प्रत्येक शॉट में कम मात्रा की आवश्यकता होती है और यहां तक कि दो खुराकों की भी आवश्यकता नहीं हो सकती है। साथ ही, यह अन्य वैक्सीनों की तुलना में नए उभरते हुए पैथोजन वेरिएंट्स के मामले में अधिक तेजी और दक्षता से उत्पादित की जा सकती है। RNA वैक्सीन तुलनात्मक रूप से सुरक्षित होती हैं। इनमें पैथोजन के पुनः सक्रिय होने का कोई जोखिम नहीं होता है और RNA in vivo में अपघटित हो जाती है, जिससे एंटीजन के स्थायित्व या जीनोम में एकीकरण का कोई जोखिम नहीं रहता है। हालांकि, mRNA वैक्सीन को उनकी बेहतर थर्मोस्टेबिलिटी के लिए संबोधित करने की आवश्यकता है।
COVID-19 के खिलाफ mRNA वैक्सीन विकास
COVID-19 महामारी उच्च संक्रामकता वाले, नए, पहले अपरिचित या उत्परिवर्तित Severe Acute Respiratory Syndrome Corona Virus-2 (SARS-CoV-2) उपभेदों के कारण होने वाली महामारियों के निरंतर खतरे को दर्शाती है। भारत में चल रही COVID-19 महामारी के लिए व्यापक रूप से प्रयुक्त होने वाले टीके हैं—Covaxin (निष्क्रिय पूरा वायरस) और Covishield (एडेनोवायरस आधारित DNA टीके)। हालांकि, महामारियों के प्रभावी नियंत्रण के लिए RNA आधारित टीकों का भी विकास किया जा रहा है। COVID-19 के लिए 25 से अधिक mRNA आधारित टीके उम्मीदवार विभिन्न पूर्व-क्लिनिकल और क्लिनिकल परीक्षण चरणों में हैं। mRNA-1273 एक लिपिड नैनोपार्टिकल (LNP) से घिरा mRNA आधारित टीका है जो SARS-CoV-2 के स्पाइक प्रोटीन के स्थिर रूप को एन्कोड करता है। इंजेक्शन देने पर, घिरा हुआ mRNA1273 प्रतिरक्षा कोशिकाओं (लसीका ग्रंथियों) तक जाता है और उन्हें अपनी सतह पर SARS-CoV-2 के संक्रमण के समान स्पाइक प्रोटीन की प्रतियाँ बनाने का निर्देश देता है। इस बीच, अन्य प्रतिरक्षा कोशिकाएँ स्पाइक प्रोटीन के बारे में सीखती हैं और SARS-CoV-2 के प्रति भविष्य की प्रतिक्रिया के लिए खुद को तैयार करती हैं।
4.5 चिकित्सीय एजेंट/अणु: मोनोक्लोनल एंटीबॉडी, इंसुलिन और वृद्धि हार्मोन
पुनर्संयोजी डीएनए प्रौद्योगिकी ने विभिन्न प्रकार के सुरक्षित, शुद्ध और प्रभावी मानव प्रोटीनों के बड़े पैमाने पर जैविक उत्पादन को सुगम बनाकर स्वास्थ्य सेवा में क्रांति ला दी है। रोग के उपचार और मानवों के स्वास्थ्य में सुधार के लिए प्रयुक्त यौगिकों को चिकित्सीय एजेंट कहा जाता है। पुनर्संयोजी डीएए प्रौद्योगिकी के आगमन से न केवल नए चिकित्सीय एजेंट उत्पन्न किए जा रहे हैं, बल्कि परंपरागत रूप से उत्पादित चिकित्सीय पदार्थों की अधिक प्रभावी रूप भी निर्मित की जा रही हैं। चूंकि ये पुनर्संयोजी चिकित्सीय पदार्थ प्राकृतिक मानव प्रोटीनों के समान होते हैं—पशुओं (जैसे गाय और सुअर) से पृथक किए गए प्रोटीनों के विपरीत—इसलिए ये प्रतिरक्षा प्रतिक्रिया उत्पन्न नहीं करते और किसी भी एलर्जी प्रतिक्रिया के खतरे से मुक्त होते हैं। वर्तमान में, अनेक उत्पाद—जैसे एंटीबायोटिक, मोनोक्लोनल एंटीबॉडी, रक्त के थक्के बनाने वाले कारक, हार्मोन (इंसुलिन और वृद्धि हार्मोन), साइटोकाइन और टीके—मानव कल्याण के लिए उत्पादित किए जा रहे हैं।
प्रतिरक्षा तंत्र की B कोशिकाओं द्वारा उत्पादित प्रोटीन अणु प्रतिरक्षा कहलाते हैं और ये शरीर को बाहर से आने वाले विदेशी पदार्थों जिन्हें एंटीजन कहा जाता है, से सुरक्षा प्रदान करते हैं। मानव सीरम में पाँच प्रकार के प्रतिरक्षा उपस्थित होते हैं: IgA, $\mathrm{IgD}, \mathrm{IgE}, \mathrm{IgG}$ और IgM। B कोशिकाएँ किसी विदेशी कण के प्रतिसाद में एंटीजन की सतह पर उपस्थित विभिन्न क्षेत्रों जिन्हें एपिटोप कहा जाता है, के प्रति विशिष्ट कई प्रकार के प्रतिरक्षा उत्पन्न करती हैं और इसलिए इन्हें बहुक्लोनिक प्रतिरक्षा कहा जाता है। यह बहुक्लोनिक प्रतिरक्षा माध्यित प्रतिसाद एंटीजन के प्रसंस्करण और विघटन की ओर ले जाता है और इसलिए जीव के लिए in vivo स्पष्ट लाभ होता है। तथापि, इनकी विषम प्रकृति के कारण in vitro उपयोग के लिए इनकी प्रभावकारिता सीमित होती है। इसके विपरीत, किसी विशेष क्षेत्र या एपिटोप के प्रति विशिष्ट प्रतिरक्षा, जिन्हें एकलक्लोनिक प्रतिरक्षा (MAB) कहा जाता है, को in vitro उद्देश्यों जैसे चिकित्सीय और निदानात्मक अनुप्रयोगों में बहुत अच्छी तरह से उपयोग में लाया जा सकता है।
पहले, किसी जानवर को एक प्रतिजन के संक्षिप्त संपर्क में लाने के बाद, B कोशिकाओं को अलग किया जाता था और मोनोक्लोनल एंटीबॉडीज़ उत्पन्न करने के लिए उनकी संवर्धन किया जाता था। हालाँकि, B कोशिकाओं का संवर्धन बहुत ही जटिल और कठिन होता है, और साथ ही उत्पन्न होने वाली मोनोक्लोनल एंटीबॉडीज़ भी अल्पकालिक होती हैं। जॉर्ज कोहलर और सीज़र मिल्स्टीन (1975) द्वारा किया गया एक आविष्कार एक रास्ता प्रदान करता है, जिसके द्वारा हाइब्रिडोमा तकनीक का उपयोग करके मोनोक्लोनल एंटीबॉडीज़ का बड़े पैमाने पर उत्पादन किया जा सकता है, जहाँ अल्पकालिक एंटीबॉडी स्रावित सामान्य B कोशिका को पॉलीएथिलीन ग्लाइकोल (PEG) की सहायता से अमर मायलोमा कोशिका के साथ संलग्न किया जाता है, जिससे हाइब्रिड कोशिकाएँ बनती हैं जिन्हें हाइब्रिडोमा कहा जाता है। हाइब्रिडोमा कोशिकाएँ अमर वृद्धि प्राप्त कर लेती हैं, जो मायलोमा कोशिका की एक विशिष्ट विशेषता है, साथ ही B प्लाज्मा कोशिका द्वारा प्रदान की गई एंटीबॉडी उत्पादन क्षमता भी। मायलोमा कोशिकाओं को जेनेटिकली इंजीनियर किया जाता है ताकि वे हाइपोक्सैंथिन, एमिनोप्टेरिन और थाइमिडिन (HAT माध्यम) का उपयोग न्यूक्लिक अम्ल जैवसंश्लेषण के स्रोत के रूप में न कर सकें और संवर्धन में मर जाएँ। दूसरी ओर, B कोशिकाएँ HAT माध्यम में जीवित रह सकती हैं लेकिन उनकी एक निश्चित जीवन अवधि होती है और वह उसके बाद मर जाती हैं। केवल वे B कोशिकाएँ ही संवर्धन में जीवित रहेंगी जो इन इंजीनियर मायलोमा कोशिकाओं के साथ संलग्न हो गई हैं, जब उन्हें HAT माध्यम में उगाया जाता है (चित्र 4.12)। rDNA तकनीक में प्रगति के साथ, यह संभव है कि माउस एंटीबॉडीज़ विकसित की जाएँ जिनमें कुछ मानव खंड हों, जिन्हें काइमेरिक या मानवीकृत एंटीबॉडीज़ कहा जाता है और जो उच्च प्रभावकारिता और सक्रियता रखते हैं।
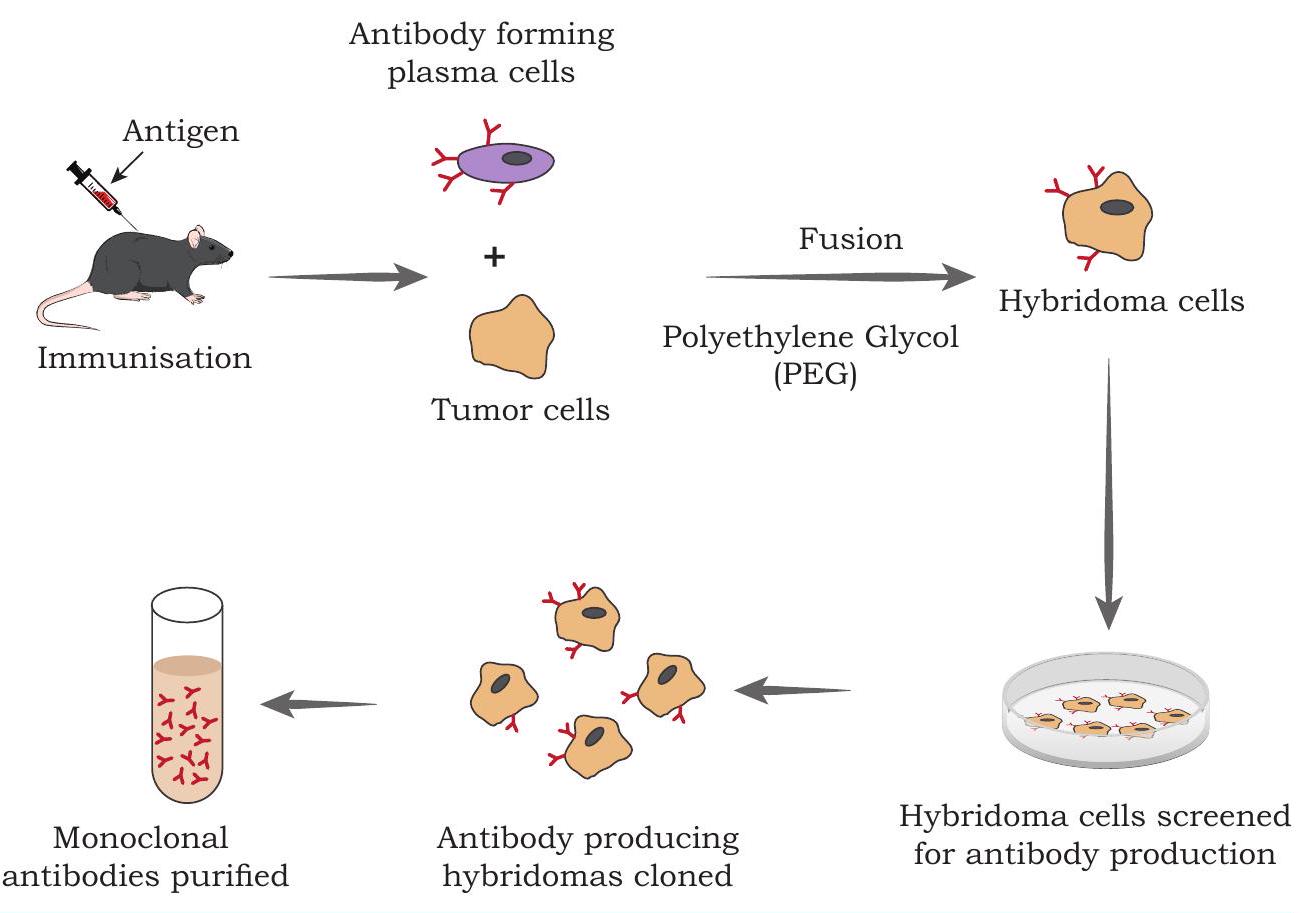
चित्र 4.12: हाइब्रिडोमा तकनीक का उपयोग करके मोनोक्लोनल एंटीबॉडीज का उत्पादन
मोनोक्लोनल एंटीबॉडीज ने विभिन्न बीमारियों के निदान में क्रांति ला दी है और ये कई व्यावसायिक रूप से उपलब्ध नैदानिक किटों में उपयोग की जाती हैं, जैसे गर्भावस्था का पता लगाने वाली किट्स और कैंसर के नैदानिक इमेजिंग में मोनोक्लोनल एंटीबॉडीज का उपयोग, जिसमें ट्यूमर विशिष्ट मोनोक्लोनल एंटीबॉडीज कैंसर और गैर-कैंसर वृद्धि में भेद करने में मदद कर सकती हैं। हाल के वर्षों में, मोनोक्लोनल एंटीबॉडीज को बहुत विशिष्ट लक्षित चिकित्सीय एजेंटों के रूप में नियोजित किया जा रहा है और इन्हें विषाक्त पदार्थों या दवाओं के साथ जोड़ा जाता है और प्रभावी कार्रवाई के लिए लक्षित ऊतकों तक पहुंचाया जाता है।
बॉक्स 5
1921 में, फ्रेडरिक बैंटिंग और हावर्ड बेस्ट द्वारा एक श्रृंखला क्लासिक प्रयोग किए गए, जिससे इंसुलिन के अलगाव की ओर अग्रसर हुआ। इंसुलिन रक्तप्रवाह के माध्यम से शरीर की सभी कोशिकाओं तक वितरित किया जाता है। इंसुलिन की प्राथमिक संरचना का अध्ययन सेंगर ने 1955 में किया, जिसके लिए उन्हें 1958 में नोबेल पुरस्कार प्रदान किया गया।

इंसुलिन, एक हार्मोन जो अग्न्याशय के बीटा कोशिकाओं द्वारा स्रावित होता है, विभिन्न प्रकार की कोशिकाओं पर कार्य करता है जिससे रक्त से ग्लूकोज़ का उपभेदन होता है। इंसुलिन लक्ष्य कोशिकाओं में ग्लूकोज़ को ग्लाइकोजन में बदलने (ग्लाइकोजेनेसिस) को भी उत्तेजित करता है। रक्त में ग्लूकोज़ होमियोस्टेसिस वास्तव में दो हार्मोनों—इंसुलिन और ग्लूकागन—द्वारा संयुक्त रूप से बनाए रखी जाती है। एक जेनेटिक रूप से जुड़ा रोग जो इंसुलिन हार्मोन की कमी के कारण होता है और मूत्र में शर्करा की उपस्थिति से विशेषता होती है, डायबिटीज मेलिटस कहलाता है।
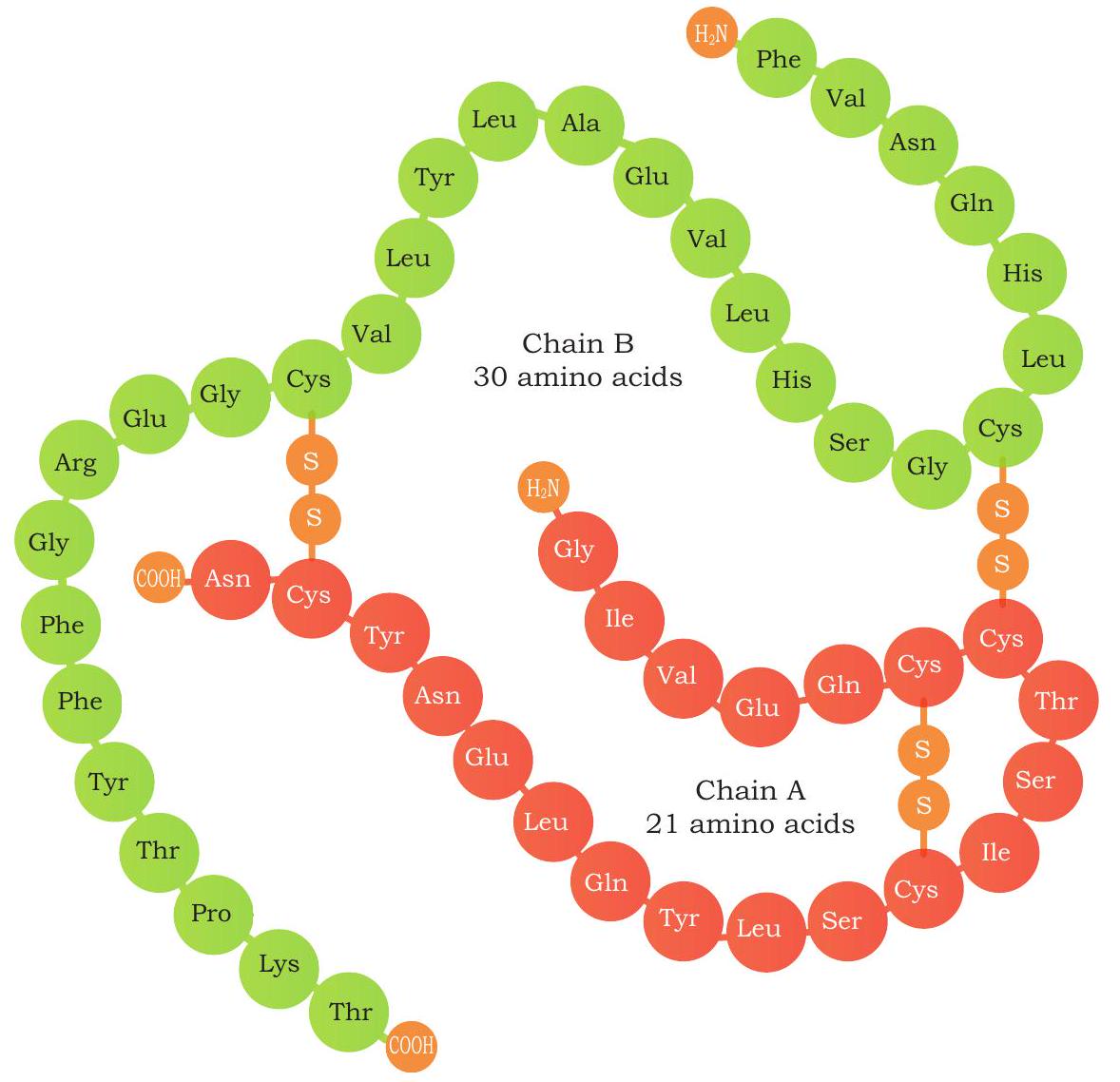
चित्र 4.13: इंसुलिन संरचना: मानव इंसुलिन की प्राथमिक संरचना। A-श्रृंखला लाल रंग में और B-श्रृंखला हरे रंग में दिखाई गई है
संरचनात्मक रूप से, इंसुलिन में दो श्रृंखलाएँ होती हैं: 21 अमीनो अम्लों की A श्रृंखला और 30 अमीनो अम्लों की B श्रृंखला, जो डाइसल्फाइड बंधों से आपस में जुड़ी होती हैं (चित्र 4.13)। बैंटिंग और बेस्ट के प्रयोगों के बाद, इंसुलिन को सूअर और गाय के अग्न्याशय से शुद्ध किया गया। मानव इंसुलिन, सुअर इंसुलिन (सूअर से) और गो-इंसुलिन (गाय से) एक या तीन अमीनो अम्लों को छोड़कर बहुत समान होते हैं। लेकिन रासायनिक संरचना में ये छोटे अंतर कुछ मधुमेह रोगियों में एलर्जी प्रतिक्रिया का कारण बन सकते हैं। परिणामस्वरूप, उपचार के लिए मानव इंसुलिन का उपयोग पशु इंसुलिन की तुलना में अधिक उपयुक्त है। शारीरिक इंसुलिन पहले एक प्राथमिक प्रोटीन में अनुवादित होता है जिसे प्री-प्रोइंसुलिन कहा जाता है जिसमें 110 अमीनो अम्ल होते हैं। एंडोप्लाज्मिक रेटिकुलम में, पहले सिग्नल पेप्टाइड खंड को प्री-प्रोइंसुलिन से काटा जाता है, जिससे प्री-प्रोइंसुलिन प्रोइंसुलिन में बदल जाता है (जिसमें 86 अमीनो अम्ल होते हैं)। प्रोइंसुलिन में तीन अलग-अलग पेप्टाइड श्रृंखलाएँ होती हैं: A-श्रृंखला, B-श्रृंखला और C-पेप्टाइड (जिसमें 31 अमीनो अम्ल होते हैं)। अगले चरण में एंडोप्लाज्मिक रेटिकुलम के अंदर, C-पेप्टाइड और अतिरिक्त चार अमीनो अम्लों को हटाकर 51 अमीनो अम्ल अवशेषों वाला जैविक रूप से सक्रिय इंसुलिन बनाया जाता है (चित्र 4.14)।
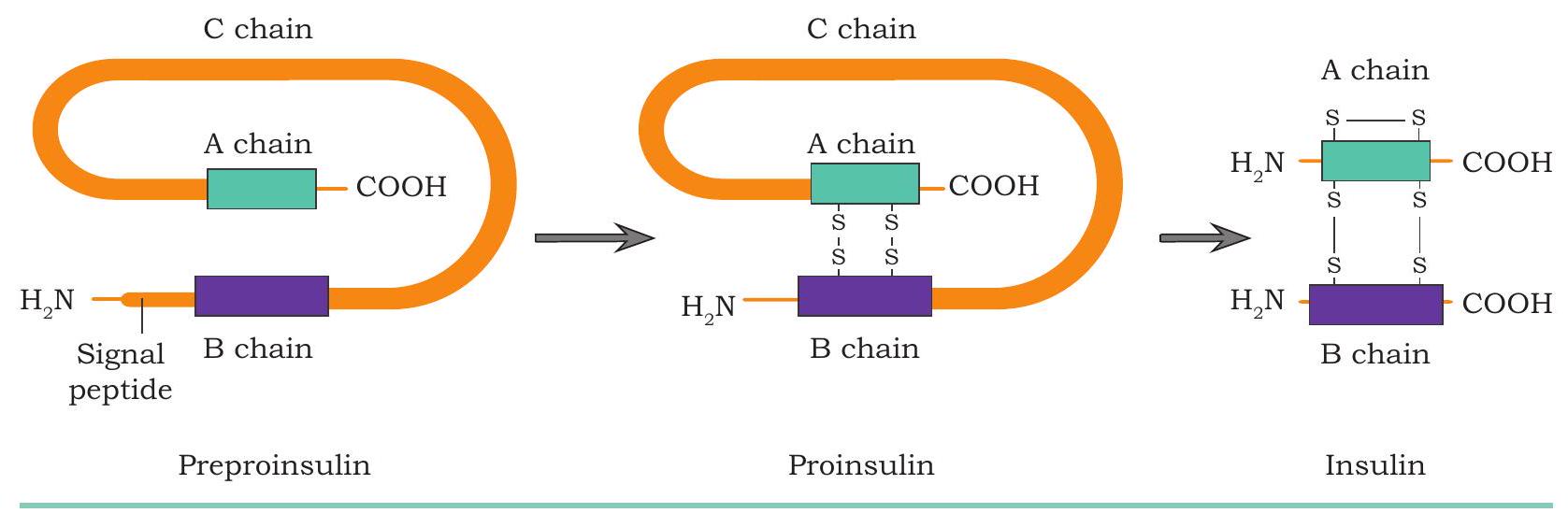
चित्र 4.14: प्री-प्रोइंसुलिन से इंसुलिन में रूपांतरण
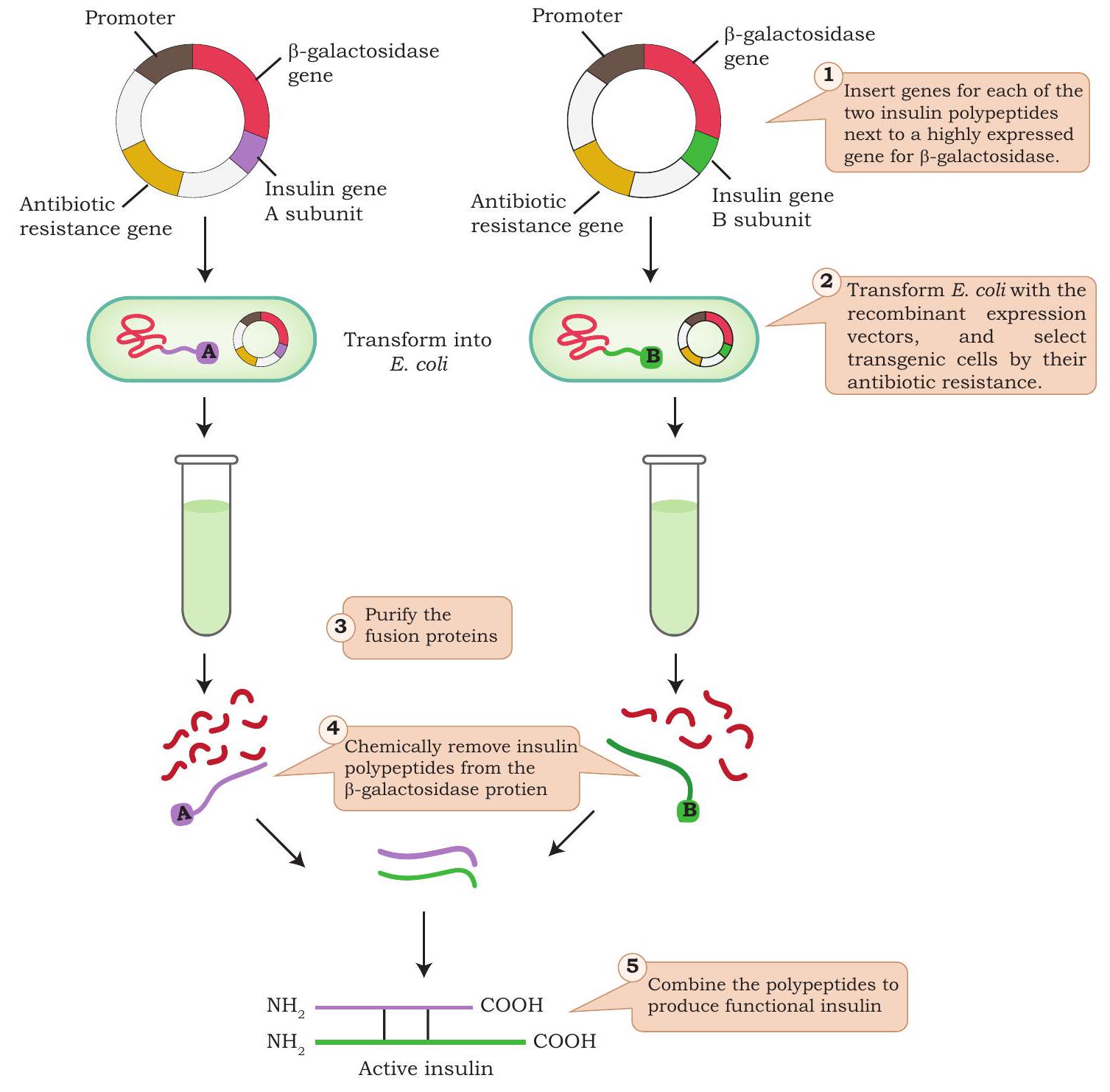
चित्र 4.15: आनुवंशिक रूप से इंजीनियर इंसुलिन के उत्पादन में शामिल चरण
1970 के दशक के अंत में, जैव-रसायनज्ञों ने rDNA प्रौद्योगिकी के विभिन्न उपकरणों का उपयोग इंसुलिन के उत्पादन के लिए किया। जीन पुस्तकालय से अलग किए गए इंसुलिन जीन को E. coli के जीवाणु प्लाज्मिड में डाला गया। लैक ऑपरॉन से प्राप्त एक प्रमोटर साइट को इंसुलिन जीन के ठीक बाद डाला गया। चूंकि इंसुलिन जीन जीवाणु ऑपरॉन के ठीक बाद डाला गया था, इसलिए यह जीन अपने आप व्यक्त हुआ। जीन अभिव्यक्ति ने एक संलयन प्रोटीन उत्पन्न किया, अर्थात् इंसुलिन अणु एंजाइम β-गैलेक्टोसिडेज़ (β-gal) से संलयित था, जिसे बाद में मानव इंसुलिन बनाने के लिए विभाजित किया गया। चूंकि बैक्टीरिया में प्रीप्रोइंसुलिन की प्रक्रिया संभव नहीं थी, वैज्ञानिकों ने इस कठिनाई को दरकिनार करते हुए A और B इंसुलिन श्रृंखलाओं के लिए जीनों को अलग-अलग बैक्टीरिया में क्लोन किया। संलयन प्रोटीन, β-gal-इंसुलिन को निकाला गया और सायनोजन ब्रोमाइड (CNBr) के साथ उपचारित किया गया ताकि β-gal खंड को A और B श्रृंखलाओं से अलग किया जा सके। बाद में, A और B श्रृंखला के बीच डाइसल्फाइड बांडों को पुनः स्थापित कर अंतिम उत्पाद, इंसुलिन को पुनः निर्मित किया गया (चित्र 4.15)।
पहला आनुवंशिक रूप से इंजीनियर किया गया मानव इंसुलिन जिसे Humulin ${ }^{\circledR}$ (चित्र 4.16) के रूप में बाजार में उतारा गया था, 1982 में निर्मित किया गया था जो सूअर और गाय से प्राप्त इंसुलिन की तुलना में अधिक प्रभावी था और इसकी सही अनुक्रम पूरी तरह से किसी भी एलर्जी प्रतिक्रिया से मुक्त था।
चित्र 4.16: Eli Lilly Company E.coli द्वारा व्यक्त इंसुलिन को Humulin के रूप में बाजार में उतार रही है
पीयूष ग्रंथि द्वारा स्रावित एक अन्य महत्वपूर्ण हार्मोन, मानव वृद्धि हार्मोन (HGH), को भी rDNA तकनीक द्वारा उत्पादित किया गया। 191 अमीनो अम्लों वाला HGH एक पेप्टाइड हार्मोन है और यह बचपन तथा वयस्कता के दौरान अमीनो अम्लों, लिपिड्स और कार्बोहाइड्रेट चयापचय को बढ़ाकर शरीर की वृद्धि को बढ़ावा देता है। बचपन में HGH की कमी बौनापन (Dwarfism) का कारण बनती है। बौनापन की विशेषताएँ हैं: शरीर की वृद्धि में बाधा, गोल-मटोल चेहरा, कमर पर अतिरिक्त वसा जमाव और लगभग चार फीट की छोटी ऊँचाई, जबकि वयस्क की बुद्धि औसत होती है लेकिन शरीर के अनुपात असामान्य होते हैं (चित्र 4.17)। चूँकि प्रारंभिक अवस्था में अस्थि वृद्धि पूरी तरह पूर्ण नहीं होती, इसलिए इस चरण में HGH के इंजेक्शन देकर बौनापन का इलाज किया जा सकता है। पारंपरिक उपचार द्वारा एक वर्ष के लिए पर्याप्त HGH मात्रा प्राप्त करने के लिए 80 से अधिक शवों की पीयूष ग्रंथियों की आवश्यकता होती थी। यह विधि न केवल महँगी थी, बल्कि शवों के संक्रमित मस्तिष्क ऊतक से रोग विकसित होने का जोखिम भी लेती थी।
बॉक्स 6
1978 में, संयुक्त राज्य अमेरिका और ग्रेट ब्रिटेन में शव ऊतक के उपयोग पर प्रतिबंध लगा दिया गया क्योंकि इससे क्रूट्ज़फेल्ट-जैकब (CJ) सिंड्रोम के स्थानांतरण की संभावना थी। माना जाता है कि यह रोग वायरस-जैसे एजेंट ‘प्रायन’ के कारण होता है और इसके लक्षण हैं: कंपन, ऐंठन, मनोभ्रंश और पेशियों की क्षीणता। वास्तव में, 1993 तक फ्रांस में शव ऊतक से प्राप्त HGH प्राप्त करने वालों में CJ सिंड्रोम के 24 मामलों की पहचान की गई थी।
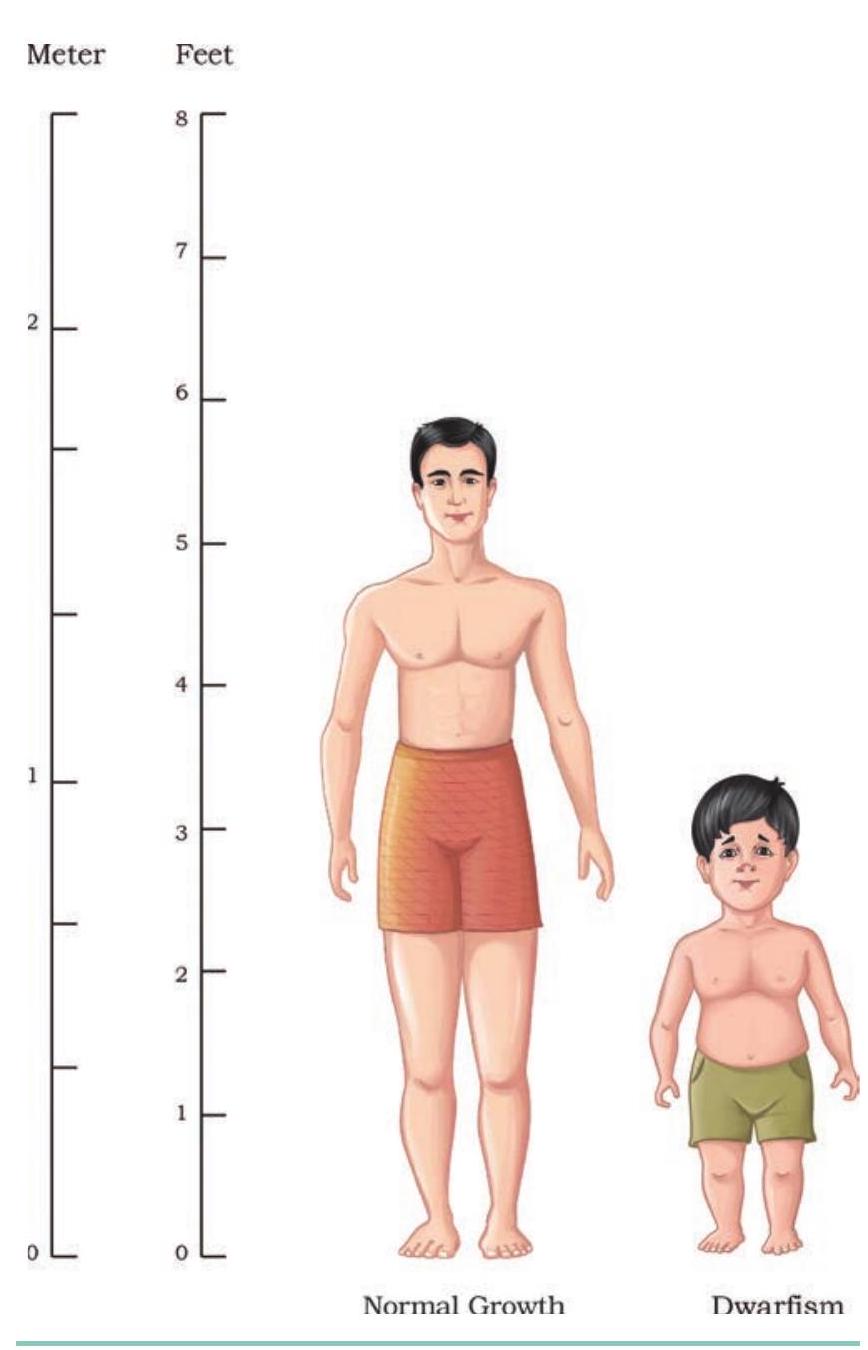
चित्र 4.17: मानव वृद्धि हार्मोन की कमी से विकास मंद हो जाता है और शरीर के अनुपात असामान्य हो जाते हैं
rDNA प्रौद्योगिकी ने संपूर्ण HGH के उत्पादन को सक्षम बनाया है। HGH के लिए उत्पादन प्रक्रिया मानव इंसुलिन उत्पादन के समान है।
यद्यपि प्राकृतिक HGH अणु में 191 अमीनो अम्ल होते हैं, लेकिन शरीर में इसके उत्पादन के दौरान एक मध्यवर्ती अणु में अतिरिक्त 26 अमीनो अम्ल एक सिग्नल पेप्टाइड के रूप में एन्कोड होते हैं। यह सिग्नल पेप्टाइड श्रृंखला अंततः स्राव के दौरान काटकर अलग कर दी जाती है। HGH की पर्याप्त मात्रा प्राप्त करने के लिए, मूलभूत उत्पादन तकनीकों को संशोधित किया गया। परिणामस्वरूप, HGH के लिए जीन संश्लेषित करने के लिए, HGH को एन्कोड करने वाले mRNA को टेम्पलेट के रूप में प्रयोग किया गया और एक समपूरक DNA (cDNA) अणु संश्लेषित किया गया। सिग्नल पेप्टाइड की उपस्थिति के कारण, cDNA के समावेशन के बाद जीवाणु अस्थिर प्रतिक्रिया देता है और मध्यवर्ती HGH अणु से सिग्नल पेप्टाइड को हटाने में असफल रहता है।
इस समस्या को दूर करने के लिए, rDNA प्रौद्योगिकीविदों ने सिग्नल पेप्टाइड को काटने के लिए cDNA अणु के साथ कार्य किया है, जहाँ यह HGH जीन से जुड़ता है। चूँकि कोई भी ज्ञात प्रतिबंधक एंजाइम इस कट को नहीं कर सकता, प्रतिबंधक एंजाइम EcoRI का उपयोग सिग्नल पेप्टाइड (26 अमीनो अम्ल) के लिए आधार अनुक्रमों को हटाने के लिए किया गया, साथ ही अतिरिक्त 24 अमीनो अम्ल (कुल 50 अमीनो अम्ल) को cDNA अणु से हटाया गया। हटाए गए अतिरिक्त 24 अमीनो अम्ल आधार अनुक्रम को रासायनिक रूप से संश्लेषित किया गया और पूरे मानव वृद्धि हार्मोन जीन को उत्पन्न करने के लिए cDNA अणु पर वापस जोड़ा गया (चित्र 4.18)। सिग्नल पेप्टाइड अनुक्रम की अनुपस्थिति में, मानव वृद्धि हार्मोन जीन को हार्मोन उत्पादन के लिए जीवाणु कोशिकाओं में सम्मिलित किया जा सकता है। 1985 में, आनुवंशिक रूप से इंजीनियर किया गया मानव वृद्धि हार्मोन उत्पादित किया गया और Humatrope $^{\circledR}$ और Protropin ${ }^{\circledR}$ के रूप में विपणित किया गया।
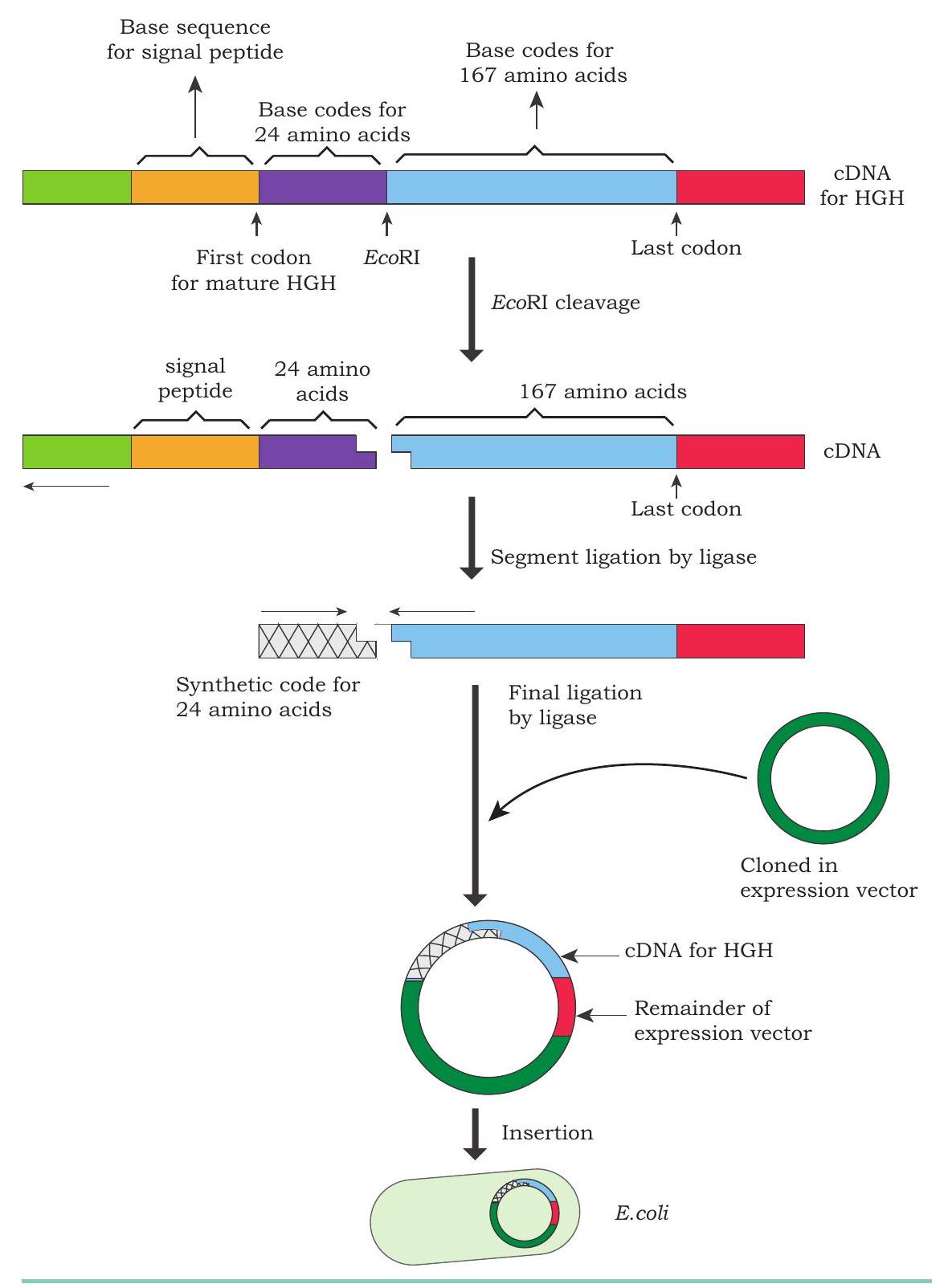
चित्र 4.18: आनुवंशिक रूप से इंजीनियर किए गए मानव वृद्धि हार्मोन का उत्पादन
सारांश
- मानव डीएनए में अनुवांशिक विभिन्नताओं का अध्ययन और तुलना बिना अनुक्रमण के करने के लिए, ‘डीएनए फिंगरप्रिंटिंग’ नामक एक नई तकनीक का विकास सर अलेक जेफ्रीज ने 1984 में लिसेस्टर विश्वविद्यालय में किया।
- डीएनए फिंगरप्रिंटिंग में, वेरिएबल नंबर टैंडेम रिपीट्स (VNTR) के रूप में जाने जाने वाले मिनी-सैटेलाइट डीएनए के एक हिस्से का उपयोग किया जाता है, जो टैंडेम रूप में व्यवस्थित होते हैं और इन्हें रेस्ट्रिक्शन फ्रैगमेंट लेंथ पॉलिमॉर्फिज्म (RFLP) तकनीक द्वारा उपयोग में लाया जाता है।
- किसी जीव के जीनोम में विदेशी जीन (ट्रांसजीन) को सम्मिलित करना और उसके वंशजों में इसके स्थानांतरण और अभिव्यक्ति की प्रक्रिया को ट्रांसजेनेसिस कहा जाता है। ट्रांसजीन वाहक जीवों को ट्रांसजेनिक जीव कहा जाता है।
- ट्रांसजेनिक पौधों को आनुवांशिक रूप से संशोधित पौधे भी कहा जाता है, जिनके जीनोम में संशोधन किया जाता है, जैसे कि किसी अन्य प्रजाति से एक या अधिक जीनों की प्रवेश द्वारा आनुवांशिक इंजीनियरिंग तकनीकों के माध्यम से।
- आनुवांशिक रूपांतरण की मूल आवश्यकता एक आनुवांशिक वाहन का निर्माण है, जो रुचि के जीनों को आवश्यक नियामक अनुक्रमों जैसे प्रोमोटर या टर्मिनेटर से घिरा हुआ वहन करता है। जीन स्थानांतरण के लिए सबसे अधिक प्रयुक्त तकनीकें दो प्रकार की होती हैं: वेक्टर-आधारित या अप्रत्यक्ष जीन स्थानांतरण और वेक्टर-रहित या प्रत्यक्ष जीन स्थानांतरण।
- वेक्टर-आधारित या अप्रत्यक्ष जीन स्थानांतरण में एग्रोबैक्टीरियम ट्यूमिफेशियंस का उपयोग कर रूपांतरण, इन प्लांटा रूपांतरण, पौधा वायरस-आधारित स्थानांतरण शामिल हैं जबकि वेक्टर-रहित या प्रत्यक्ष जीन स्थानांतरण में कण बमबार्डमेंट, प्रोटोप्लास्ट रूपांतरण और सूक्ष्म इंजेक्शन शामिल हैं।
- ट्रांसजेनिक जानवर वे जानवर होते हैं जिनकी आनुवांशिक संरचना को विभिन्न आनुवांशिक इंजीनियरिंग तकनीकों जैसे डीएनए प्रोन्यूक्लियर सूक्ष्म इंजेक्शन, भ्रूणीय स्टेम सेल-आधारित जीन स्थानांतरण और रेट्रोवायरस-आधारित जीन स्थानांतरण द्वारा रूपांतरित किया गया हो।
- ट्रांसजेनिक पौधों को फसल पौधों और उत्पादों में सुधारित कृषि लक्षणों के साथ विकसित किया गया है, उदाहरण के लिए, जैविक और अजैविक तनावों के प्रति प्रतिरोध, पोषक तत्व गुणवत्ता और फलों की पकने में देरी आदि।
- ट्रांसजेनिक पौधों का उपयोग औद्योगिक और चिकित्सीय उत्पादों के बड़े पैमाने पर उत्पादन के लिए आण्विक खेती में किया जाता है।
- ट्रांसजेनिक जानवरों का उपयोग भी आण्विक फार्मिंग में प्रोटीनों के बड़े पैमाने पर उत्पादन के लिए किया गया है, जैसे कि a1-एंटीट्रिप्सिन, मानव a-लैक्टल्ब्यूमिन आदि। ट्रांसजेनिक जानवरों का विकास पर्यावरणीय लाभों और अनुसंधान उद्देश्यों के लिए किया गया है।
- जीएमओ के उपयोग से संबंधित मानव स्वास्थ्य और पर्यावरण पर कई चिंताएं हैं। पर्यावरण, वन और जलवायु परिवर्तन मंत्रालय द्वारा स्थापित आनुवांशिक इंजीनियरिंग अनुमोदन समिति (GEAC) खतरनाक सूक्ष्मजीवों के निर्माण, उपयोग, आयात, निर्यात को नियंत्रित करती है।
- जीन थेरेपी एक ऐसी तकनीक है जिसे मानवों में खराब जीनों को सुधारने के लिए डिज़ाइन किया गया है ताकि कोशिकाओं के अंदर सही आनुवांशिक सामग्री को पेश किया जा सके। जीन थेरेपी के लिए तीन मुख्य दृष्टिकोण हैं: (i) जीन प्रतिस्थापन / जीन जोड़ना, (ii) जीन अवरोधन और (iii) जीन मरम्मत / जीन संपादन।
- चूंकि जीन थेरेपी शरीर के मूलभूत जीन समूह में परिवर्तन करती है, इसलिए यह अद्वितीय नैतिक विचारों को जन्म देती है।
- मारे गए या कमजोर किए गए रोगजनकों या उनके घटकों की तैयारी जो प्रतिरक्षा प्रतिक्रिया उत्पन्न करने के लिए दी जाती है और बाद में संक्रामक एजेंट को पहचानकर रोग से सुरक्षा प्रदान करती है, को ‘वैक्सीन’ कहा जाता है।
- पारंपरिक वैक्सीनों द्वारा उठाई गई कई संभावित चिंताओं जैसे कि टॉक्सॉयड्स के उनके विषैले रूपों में पलटने, या अवांछनीय घटकों के सह-शुद्धिकरण और पर्याप्त मात्रा में शुद्ध प्रतिजन घटकों को प्राप्त करने में शामिल जटिलता को दूर करने के लिए, आरडीएनए तकनीकों के विभिन्न उपकरणों का उपयोग करके पुनः संयोजित वैक्सीनों का विकास किया गया।
- पुनः संयोजित वैक्सीनों के तीन मुख्य प्रकार हैं: जीवित आनुवांशिक रूप से संशोधित वैक्सीन, पुनः संयोजित उपइकाई वैक्सीन और आनुवांशिक/डीएनए वैक्सीन।
- आरडीएनए तकनीक स्वास्थ्य देखभाल को सक्षम बनाती है क्योंकि यह विविध सुरक्षित, शुद्ध और प्रभावी चिकित्सीय एजेंटों जैसे कि दवाओं: मोनोक्लोनल एंटीबॉडीज, मानव प्रोटीन उदाहरण के लिए इंसुलिन, HGH के बड़े पैमाने पर जैविक उत्पादन को सुविधाजनक बनाती है।
- आरडीएनए तकनीक में प्रगति के साथ, यह संभव हो गया है कि माउस एंटीबॉडीज जिनमें कुछ मानव खंड होते हैं, जिन्हें काइमेरिक या मानवीकृत एंटीबॉडीज कहा जाता है, उच्च प्रभावकारिता और सक्रियता के साथ विकसित किए जा सकें।
- 1970 के दशक के अंत में, जैव रसायनज्ञों ने इंसुलिन के उत्पादन के लिए आरडीएनए तकनीक के विभिन्न उपकरणों का उपयोग किया। उन्होंने एक जीन लाइब्रेरी से इंसुलिन जीन को अलग किया और फिर इस जीन को $E$. coli के बैक्टीरियल प्लाज्मिड में सम्मिलित किया।
- पहली आनुवांशिक रूप से इंजीनियर मानव इंसुलिन जिसे ह्यूमुलिन ${ }^{\circledR}$ के रूप में विपणन किया गया, 1982 में निर्मित की गई। मानव इंसुलिन का सफल उत्पादन बिना किसी अस्पष्टता के इस बात को सिद्ध करता है कि विविध जैविक जीवों को आनुवांशिक रूप से इंजीनियर करके औषधीय और चिकित्सीय उपयोग के लिए मानव प्रोटीन उत्पन्न करना संभव है।
- डीएनए तकनीशियन अब मानव वृद्धि हार्मोन को पूरी तरह से आरडीएनए तकनीक का उपयोग करके उत्पन्न कर सकते हैं। 1985 में, आनुवांशिक रूप से इंजीनियर मानव वृद्धि हार्मोन का उत्पादन किया गया और इसे ह्यूमाट्रोप ${ }^{\oplus}$ और प्रोट्रोपिन ${ }^{\circledR}$ के रूप में विपणन किया गया।
अभ्यास
1. DNA फिंगरप्रिंटिंग से आपका क्या तात्पर्य है? RFLP के माध्यम से इसकी व्याख्या कीजिए।
2. GMO क्या होते हैं? ट्रांसजेनिक पादपों के विकास की विधि का वर्णन कीजिए।
3. जीन ट्रांसफर की प्रत्यक्ष और अप्रत्यक्ष विधियों के बीच अंतर बताइए। डाइकोट पादपों में जीन ट्रांसफर के लिए उपयुक्त एक अप्रत्यक्ष विधि का नाम लिखिए।
4. आण्विक फार्मिंग क्या है? आण्विक फार्मिंग में ट्रांसजेनिक जानवरों के अनुप्रयोग दीजिए।
5. जीन गन और जीन थेरेपी के बीच अंतर बताइए।
6. पुनः संयोजन उपइकाई टीकों के विकास की प्रक्रिया दीजिए।
7. DNA टीकों पर एक संक्षिप्त टिप्पणी लिखिए।
8. हाइब्रिडोमा प्रौद्योगिकी द्वारा विकसित मोनोक्लोनल एंटीबॉडीज की तुलना में rDNA प्रौद्योगिकी द्वारा विकसित मोनोक्लोनल एंटीबॉडीज के लाभों का वर्णन कीजिए।
9. rDNA प्रौद्योगिकी के माध्यम से ह्यूमुलिन के विकास का संक्षिप्त वर्णन कीजिए।
10. ह्यूमाट्रोप और प्रोट्रोपिन पर एक संक्षिप्त टिप्पणी लिखिए।
11. फसल सुधार में rDNA प्रौद्योगिकी के अनुप्रयोगों का संक्षिप्त वर्णन कीजिए।
12. ट्रांसजेनिक जानवरों के उपयोग से संबंधित नैतिक मुद्दों की सूची बनाइए।
13. पुनः संयोजन टीके के विकास में वैक्सीनिया वायरस की क्या भूमिका है?
14. पुनः संयोजन चिकित्सीय एजेंटों पर एक संक्षिप्त टिप्पणी लिखिए।
15. मानवीकृत एंटीबॉडीज पर एक सं्षिप्त टिप्पणी लिखिए।
16. अभिकथन: हाइब्रिडोमा प्रौद्योगिकी में, B कोशिकाओं को माइलोमा कोशिकाओं के साथ संलग्न किया जाता है।
कारण: माइलोमा कोशिकाएं अमर होती हैं।
(a) अभिकथन और कारण दोनों सत्य हैं और कारण अभिकथन का सही व्याख्या है।
(b) दोनों कथन और कारण सत्य हैं, लेकिन कारण कथन का सही स्पष्टीकरण नहीं है।
(c) कथन सत्य है, लेकिन कारण असत्य है।
(d) दोनों कथन और कारण असत्य हैं।
17. कथन: ह्यूमुलिन में पॉलीपेप्टाइड A और पॉलीपेप्टाइड B डाइसल्फाइड सेतुओं से जुड़े होते हैं।
कारण: जैविक रूप से सक्रिय इंसुलिन बनाने के लिए प्रोइंसुलिन से C पेप्टाइड को हटाया जाता है।
(a) दोनों कथन और कारण सत्य हैं और कारण कथन का सही स्पष्टीकरण है।
(b) दोनों कथन और कारण सत्य हैं, लेकिन कारण कथन का सही स्पष्टीकरण नहीं है।
(c) कथन सत्य है, लेकिन कारण असत्य है।
(d) दोनों कथन और कारण असत्य हैं।
18. डीएनए फिंगरप्रिंटिंग विशिष्ट की पहचान पर निर्भर करती है:
(a) कोडिंग अनुक्रम
(b) नॉन-कोडिंग अनुक्रम
(c) mRNA
(d) प्रोमोटर
19. डीएनए का छोटा खंड जो किसी नमूने में पूरक अनुक्रमों की पहचान करने के लिए प्रयोग किया जाता है, कहलाता है:
(a) प्रोब
(b) मार्कर
(c) VNTR
(d) मिनीसैटेलाइट
20. परिवर्तनीय संख्या टैंडेम रिपीट (VNTR) होते हैं:
(a) दोहराव वाले कोडिंग छोटे डीएनए अनुक्रम
(b) अदोहराव वाले नॉन-कोडिंग छोटे डीएनए अनुक्रम
(c) दोहराव वाले नॉन-कोडिंग छोटे डीएनए अनुक्रम
(d) अदोहराव वाले कोडिंग छोटे डीएनए अनुक्रम
21. Cry जीन या Bt जीन प्राप्त किए जाते हैं:
(a) कपास के कीट से
(b) तंबाकू के पौधे से
(c) बेसिलस थुरिंजिएंसिस से
(d) ई. कोलाई से
22. जब जीन थेरेपी सोमैटिक कोशिकाओं में की जाती है, तो यह $ \qquad $ होती है।
(a) अनुवांशिक नहीं
(b) अनुवांशिक
(c) दुर्लभ रूप से अनुवांशिक
(d) अनुवांशिकता से संबंधित नहीं
23. जीन वृद्धि चिकित्सा में, आनुवंशिक पदार्थ $ \qquad $ होता है।
(a) संशोधित
(b) प्रतिस्थापित
(c) दबाया
(d) हटाया
24. जर्म कोशिका चिकित्सा का उपयोग यदि किया जाता है तो
(a) RBC
(b) पेट की कोशिकाओं
(c) अंडाणु कोशिकाओं
(d) अस्थि मज्जा कोशिकाओं
25. पहली बार किस जानवर से टीकाकरण के लिए पदार्थ अलग किया गया था?
(a) बिल्ली
(b) गाय
(c) बकरी
(d) घोड़ा
26. टीकाकरण का आविष्कार किसने किया:
(a) जेनर
(b) पास्चर
(c) वाटसन
(d) क्रिक
27. rDNA प्रौद्योगिकी द्वारा इंसुलिन के उत्पादन के लिए किस जीवाणु का उपयोग किया गया था?
(a) सैकरोमाइसिस
(b) राइज़ोबियम
(c) एशेरिशिया
(d) माइकोबैक्टीरियम
28. आनुवंशिक इंजीनियरिंग द्वारा बनाया गया इंसुलिन कहलाता है
(a) ह्यूमुलिन
(b) प्रोमुलिन
(c) बोवुलिन
(d) प्रोक्युलिन
29. एकल प्रतिरक्षी (मोनोक्लोनल) एंटीबॉडी उत्पन्न किए जाते हैं
(a) उत्परिवर्तनों द्वारा
(b) ट्रांस्फेक्शन द्वारा
(c) हाइब्रिडोमा प्रौद्योगिकी द्वारा
(d) RNA हस्तक्षेप द्वारा



